
- •Предмет и метод термодинамики. Термодинамика, как теоретическая основа теплоэнергетики и теплотехники
- •Основные понятия и определения термодинамики. Параметры состояния.
- •Основные законы идеальных газов. Уравнения состояния идеальных газов.
- •Газовые смеси
- •Теплоемкость газов и газовых смесей, их определение.
- •Первый закон термодинамики и его математические выражения
- •Энтропия как функция состояния и её смысл.
- •Второй закон термодинамики и его математические выражения.
- •Исследования изохорного процесса идеальных газов.
- •Исследование изобарного процесса идеальных газов.
- •Исследование адиабатного процесса идеальных газов
- •Исследования изотермического процесса идеальных газов.
- •Исследования политропного процесса идеальных газов
- •Эксергия, её свойства и физический смысл
- •Дифференциальные уравнения внутренней энергии и энтальпии
- •Дифференциальные уравнения энтропии и теплоемкости
- •Потенциальные функции
- •Уравнения состояния реальных газов
- •Уравнение Ван-дер-Ваальса и его анализ. Критическое состояние вещества
- •Пары, общие понятия и определения. Процесс парообразования.
- •Дифференциальное соотношение Клапейрона-Клаузуиса. Применение
- •Паровые процессы и их расчет Циклы пту. Общая характеристика. Цикл Ренкина и его анализ.
- •Влияния начальных и конечных параметров пара на эффективность пту
- •Цикл пту с промежуточным перегревом пара
- •Циклы теплофикационных паротурбинных установок
- •Циклы холодильных машин и тепловых насосов
- •Циклы ядерных энергетических установок
- •Циклы бинарных энергетических установок
- •Эксергия, её свойства и физический смысл
- •Циклы ядерных энергетических установок
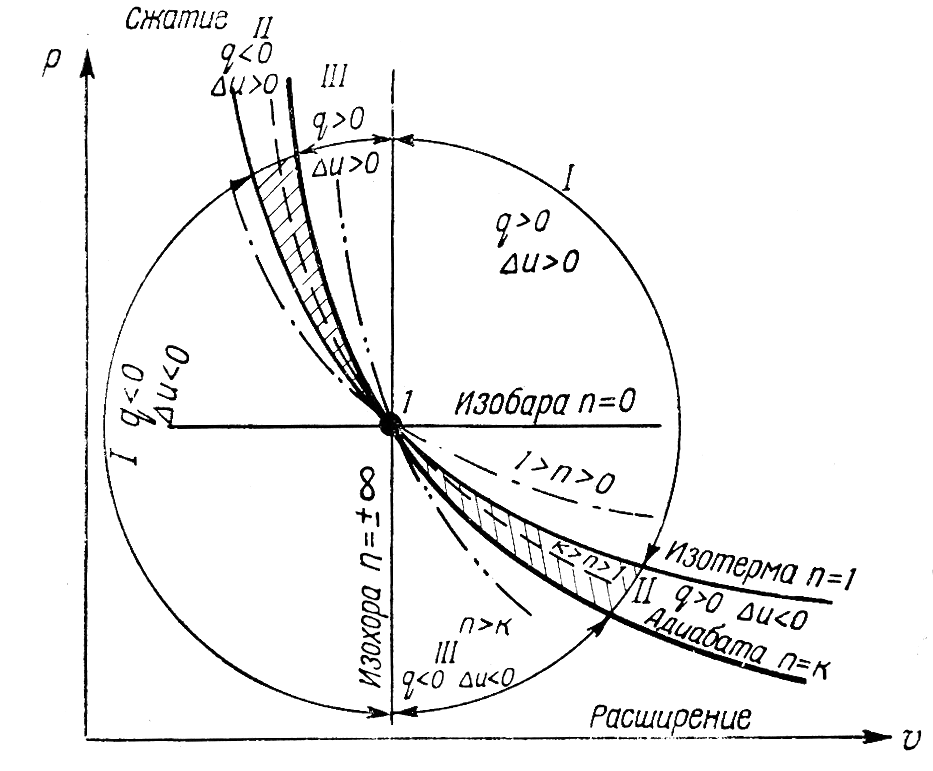
Исследования политропного процесса идеальных газов
Политропный процесс — термодинамический
процесс, во время которого удельная
теплоёмкость c газа остаётся неизменной.
Величина
![]() называется
показателем политропы. Частными явлениями
политропного процесса являются
изопроцессы и адиабатный процесс.
Уравнение
называется
показателем политропы. Частными явлениями
политропного процесса являются
изопроцессы и адиабатный процесс.
Уравнение
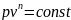 .
n=0 изобарный, n=±∞
изохорный , n=1 изотермический,
n=k адиабатный.
.
n=0 изобарный, n=±∞
изохорный , n=1 изотермический,
n=k адиабатный.
Уравнения те же что и для адиабатного, только показатель адиабаты меняется на показатель политропы.
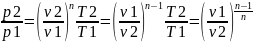 Уравнения внешней работы примут вид
Уравнения внешней работы примут вид
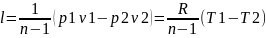 .
Изменение внутренней энергии определяют
из уравнения ∆u=сV(T2-T1).
.
Изменение внутренней энергии определяют
из уравнения ∆u=сV(T2-T1).
Теплоемкость
газа может быть получена из первого
начала термодинамики q=∆u+l/
Теплоту определяют из уравнения
q=с(T2-T1).
 ,
откуда
,
откуда
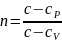 .
Коэффициент α=
.
Коэффициент α= .
.
Форма и расположение политроп зависят от n, чем больше n тем круче политропа. Все процессы политропы выше изотермы протекают с увеличением внутренней энергии газа, и наоборот. Процессы политропы которых расположены выше адиабаты протекают с подводом тепла к газу, и наоборот.
Эксергия, её свойства и физический смысл
Эксергия - ergon - работа, сила, и приставки ex, означающей «из», «вне». – свойство термодинамической системы или потока энергии, определяемое количеством работы, которое может быть получено внешним приемником энергии при обратимом их взаимодействии с окружающей средой до установления полного равновесия. При определении эксергии объект рассмотрения включает самую систему (или поток энергии), окружающую среду, меру эксергии (работу), отдаваемую внешнему приемнику энергии, и те объекты внешней среды, которые могут служить приемником энергии.
если в изолированной тд системе протекают необратимые процессы то ds>0,т.к. q=0 =>энтропия системы растет.энергия системы остается не изменой,а “качество”(способность к преобразованию в др виды снижается) При определении эксергии объект рассмотрения включает самую систему (или поток энергии), окружающую среду, меру эксергии (работу), отдаваемую внешнему приемнику энергии, и те объекты внешней среды, которые могут служить приемником энергии.EX-полная(Дж)ех-удельная(Дж/кг) ВИДЫ:-теплоты тела(системы)с постоянной Т,с переменной Т;открытой(поточной системы);закрытой(квазистатической)системы
Физический смысл-раскрывается формулой Гюи-Стодальта(∆ехq=TOC ∆Sсист)Под энтропией понимаеся тд параметр состояния системы,увеличение которого при протекании в системе необратимых процессов прямопропорц уменьшению эксергии этой системы
СВОЙСТВА:1)определяется параметрами состояния системы и ОС
2)Преобразуемость в др.виды не ограниченна
3)Запас уменьшается до0 при протекании необратимых процессов
4)эксергия ОС -> 0
Эксергия теплоты, потока и квазистатической системы
Эксергия теплоты
П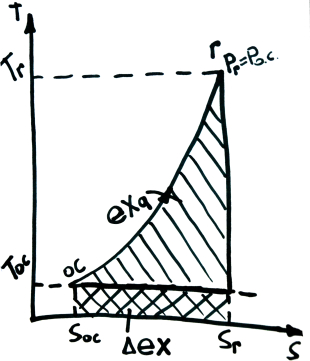 роцесс
нагрева газов при сжигании топлива(изобарный
Р=const,
q=Cp(Tг-Toc),∆S=CpLn(Tг\Toc))Tcp=q\∆S=
роцесс
нагрева газов при сжигании топлива(изобарный
Р=const,
q=Cp(Tг-Toc),∆S=CpLn(Tг\Toc))Tcp=q\∆S=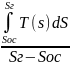 =
=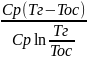
Эксергия теплоты тела
с переменной Т:ехqT=Voc=q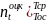 =q(1-
=q(1-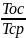 )=q(1-
)=q(1-
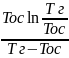 )
)
ехqT=Voc
=q(1-
)=q- =q-
Toc∆Sсист=q-∆ех
=q-
Toc∆Sсист=q-∆ех
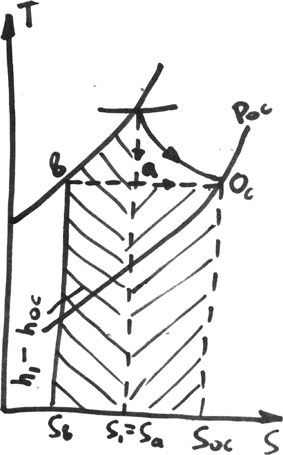
эксергия потока
-
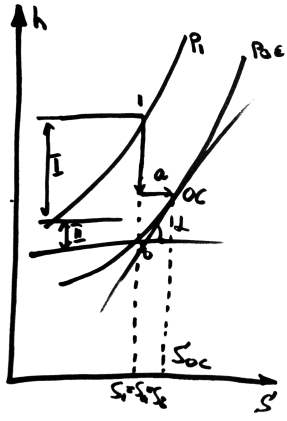 ->-необратимый
переход - >обратимый
->-необратимый
переход - >обратимый
1-а-oc- обр.переход системы в состояние равновесия с ОС
1-а-изоэнтропное расширение раб тела до темпер ОС
а-ос- изотермич расширение до состояния ОС
Lmax=ex=l’1-a +l’1-oc =(h1-ha)+Toc(Soc-Sa)= h1-hoc -Toc(S1-Soc)=h1-hb; hа-hoc, Sa=S1
tgα=
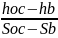 =
= )p
=
)p
=
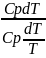 =T;
hoc-hb= Toc(Soc-S1); в точке
b ех=0
=T;
hoc-hb= Toc(Soc-S1); в точке
b ех=0
квазистатической системы
1-а- изоэнтропное расширение до t ОС
а-oc- изотермическое расширение раб тела до сост-я равновесия с ос
0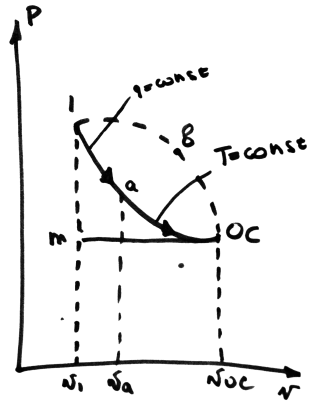 С-b
– изобарный процесс перевода системы
к изначальному(работа против внеш.сил)
С-b
– изобарный процесс перевода системы
к изначальному(работа против внеш.сил)
L max=ex= l1-a +la-oc+ loc-1 =(U1-Ua)+ Toc(Soc-Sa)+Poc(Vb-Voc)= (U1-Uoc)+ Poc(Vb-Voc)- Toc(S1-Soc)
Дифференциальные уравнения термодинамики, их значения.
Термодинамика широко использует разработанный математический аппарат дифференциальных уравнений в частных производных. Это позволяет получить количественные соотношения между различными термодинамическими параметрами и их производными для любых моделей реальных газов. С другой стороны давно уже применяются для составления уравнений состояния газов и паров на основе обработки экспериментальных данных по различным физическим величинам. Большое практическое значение в том, что позволяет расчетным путем определять те величины, которые не могут быть измерены непосредственно в опытах, например энтропию. Т.о. теория дифф уравнений – общая термодинамическая теория, для решения прикладных задач.
Соотношения
между частными производными термических
параметров состояния и энтропии были
получены Максвеллом. Объединенное
выражение 1 и 2 закона– термодинамическое
тождество
 .
Представим внутреннюю энергию, как
функцию любых двух из четырех независимых
переменных (P,v,T,S), обозначая их через x1
и x2.
.
Представим внутреннюю энергию, как
функцию любых двух из четырех независимых
переменных (P,v,T,S), обозначая их через x1
и x2.
 и
и
 Продифференц 1е по x2, а
второе по x1.
Продифференц 1е по x2, а
второе по x1.
 и
и
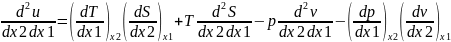 .
приравняем правые части. Подставим
вместо x1 и x2
параметры v и S.
Очевидно, что
.
приравняем правые части. Подставим
вместо x1 и x2
параметры v и S.
Очевидно, что
 .
Тогда
.
Тогда

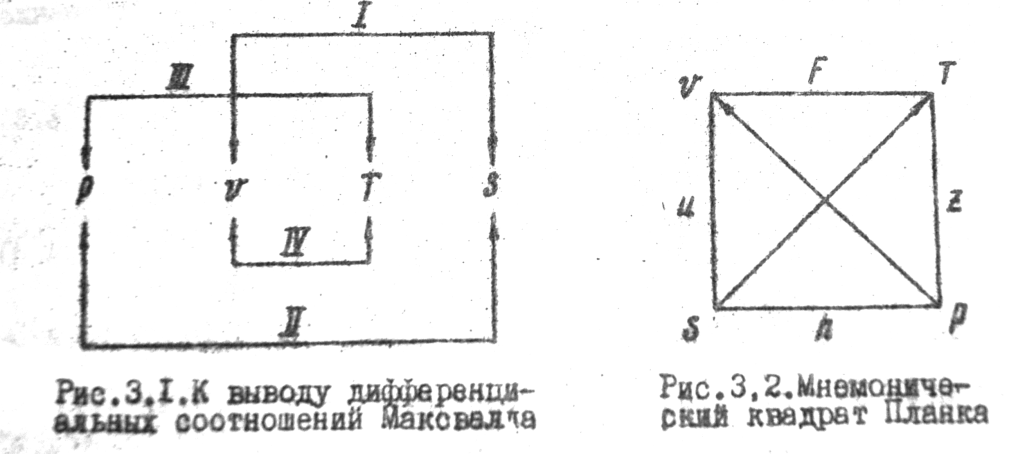
Производные формируются при обходе двух любых противоположных сторон квадрата. Диагональ соединяющая начальный угол обхода с противоположным указывает постоянный параметр и знак производной (если перемещение по диагонали совпадает с направлением стрелки +, нет-)
