
- •Предмет и метод термодинамики. Термодинамика, как теоретическая основа теплоэнергетики и теплотехники
- •Основные понятия и определения термодинамики. Параметры состояния.
- •Основные законы идеальных газов. Уравнения состояния идеальных газов.
- •Газовые смеси
- •Теплоемкость газов и газовых смесей, их определение.
- •Первый закон термодинамики и его математические выражения
- •Энтропия как функция состояния и её смысл.
- •Второй закон термодинамики и его математические выражения.
- •Исследования изохорного процесса идеальных газов.
- •Исследование изобарного процесса идеальных газов.
- •Исследование адиабатного процесса идеальных газов
- •Исследования изотермического процесса идеальных газов.
- •Исследования политропного процесса идеальных газов
- •Эксергия, её свойства и физический смысл
- •Дифференциальные уравнения внутренней энергии и энтальпии
- •Дифференциальные уравнения энтропии и теплоемкости
- •Потенциальные функции
- •Уравнения состояния реальных газов
- •Уравнение Ван-дер-Ваальса и его анализ. Критическое состояние вещества
- •Пары, общие понятия и определения. Процесс парообразования.
- •Дифференциальное соотношение Клапейрона-Клаузуиса. Применение
- •Паровые процессы и их расчет Циклы пту. Общая характеристика. Цикл Ренкина и его анализ.
- •Влияния начальных и конечных параметров пара на эффективность пту
- •Цикл пту с промежуточным перегревом пара
- •Циклы теплофикационных паротурбинных установок
- •Циклы холодильных машин и тепловых насосов
- •Циклы ядерных энергетических установок
- •Циклы бинарных энергетических установок
- •Эксергия, её свойства и физический смысл
- •Циклы ядерных энергетических установок
Уравнения состояния реальных газов
Хотя модель идеального газа хорошо описывает поведение реальных газов при низких давлениях и высоких температурах, в более экстремальных условиях её согласие с опытом гораздо хуже. В частности, это проявляется в том, что реальные газы могут быть переведены в жидкое и даже в твердое состояние, а идеальные — не могут. Для более точного описания поведения реальных газов при низких температурах была создана модель газа Ван-дер-Ваальса, вводящая поправку на конечный диаметр молекулы и на притяжение молекул на больших расстояниях (напомним, что в идеальных газах частицы считаются точечными и никак не взаимодействуют на расстоянии). Термическим уравненим состояния (называется связь между давлением, объемом и температурой. Для одного моля газа Ван-дер-Ваальса оно имеет вид:
В![]() идно,
что это уравнение фактически является
уравнением состояния идеального газа
с двумя поправками. Поправка a учитывает
притяжение молекул, поправка b — конечный
объем молекулы.
идно,
что это уравнение фактически является
уравнением состояния идеального газа
с двумя поправками. Поправка a учитывает
притяжение молекул, поправка b — конечный
объем молекулы.
Уравнение
ВДВ качественно хорошо описывает
свойство реальных газов паров, но не
удовлетворяет практическим целям с
количественной точки зрения, особенно
при высоких давлениях и низких
температурах. Оно легло в основу
нескольких других уравнений, более
точных. Уравнение Беркла, Дитеричи,
Редлиха-Квонга
 Более точным является многопараметрическое
уравнение состояния. К таким уравнениям
относят уравнение Битти-Бриджи, уравнение
Казавинского, уравнение Беннедикта-Вебба-Рубина,
Мартини-Лод.
Более точным является многопараметрическое
уравнение состояния. К таким уравнениям
относят уравнение Битти-Бриджи, уравнение
Казавинского, уравнение Беннедикта-Вебба-Рубина,
Мартини-Лод.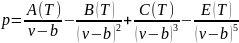 Для описания свойств воды и водяного
пара особенно в области перегретого
состояния 2 физиками было разработано
уравнение состояния на основе теории
ассоциации молекулы воды.
Для описания свойств воды и водяного
пара особенно в области перегретого
состояния 2 физиками было разработано
уравнение состояния на основе теории
ассоциации молекулы воды.
Уравнение Ван-дер-Ваальса и его анализ. Критическое состояние вещества
Уравнение состояния газа Ван-дер-Ваальса — уравнение, связывающее основные термодинамические величины в модели газа Ван-дер-Ваальса. Хотя модель идеального газа хорошо описывает поведение реальных газов при низких давлениях и высоких температурах, в более экстремальных условиях её согласие с опытом гораздо хуже. В частности, это проявляется в том, что реальные газы могут быть переведены в жидкое и даже в твердое состояние, а идеальные — не могут. Для более точного описания поведения реальных газов при низких температурах была создана модель газа Ван-дер-Ваальса, вводящая поправку на конечный диаметр молекулы и на притяжение молекул на больших расстояниях (напомним, что в идеальных газах частицы считаются точечными и никак не взаимодействуют на расстоянии). Термическим уравненим состояния (называется связь между давлением, объемом и температурой. Для одного моля газа Ван-дер-Ваальса оно имеет вид:
В
идно,
что это уравнение фактически является
уравнением состояния идеального газа
с двумя поправками. Поправка a учитывает
притяжение молекул, поправка b — конечный
объем молекулы.Для ν молей газа
Ван-дер-Ваальса уравнение состояния
выглядит так:
![]() Уравнение можно переписать так, чтобы
выразить в явном виде давление
Уравнение можно переписать так, чтобы
выразить в явном виде давление
![]() или объем
или объем
![]() Уравнение содержит объем в третьей
степени и, следовательно, имеет или три
действительных корня, или один
действительный и два мнимых. При высоких
температурах уравнение имеет один
действительный корень, и по мере повышения
температуры кривые, вычисленные по
уравнению Ван-дер-Ваальса, приближаются
к гиперболам, соответствующим уравнению
состояния идеального газа.
Уравнение содержит объем в третьей
степени и, следовательно, имеет или три
действительных корня, или один
действительный и два мнимых. При высоких
температурах уравнение имеет один
действительный корень, и по мере повышения
температуры кривые, вычисленные по
уравнению Ван-дер-Ваальса, приближаются
к гиперболам, соответствующим уравнению
состояния идеального газа.
Принципиальное значение уравнения Ван-дер-Ваальса определяется следующими обстоятельствами:
1) уравнение было получено из модельных представлений о свойствах реальных газов и жидкостей, а не явилось результатом эмпирического подбора функции f(p,V,T), описывающей свойства реальных газов;
2) уравнение долго рассматривалось как некоторый общий вид уравнения состояния реальных газов, на основе которого было построено много других уравнений состояния
3) с помощью уравнения Ван-дер-Ваальса впервые удалось описать явление перехода газа в жидкость и проанализировать критические явления. В этом отношении уравнение Ван-дер-Ваальса имеет преимущество даже перед более точными уравнениями в вириальной форме
Критическое состояние вещества: Как известно, уравнение состояния устанавливает функциональную связь между p, V, T и числом молей n газа в состоянии равновесия. Самым простым и известным уравнением состояния является уравнение состояния идеального газа: pV = nRT. Реальные газы описываются уравнением состояния идеального газа только приближенно, и отклонения от идеального поведения становятся заметными при высоких давлениях и низких температурах, особенно когда газ близок к конденсации.
Критическое состояние –состояние вещества в точках фазовых переходов II рода. Критическое состояние, являющееся предельным случаем равновесия двухфазных систем, наблюдается в чистых веществах при равновесии жидкость — газ, а в растворах — при фазовых равновесиях газ — газ, жидкость — жидкость, жидкость — газ, твёрдое тело — твёрдое тело. На диаграммах состояния Критическое состояние соответствуют предельные точки на кривых равновесия фаз. С приближением к Критическое состояние различия в плотности, составе и др. свойствах сосуществующих фаз, а также теплота фазового перехода и межфазное поверхностное натяжение уменьшаются и в критической точке равны нулю. При приближении к Критическое состояние физические свойства вещества резко изменяются: теоретически неограниченно возрастает теплоёмкость и восприимчивость системы к внешним воздействиям (например, изотермическая сжимаемость в случае чистых жидкостей). Критическое состояние необходимо во многих областях науки и техники: при создании энергетических установок на сверхкритических параметрах, сверхпроводящих систем, установок для сжижения газов, разделения смесей и т. д.
