
- •Предмет и метод термодинамики. Термодинамика, как теоретическая основа теплоэнергетики и теплотехники
- •Основные понятия и определения термодинамики. Параметры состояния.
- •Основные законы идеальных газов. Уравнения состояния идеальных газов.
- •Газовые смеси
- •Теплоемкость газов и газовых смесей, их определение.
- •Первый закон термодинамики и его математические выражения
- •Энтропия как функция состояния и её смысл.
- •Второй закон термодинамики и его математические выражения.
- •Исследования изохорного процесса идеальных газов.
- •Исследование изобарного процесса идеальных газов.
- •Исследование адиабатного процесса идеальных газов
- •Исследования изотермического процесса идеальных газов.
- •Исследования политропного процесса идеальных газов
- •Эксергия, её свойства и физический смысл
- •Дифференциальные уравнения внутренней энергии и энтальпии
- •Дифференциальные уравнения энтропии и теплоемкости
- •Потенциальные функции
- •Уравнения состояния реальных газов
- •Уравнение Ван-дер-Ваальса и его анализ. Критическое состояние вещества
- •Пары, общие понятия и определения. Процесс парообразования.
- •Дифференциальное соотношение Клапейрона-Клаузуиса. Применение
- •Паровые процессы и их расчет Циклы пту. Общая характеристика. Цикл Ренкина и его анализ.
- •Влияния начальных и конечных параметров пара на эффективность пту
- •Цикл пту с промежуточным перегревом пара
- •Циклы теплофикационных паротурбинных установок
- •Циклы холодильных машин и тепловых насосов
- •Циклы ядерных энергетических установок
- •Циклы бинарных энергетических установок
- •Эксергия, её свойства и физический смысл
- •Циклы ядерных энергетических установок
Циклы бинарных энергетических установок
Чтобы увеличить среднюю температуру при подводе теплоты и этим повысить термический кпд цикла выгодно применить рабочее тело с высокой температурой насыщения при умеренных давлениях, однако такие рабочие тела не удовлетворяют требованиям получения низких температур при отводе теплоты из цикла. На примере ртутного пара. При обычном конечном давлении пары ртути имеют температуру более 200градусов, вода же 25-28. Поэтому бинарный цикл представляет интерес. В нем используют последовательно 2 рабочих тела, ртуть в области высоких температур, и воду в области низких.
Р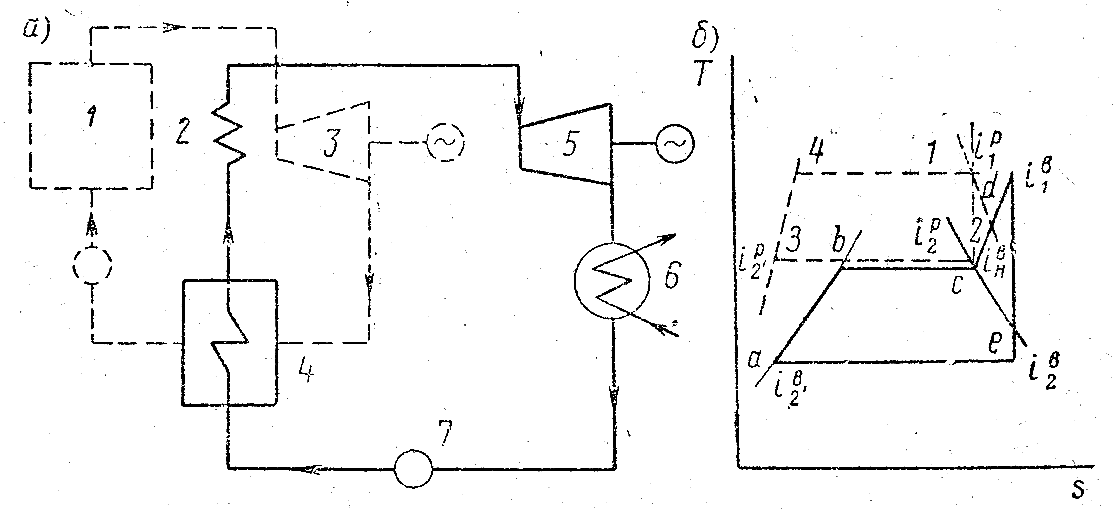 тутный
пар из котла 1 поступает в турбину 3, и
после расширения направляется в
конденсатор испаритель 4., здесь ртутный
пар при конденсации отдает свою теплоту
воде на образование водяного пара.
Жидкая ртуть возвращается насосом в
котел. Этим замыкается цикл ртути.
Водяной пар поступает в перегреватель
2, а далее в турбину 5, далее в конденсатор
6, оттуда насосом 7 возвращается в котел.
тутный
пар из котла 1 поступает в турбину 3, и
после расширения направляется в
конденсатор испаритель 4., здесь ртутный
пар при конденсации отдает свою теплоту
воде на образование водяного пара.
Жидкая ртуть возвращается насосом в
котел. Этим замыкается цикл ртути.
Водяной пар поступает в перегреватель
2, а далее в турбину 5, далее в конденсатор
6, оттуда насосом 7 возвращается в котел.
Как видно площадь бинарного цикла близка площади цикла Карно. Термический кпд ртутного цикла может достигать больших значений.
Применяя бинарные циклы можно значительно повысить экономичность паросиловой установки.
При изображении цикла ступень водяного пара построена для 1 кг, верхняя – для m килограмм ртутного пара.
Эксергия, её свойства и физический смысл
Эксергия - ergon - работа, сила, и приставки ex, означающей «из», «вне». – свойство термодинамической системы или потока энергии, определяемое количеством работы, которое может быть получено внешним приемником энергии при обратимом их взаимодействии с окружающей средой до установления полного равновесия. При определении эксергии объект рассмотрения включает самую систему (или поток энергии), окружающую среду, меру эксергии (работу), отдаваемую внешнему приемнику энергии, и те объекты внешней среды, которые могут служить приемником энергии.
если в изолированной тд системе протекают необратимые процессы то ds>0,т.к. q=0 =>энтропия системы растет.энергия системы остается не изменой,а “качество”(способность к преобразованию в др виды снижается) При определении эксергии объект рассмотрения включает самую систему (или поток энергии), окружающую среду, меру эксергии (работу), отдаваемую внешнему приемнику энергии, и те объекты внешней среды, которые могут служить приемником энергии.EX-полная(Дж)ех-удельная(Дж/кг) ВИДЫ:-теплоты тела(системы)с постоянной Т,с переменной Т;открытой(поточной системы);закрытой(квазистатической)системы
Физический смысл-раскрывается формулой Гюи-Стодальта(∆ехq=TOC ∆Sсист)Под энтропией понимаеся тд параметр состояния системы,увеличение которого при протекании в системе необратимых процессов прямопропорц уменьшению эксергии этой системы
СВОЙСТВА:1)определяется параметрами состояния системы и ОС
2)Преобразуемость в др.виды не ограниченна
3)Запас уменьшается до0 при протекании необратимых процессов
4)эксергия ОС -> 0
Эксергия теплоты, потока и квазистатической системы
Эксергия теплоты
П роцесс нагрева газов при сжигании топлива(изобарный Р=const, q=Cp(Tг-Toc),∆S=CpLn(Tг\Toc))Tcp=q\∆S= =
Эксергия теплоты тела с переменной Т:ехqT=Voc=q =q(1- )=q(1- )
ехqT=Voc =q(1- )=q- =q- Toc∆Sсист=q-∆ех
эксергия потока
- ->-необратимый переход - >обратимый
1-а-oc- обр.переход системы в состояние равновесия с ОС
1-а-изоэнтропное расширение раб тела до темпер ОС
а-ос- изотермич расширение до состояния ОС
Lmax=ex=l’1-a +l’1-oc =(h1-ha)+Toc(Soc-Sa)= h1-hoc -Toc(S1-Soc)=h1-hb; hа-hoc, Sa=S1
tgα= = )p = =T; hoc-hb= Toc(Soc-S1); в точке b ех=0
квазистатической системы
1-а- изоэнтропное расширение до t ОС
а-oc- изотермическое расширение раб тела до сост-я равновесия с ос
0 С-b – изобарный процесс перевода системы к изначальному(работа против внеш.сил)
L max=ex= l1-a +la-oc+ loc-1 =(U1-Ua)+ Toc(Soc-Sa)+Poc(Vb-Voc)= (U1-Uoc)+ Poc(Vb-Voc)- Toc(S1-Soc)
Уравнения состояния реальных газов
Хотя модель идеального газа хорошо описывает поведение реальных газов при низких давлениях и высоких температурах, в более экстремальных условиях её согласие с опытом гораздо хуже. В частности, это проявляется в том, что реальные газы могут быть переведены в жидкое и даже в твердое состояние, а идеальные — не могут. Для более точного описания поведения реальных газов при низких температурах была создана модель газа Ван-дер-Ваальса, вводящая поправку на конечный диаметр молекулы и на притяжение молекул на больших расстояниях (напомним, что в идеальных газах частицы считаются точечными и никак не взаимодействуют на расстоянии). Термическим уравненим состояния (называется связь между давлением, объемом и температурой. Для одного моля газа Ван-дер-Ваальса оно имеет вид:
В идно, что это уравнение фактически является уравнением состояния идеального газа с двумя поправками. Поправка a учитывает притяжение молекул, поправка b — конечный объем молекулы.
Уравнение ВДВ качественно хорошо описывает свойство реальных газов паров, но не удовлетворяет практическим целям с количественной точки зрения, особенно при высоких давлениях и низких температурах. Оно легло в основу нескольких других уравнений, более точных. Уравнение Беркла, Дитеричи, Редлиха-Квонга Более точным является многопараметрическое уравнение состояния. К таким уравнениям относят уравнение Битти-Бриджи, уравнение Казавинского, уравнение Беннедикта-Вебба-Рубина, Мартини-Лод. Для описания свойств воды и водяного пара особенно в области перегретого состояния 2 физиками было разработано уравнение состояния на основе теории ассоциации молекулы воды.
