
- •Предмет и метод термодинамики. Термодинамика, как теоретическая основа теплоэнергетики и теплотехники
- •Основные понятия и определения термодинамики. Параметры состояния.
- •Основные законы идеальных газов. Уравнения состояния идеальных газов.
- •Газовые смеси
- •Теплоемкость газов и газовых смесей, их определение.
- •Первый закон термодинамики и его математические выражения
- •Энтропия как функция состояния и её смысл.
- •Второй закон термодинамики и его математические выражения.
- •Исследования изохорного процесса идеальных газов.
- •Исследование изобарного процесса идеальных газов.
- •Исследование адиабатного процесса идеальных газов
- •Исследования изотермического процесса идеальных газов.
- •Исследования политропного процесса идеальных газов
- •Эксергия, её свойства и физический смысл
- •Дифференциальные уравнения внутренней энергии и энтальпии
- •Дифференциальные уравнения энтропии и теплоемкости
- •Потенциальные функции
- •Уравнения состояния реальных газов
- •Уравнение Ван-дер-Ваальса и его анализ. Критическое состояние вещества
- •Пары, общие понятия и определения. Процесс парообразования.
- •Дифференциальное соотношение Клапейрона-Клаузуиса. Применение
- •Паровые процессы и их расчет Циклы пту. Общая характеристика. Цикл Ренкина и его анализ.
- •Влияния начальных и конечных параметров пара на эффективность пту
- •Цикл пту с промежуточным перегревом пара
- •Циклы теплофикационных паротурбинных установок
- •Циклы холодильных машин и тепловых насосов
- •Циклы ядерных энергетических установок
- •Циклы бинарных энергетических установок
- •Эксергия, её свойства и физический смысл
- •Циклы ядерных энергетических установок
Энтропия как функция состояния и её смысл.
Энтропия—
понятие, впервые введенное в термодинамике
для определения меры необратимого
рассеивания энергии. является функцией
состояния термодинамической системы;
её существование постулируется вторым
началом термодинамики. Было впервые
введено в 1865 году Рудольфом Клаузиусом.
Он определил изменение энтропии
термодинамической системы при обратимом
процессе как отношение изменения общего
количества тепла ΔQ к величине абсолютной
температуры T:
![]() Эта
формула применима только для изотермического
процесса (происходящего при постоянной
температуре). Энтропия -- это функция
состояния, то есть любому состоянию
можно сопоставить вполне определенное
значение энтропии.
Эта
формула применима только для изотермического
процесса (происходящего при постоянной
температуре). Энтропия -- это функция
состояния, то есть любому состоянию
можно сопоставить вполне определенное
значение энтропии.
Её обобщение
на случай произвольного квазистатического
процесса выглядит так:
![]() где
dS - приращение (дифференциал) энтропии,
а δQ - бесконечно малое приращение
количества теплоты. Необходимо обратить
внимание на то, что рассматриваемое
термодинамическое определение применимо
только к квазистатическим процессам
(состоящим из непрерывно следующих друг
за другом состояний равновесия). Поскольку
энтропия является функцией состояния,
в левой части равенства стоит её полный
дифференциал. Напротив, количество
теплоты является функцией процесса, в
котором эта теплота была передана,
поэтому δQ считать полным дифференциалом
нельзя.
где
dS - приращение (дифференциал) энтропии,
а δQ - бесконечно малое приращение
количества теплоты. Необходимо обратить
внимание на то, что рассматриваемое
термодинамическое определение применимо
только к квазистатическим процессам
(состоящим из непрерывно следующих друг
за другом состояний равновесия). Поскольку
энтропия является функцией состояния,
в левой части равенства стоит её полный
дифференциал. Напротив, количество
теплоты является функцией процесса, в
котором эта теплота была передана,
поэтому δQ считать полным дифференциалом
нельзя.
Статистическое
определение энтропии: принцип Больцмана
В 1877 году Людвиг Больцман нашёл, что
энтропия системы может относиться к
количеству возможных «микросостояний»
(микроскопических состояний), согласующихся
с их термодинамическими свойствами.
Рассмотрим, например, идеальный газ в
сосуде. Микросостояние определено как
позиции и импульсы (моменты движения)
каждого составляющего систему атома.
Связность предъявляет к нам требования
рассматривать только те микросостояния,
для которых: (I) месторасположения всех
частей расположены в рамках сосуда,
(II) для получения общей энергии газа
кинетические энергии атомов суммируются.
Больцман постулировал, что:
![]() где
константу k=1,38•10–23 Дж/К мы знаем теперь
как постоянную Больцмана, а Ω является
числом микросостояний, которые возможны
в имеющемся макроскопическом состоянии
(статистический вес состояния). Этот
постулат, известный как принцип Больцмана,
может быть оценен как начало статистической
механики, которая описывает термодинамические
системы, используя статистическое
поведение составляющих их компонентов.
Принцип Больцмана связывает микроскопические
свойства системы (Ω) с одним из её
термодинамических свойств (S). Согласно
определению Больцмана, энтропия является
просто функцией состояния. Так как Ω
может быть только натуральным числом
(1,2,3,…), то энтропия Больцмана должна
быть положительной — исходя из свойств
логарифма.
где
константу k=1,38•10–23 Дж/К мы знаем теперь
как постоянную Больцмана, а Ω является
числом микросостояний, которые возможны
в имеющемся макроскопическом состоянии
(статистический вес состояния). Этот
постулат, известный как принцип Больцмана,
может быть оценен как начало статистической
механики, которая описывает термодинамические
системы, используя статистическое
поведение составляющих их компонентов.
Принцип Больцмана связывает микроскопические
свойства системы (Ω) с одним из её
термодинамических свойств (S). Согласно
определению Больцмана, энтропия является
просто функцией состояния. Так как Ω
может быть только натуральным числом
(1,2,3,…), то энтропия Больцмана должна
быть положительной — исходя из свойств
логарифма.
Второй закон термодинамики и его математические выражения.
ВНТ — физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами. ВНТ запрещает вечные двигатели второго рода, показывая, что невозможно всю внутреннюю энергию тела превратить в полезную работу. ВНТ является постулатом, не доказываемым в рамках термодинамики. Оно было создано на основе обобщения опытных фактов и получило многочисленные экспериментальные подтверждения. несколько эквивалентных формулировок: Постулат Клаузиуса: «Невозможен процесс, единственным результатом которого являлась бы передача тепла от более холодного тела к более горячему» Постулат Томсона: «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара» На понятии энтропии:«Энтропия изолированной системы не может уменьшаться» (закон неубывания энтропии).Такая формулировка основывается на представлении об энтропии как о функции состояния системы, что также должно быть постулировано. В состоянии с максимальной энтропией макроскопические необратимые процессы (а процесс передачи тепла всегда является необратимым из-за постулата Клаузиуса) невозможны.
Математические
выражения: 1.Для обратимого цикла
Карно
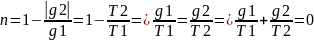 или
или
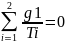 –
приведенная теплота i-го
изотермического процесса.
–
приведенная теплота i-го
изотермического процесса.
Рассмотрим
произвольный обратимый цикл. Когда
число циклов стремиться к бесконечности
получим
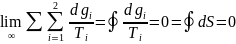 1 интеграл Клаузиуса математическое
выражение для обратимых процессов.
1 интеграл Клаузиуса математическое
выражение для обратимых процессов.
Рассмотрим
прямой необратимый цикл Карно.
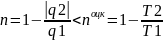 .
Необратимость цикла Карно может быть
внешней необратимостью, связанной с
наличием теплообмена.
.
Необратимость цикла Карно может быть
внешней необратимостью, связанной с
наличием теплообмена.
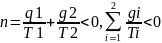 ,
,
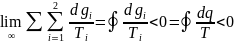 второй интеграл Клаузиуса.
второй интеграл Клаузиуса.
Для некруговых:
Вернем систему в исходное состояние
другим обратимым процессом 2-в-1.
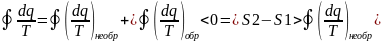 Переходя к б.м. =>
Переходя к б.м. =>
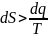 – для необратимых некруговых процессов
– для необратимых некруговых процессов
