
- •Предмет и метод термодинамики. Термодинамика, как теоретическая основа теплоэнергетики и теплотехники
- •Основные понятия и определения термодинамики. Параметры состояния.
- •Основные законы идеальных газов. Уравнения состояния идеальных газов.
- •Газовые смеси
- •Теплоемкость газов и газовых смесей, их определение.
- •Первый закон термодинамики и его математические выражения
- •Энтропия как функция состояния и её смысл.
- •Второй закон термодинамики и его математические выражения.
- •Исследования изохорного процесса идеальных газов.
- •Исследование изобарного процесса идеальных газов.
- •Исследование адиабатного процесса идеальных газов
- •Исследования изотермического процесса идеальных газов.
- •Исследования политропного процесса идеальных газов
- •Эксергия, её свойства и физический смысл
- •Дифференциальные уравнения внутренней энергии и энтальпии
- •Дифференциальные уравнения энтропии и теплоемкости
- •Потенциальные функции
- •Уравнения состояния реальных газов
- •Уравнение Ван-дер-Ваальса и его анализ. Критическое состояние вещества
- •Пары, общие понятия и определения. Процесс парообразования.
- •Дифференциальное соотношение Клапейрона-Клаузуиса. Применение
- •Паровые процессы и их расчет Циклы пту. Общая характеристика. Цикл Ренкина и его анализ.
- •Влияния начальных и конечных параметров пара на эффективность пту
- •Цикл пту с промежуточным перегревом пара
- •Циклы теплофикационных паротурбинных установок
- •Циклы холодильных машин и тепловых насосов
- •Циклы ядерных энергетических установок
- •Циклы бинарных энергетических установок
- •Эксергия, её свойства и физический смысл
- •Циклы ядерных энергетических установок
Теплоемкость газов и газовых смесей, их определение.
Теплоемкость – количество тепла, которое нужно затратить для нагрева единицы количества вещества на 1 градус. Абсолютная теплоемкость [C][Дж/К]. Теплоемкость зависит от внешних условий или характера процесса, зависит от рода газа или газов смеси, количественного состава смеси. ТЕПЛОЕМКОСТИ ИДЕАЛЬНЫХ ГАЗОВ ОТ ДАВЛЕНИЯ НЕ ЗАВИСЯТ. Теплоемкость единицы количества вещества называют удельной теплоемкостью. Теплоемкость – экстенсивная величина, удельная теплоемкость – интенсивная. В зависимости от выбранной количественной единицы различают удельную массовую теплоемкость, отнесенную к 1 кг [c][Дж/кг*К], удельную объемную теплоемкость, отнесенную к 1 м3 [c’][Дж/м3*К] и мольную теплоемкость, отнесенную к 1 моль газа, [cμ][Дж/моль*К].
Теплоемкость
не является постоянной величиной. Она
изменяется с изменением температуры,
причем в ряде случаев эта зависимость
может быть значительной. Поэтому
теплоемкость, определяемую соотношением
 называют средней теплоемкостью, в
отличие от так называемой истинной
теплоемкости, которую определяют как
производную от количества тепла,
подводимого к телу в процессе его
нагрева, по температуре этого тела.
называют средней теплоемкостью, в
отличие от так называемой истинной
теплоемкости, которую определяют как
производную от количества тепла,
подводимого к телу в процессе его
нагрева, по температуре этого тела.
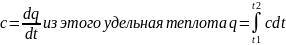 .
Если изобразить графически
зависимость кол-ва тепла от температуры,
линия q будет не прямой.
Средняя теплоемкость на графике может
быть найдена как тангенс угла между
секущей, через точки 1,2 и осью абсцисс
–tgβ. А истинные теплоемкость
в 1 и 2 – tgα1 и – tgα2.
зНая зависимость истинной теплоемкость
от температуры можно определить среднюю
теплоемкость в данном интервале
температур
.
Если изобразить графически
зависимость кол-ва тепла от температуры,
линия q будет не прямой.
Средняя теплоемкость на графике может
быть найдена как тангенс угла между
секущей, через точки 1,2 и осью абсцисс
–tgβ. А истинные теплоемкость
в 1 и 2 – tgα1 и – tgα2.
зНая зависимость истинной теплоемкость
от температуры можно определить среднюю
теплоемкость в данном интервале
температур
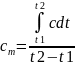 /
/
В зависимости от характера процесса подвода тепла, количество тепла, которое необходимо подвести для +T на 1 градус будет различным. Поэтому надо понимать, о каком процессе подвода тепла идет речь. нАиболее часто на практике используют теплоемкости изобарного и изохорного процессов. Зависимости: cp-cv=R; cp/cv=k-показатель адиабаты.(1,67;1,40;1,33)
Теплоемкость
смеси заданной массовыми долями:
 ,
объемными долями
,
объемными долями
 ,
мольными
,
мольными

Первый закон термодинамики и его математические выражения
Общий закон сохранения и превращения энергии применительно к термодинамическим системам, в которых участвуют теплота и работа, называется П.З.Т. Согласно закону, энергия не создается и не уничтожается, различные формы энергии могут превращаться друг в друга, но в строго эквивалентных соотношениях. Сформулирован Ломоносовым в 1748. Закон сохранения и превращения энергии позволяет выяснить природу физической величины – работы. Энергия системы может менять лишь за счет совершаемой работы. Следовательно П.З.Т, являясь частным случаем закона сохранения энергии применительно к тепловым явлениям, устанавливает возможность превращения тепловой энергии в механическую и механической в тепловую, т.е. эквивалентность теплоты и механической работы. Q=L. 1 квт*ч=3,6 МДж=860 ккал.
Уравнения первого закона. Если к газообразному рабочему телу объемом V и массой m, заключенному в цилиндре подвести некоторое количество тепла Q, тело нагреется и увеличиться в объеме, поршень в цилиндре переместиться вправо. Теплота, сообщенная телу, расходуется на изменение внутренней энергии и на совершение работы. Обозначим изменение внутренней энергии ∆U=U2-U1. А работу через L. Тогда на основании П.З.Т. Q=∆U+L. Уравнение для массы 1кг принято писать маленькими буквами. Для бесконечно малого процесса dq=du+dl. Теплота, изменение внутренней энергии и механическая работа могут быть + и-. Если тепло подводиться +, отводится -. При расширении рабочее тело совершает + работу, сжатии -. Изменение внутренней энергии при увеличении температуры +. Уравнение выведено для процессов, в которых отсутствует перемещение газа в пространстве. При истечении газа процессы протекают с перемещением их в пространстве, тогда q=∆u+l+(c2^2-c1^2)/2,где с1 и с2 начальная и конечная скорости потока, в дифф.форме dq=du+dl+(dc^2)/2. Согласно этим уравнениям тепло, участвующее в процессе расходуется на изменение внутренней энергии, на совершение работы проталкивания и на изменение внешней кинетической энергии газа при перемещении в пространстве.
