
- •Н а вопросы к экзаменационным билетам по предмету «Химия» для профессий «Оператор эвм», «Радиомеханик».
- •2001 – 2002 Учебный год
- •Вопрос №1
- •Периодический закон и периодическая система химических элементов
- •Д. И. Менделеева
- •Значение периодического закона
- •Простые и кратные связи
- •Вопрос №4 Классификация химических реакций Неорганическая химия
- •Вопрос №5 Обратимость химических реакций, химическое равновесие
- •Вопрос №6 Скорость химических реакций
- •Катализ и катализаторы
- •Вопрос №7 Реакции ионного обмена
- •Вопрос №8 Окислительно-восстановительные реакции (овр)
- •Вопрос №9 Оксиды
- •Вопрос №10 Кислоты
- •Классификация
- •Специфические свойства серной кислоты
- •Вопрос №11 Основания
- •Свойства Вопрос №12 Соли
- •Вопрос №13 Электролиз расплавов солей
- •Применение электролиза.
- •Вопрос №14 Металлы
- •Вопрос №15 Железо
- •Физические свойства
- •Применение и биологическая роль железа и его соединений
- •Вопрос №16 Электрохимический ряд металлов
- •Вопрос №17 Коррозия металлов
- •Способы борьбы с коррозией
- •Вопрос №18 Неметаллы
- •Характеристика неметалличности
- •Характеристика атомов-неметаллов 2-го периода
- •Вопрос №19 Сера (s)
- •Вопрос №20 Водородные соединения неметаллов
- •Вопрос №21 Теория химического строения органических веществ а. М. Бутлерова
- •Вопрос №22 Предельные углеводороды (Алканы)
- •Химические свойства
- •Вопрос №25 Диеновые углеводороды (Алкадиены)
- •Получение
- •Применение
- •Природный каучук
- •Физические свойства:
- •Химические свойства
- •Вопрос №29 Предельные одноатомные спирты
- •Физические свойства
- •Химические свойства
- •Физические свойства
- •Химические свойства
- •Применение
- •Вопрос №34 Глюкоза
- •Физические свойства
- •Химические свойства
- •Применение
- •Вопрос №35 Крахмал
- •Применение крахмала
- •Биологическая роль
- •Получение
- •Вопрос №36 Целлюлоза Строение молекулы
- •Физические свойства
- •Химические свойства
- •Применение
- •Вопрос №37 Анилин
- •Физические свойства
- •Важнейшие химические свойства анилина
- •Применение
- •Вопрос №38 Аминокислоты
- •Физические свойства
- •Химические вещества
- •Применение
- •Вопрос №39 Изомерия органических соединений
- •Вопрос №40 Белки
- •Структура белка
- •Физические свойства
- •Химические свойства
- •Функции белков в организме
- •Вопрос №41 (Вопросы №42 – 47) Общая характеристика высоко молекулярных веществ (вмв, полимеры)
- •Вопрос №50 Синтетический каучук
- •Вопрос №51 Металлы и сплавы
- •Вопрос №52 Физические свойства металлов
- •Способы борьбы с коррозией
- •Вопрос №53 Измерение разности потенциалов металлов
- •Вопрос №56 Алюминий
- •Вопрос №57 Медь и благородные металлы
- •Вопрос №58 Металлы побочных подгрупп
- •Вопрос №59 Полупроводники
- •Вопрос №60 Использование неорганических материалов в качестве проводников и диэлектриков
Министерство среднего и специального образования Р.Ф.
Профессиональный лицей информатики,
бизнеса и дизайна №105

Н а вопросы к экзаменационным билетам по предмету «Химия» для профессий «Оператор эвм», «Радиомеханик».
2001 – 2002 Учебный год
Вопрос №1
Периодический закон и периодическая система химических элементов
Д. И. Менделеева
Периодический закон открыт Д. И. Менделеевым в 1869 году, за основу классификации Менделеев принял атомные массы элементов. Современная формулировка закона: Свойства химических элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядер этих элементов.
Свойства элементов повторяются периодически, так как периодически повторяется строение внешнего энергетического уровня атомов.
Графическим изображением периодического закона является периодическая таблица. Порядковый номер элемента в периодической таблице соответствует величине заряда ядра атома и количеству электронов в атоме.
Таблица семи периодов: три малых и четыре больших. Периоды – это ряды элементов расположенных в порядке возрастания порядковых номеров, начинающихся щелочным металлом и заканчивающийся инертным газом. 1 – 3 периоды малые (2, 8, 8 элементов). В малых периодах накопление электронов с возрастанием порядкового номера происходит на внешнем уровне.
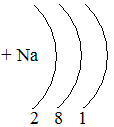
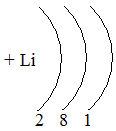
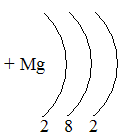
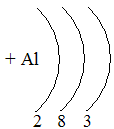
4 – 6 периоды большие. В больших периодах с возрастанием порядкового номера накопление на внешнем уровне происходит у элементов первой, второй группы. Начиная с элемента третьей группы электроны, накапливаются на предпоследнем уровне до 18-ти, а затем возобновляется достройка внешнего уровня до 8-ми электронов.
Большие периоды состоят из двух рядов: чётного и нечётного. Чётные ряды составляют только металлы (1-2 электрона, Cr – 2). В нечётном ряду металлы и неметаллы (1-8 электронов на внешнем уровне).
Металлические свойства в периоде с возрастанием порядкового номера элемента ослабевают, а неметаллические усиливаются, так как радиус атома уменьшается.
Седьмой период не завершён.
Номер периода показывает число энергетических уровней в атоме.
В таблице 8 групп. Группы – это элементы, объединённые в одном вертикальном столбце таблицы. Группы делятся на две подгруппы, в которых объединены элементы со сходным строением внешнего энергетического уровня. В главных подгруппах находятся элементы больших и малых периодов – это s- и p-элементы (заполняются соответственно s- и p-подуровни). В побочных подгруппах находятся элементы только больших периодов f- и d-подуровней (f – лантаноиды и актиноиды). В главных подгруппах расположены металлы и неметаллы. В побочных подгруппах расположены только металлы. Валентные электроны у элементов главной подгруппы расположены в наружном слое. У элементов побочных подгрупп валентные электроны расположены на внешнем и предпоследнем уровне.
Металлические свойства в группе с увеличением порядкового номера элемента усиливаются, так как увеличивается радиус атома. Номер группы показывает высшую валентность элемента и количество электронов на внешнем уровне у элементов главной подгруппы. Элементы побочных подгрупп на внешнем уровне имеют, как правило, один или два электрона.
Значение периодического закона
Периодический закон способствовал развитию науки и открытию новых элементов;
Периодический закон подтвердил общие законы развития природы:
Закон перехода количества в качество (изменение металлических и неметаллических свойств);
Закон единства и борьбы противоположностей (строение атома, амфотерные соединения);
Закон отрицания отрицания (развитие по спирали, переход от периода к периоду).
Периодический закон явился первоисточником всех открытий химии и физики в XX веке.
Вопрос №2
Строение атомов химических элементов
Вопрос №3
Химические связи
Различают несколько типов химических связей: 1 – ионная. Ионная связь образуется при взаимодействии атомов, которые сильно различаются по электроотрицательности (связь между типичным металлом и типичным неметаллом).
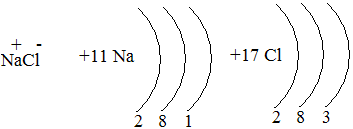
Na0-1e = Na+ Cl0+1e = Cl—
Ионная связь характерна также для щелочей и солей, в которые входят кислород и активные металлы.
2 – ковалентная связь образуется при перекрывании электронных облаков.
Ковалентная неполярная образуется при взаимодействии атомов с одинаковыми электроотрицательностями.
![]()
Ковалентная полярная образуется при взаимодействии атомов, электроотрицательности которых различаются незначительно.
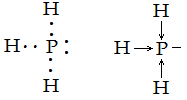
3 – металлическая связь образуется во всех металлах. Это связь, которую осуществляют относительно свободные электроны с положительными ионами металлов в кристаллической решётке. Атомы металла легко отдают валентные электроны и превращаются в положительные ионы. Относительно свободные электроны перемещаются между положительными ионами металла и между ними возникает металлическая связь, то есть электроны как бы цементируют положительные ионы металла в кристаллической решётке.

4 – водородная связь – это связь между атомом водорода одной молекулы и атомом сильного электроотрицательного элемента другой молекулы.
Водородная связь – это молекулярная связь. Она слабее, чем ионная и ковалентная связь.
