
- •43. Гомогенный катализ в растворах.
- •33. Внешняя масса передачи.
- •34. Внутренняя масса передачи.
- •42. Катализ.
- •35. Кинетика фазовых превращений.
- •16. 3 Закон термодинамики.
- •44. Гетерогенный катализ
- •19. Изменение энтропии при изотермическом расширении или сжатии.
- •17. Применение третьего закона термодинамики для расчета равновесий.
- •13. Изменение свободной энергии при изотермическом расширении и сжатии
- •18. Изменение энтропии при изобарном нагревании или охлаждении.
- •37. Скорость образования зародыша концентрации.
- •23. Закон распределения энергии по степеням свободы.
- •25. Флуктуации плотности.
- •3. Основные условия существования термодинамического равновесия.
- •1. Первый закон тд. Тд координаты, обобщенные силы.
- •4.Химический потенциал.
- •2. Второй закон термодинамики. Общее понятие энтропии.
- •5.Основные термодинамические потенциалы (тдп).
- •8. Распределение в-ва м/у 2 фазами.
- •6.Механические и калорические ур-ия состояния.
- •7. Тдп идеального газа.
- •9.Фазовые превращения. Уравнения Клаузиуса – Клапейрона и Кирхгофа.
- •10. Хим. Равновесие в гом-ых сис-х.
- •15. Равновесие в гетеро-х системах.
- •12. Изменение энергии Гиббса при изменении температуры.
- •11. Изменение свободной энергии при химических реакциях.
- •41. Влияние температуры на скорость химических реакций
- •32.Кинетика гетерогенных реакций.
- •20. Энтропия и вероятность. Теорема Больцмана-Планка.
- •21. Распределение молекул газа в потенциальном поле.
- •28. Статистический расчет химического равновесия.
- •29. Формальная кинетика химических реакций.
- •31.Теория переходного состояния при химической реакции.
- •14. Зависимость константы равновесия от температуры.
- •38. Порядок реакции и молекулярность.
- •30.Теория активных столкновений Аррениуса.
- •22. Распределение молекул по импульсам.
- •24. Статистика Гиббса.
- •36. Работа образования зародыша конденсации.
8. Распределение в-ва м/у 2 фазами.
Пусть имеется система, состоящ. из одного компонента и 2 фаз. Возьмем жид-ть и пар, настолько разреженный, что его можно считать идеаль. газом. Тогда, подставляя выражения для хим. потен-ла для пара и жидкости, имеем:
 (1)
(1)
где индекс ‘ относится к жид., а ‘’ – к газообразной фазе
с – концен-ция, fa – коэф. актив-ти,

Cooт (1) можно зап-ть в след. виде
 (2)
(2)
Эта фор-ла м.б. применима и для случая, когда с’ – конц. в-ва в тв. фазе, а с’’ – в р-ре, кот-ю считают идеаль-м, т.е. полагают, что в-во ведет себя в нем, как идеаль. газ.
6.Механические и калорические ур-ия состояния.
Запишем ТДП: dU = TdS – pdV; dH = TdS + VdP; dF = -SdT – pdV; dG = Vdp – SdT.
Как и ТДП, так и их произ-ные имеют физич. смысл. Найдем произ-ные всех потен-лов по мех. переменным (V,p):

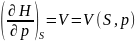 (1)
(1)


Система (1) дает нам знач-я p и V, как функция Т и одной из мех. перем-ой или как функция S и мех. переменной. Уравнения в системе (1) наз-ся механическими уравнениями состояния.
Теперь возьмем произ-ные по термич. переменным (S, T):

 (2)
(2)


Уравнения входящ. в сист. (2) яв-ся КАЛОРИЧЕСКИМИ уравнениями состояния.
7. Тдп идеального газа.
Св-ва ид. газа будут выражаться след. соотношениями:

pV = RT (ур-ние состояния)
Найдем
энтропию идеаль. газа:
.
Поскольку для идеального газа:

изменение
энтропии м.б. записано в след. виде:
 ;
;
 (2)
(2)
Интегрируя
первое ур-ние, получим:
 где U0
– пост-ная интегрирования.
где U0
– пост-ная интегрирования.
Фор-лы (2) и (3) позволяют найти новые соотношения для ТДП:
1)
2)Для своб. эн-гии Гельмгольца:

3)Для эн-гии Гиббса
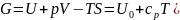 )
)
4) Для энтропии:
 )
)
9.Фазовые превращения. Уравнения Клаузиуса – Клапейрона и Кирхгофа.
Плавление, возгонка, аморфные превращения. Основ. хар-ка – тем-ра, кот-рая зависит от давления. Для нахождения связи м/у Т и р используем смешан-е произ-ные по переменным разных видов:

При фаз-х прев-ях р не зависит от V. Поэтому частные произ-е можно заменить полной.
При изотерм. фаз-х прев-х V меняется на ΔV, а энтропия на ΔS

Т.к. процесс фаз-го прев-я яв-ся изотермич. и равновесным, то

q – теплота плавления, затверд.,…
ΔV = V’’ – V’
Ур-е (3) - ур-е Клауз-са-Клапейрона
Если тем-ра значит. ниже критич. то V-ом жидкости и тв. тела можно пренебречь по сравнению с объемом пара



I – химич. постоянная
Поскольку фаз-й переход происх-т при постоянном давлении, то для нах-ния зависимости q(T) используют зав-ть энтальпии от тем-ры: q = Нп – Нж
 ;
;

Cоот. (7) – ур-ние Кирхгофа
10. Хим. Равновесие в гом-ых сис-х.
Для
решения подобных задач необход. характер.
равновесие и найти параметры от которой
зависит равнов-е: CO+1/2
При относит-но низких t равн-е сдвинута влево, а при увеличении t происх-т диссоц-я.
Рассмотр. условие равнов-я газовых р-ций в общем случае: А+2В=3D. При условии пост-ых Р и Т свобод-я эн-я в равновесной системе имеет min знач-е. В рассм-ом случае

В
против-ом случае не было бы равнов-я.
Учитываем, что для идеал-го газа
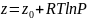 ;
;
3
где
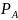 ,
,
 ,
, - парциальные давления. Величина в
правой части ур-я опред-ся темпер-ой
- парциальные давления. Величина в
правой части ур-я опред-ся темпер-ой
 – константа
равновесия. Т.О. парц-ые давления реаг-их
газов связаны м/у собой опред-ым соотн-ем.
Также можно перейти от одной связи к
другой
– константа
равновесия. Т.О. парц-ые давления реаг-их
газов связаны м/у собой опред-ым соотн-ем.
Также можно перейти от одной связи к
другой

где
 -
измен-е числа молей
-
измен-е числа молей
Если при одной и той же t газов-е смеси наход-ся нах-ся в нескольких разных сосудах под различ. давл-ем, то несмотря на то, что const равнов-я одинакова, составы смеси могут отлич-ся друг от др. Для опред-я парц-го давл-я, кроме знач-й const равновесия, надо знать состав до начала р-ции.
