
- •43. Гомогенный катализ в растворах.
- •33. Внешняя масса передачи.
- •34. Внутренняя масса передачи.
- •42. Катализ.
- •35. Кинетика фазовых превращений.
- •16. 3 Закон термодинамики.
- •44. Гетерогенный катализ
- •19. Изменение энтропии при изотермическом расширении или сжатии.
- •17. Применение третьего закона термодинамики для расчета равновесий.
- •13. Изменение свободной энергии при изотермическом расширении и сжатии
- •18. Изменение энтропии при изобарном нагревании или охлаждении.
- •37. Скорость образования зародыша концентрации.
- •23. Закон распределения энергии по степеням свободы.
- •25. Флуктуации плотности.
- •3. Основные условия существования термодинамического равновесия.
- •1. Первый закон тд. Тд координаты, обобщенные силы.
- •4.Химический потенциал.
- •2. Второй закон термодинамики. Общее понятие энтропии.
- •5.Основные термодинамические потенциалы (тдп).
- •8. Распределение в-ва м/у 2 фазами.
- •6.Механические и калорические ур-ия состояния.
- •7. Тдп идеального газа.
- •9.Фазовые превращения. Уравнения Клаузиуса – Клапейрона и Кирхгофа.
- •10. Хим. Равновесие в гом-ых сис-х.
- •15. Равновесие в гетеро-х системах.
- •12. Изменение энергии Гиббса при изменении температуры.
- •11. Изменение свободной энергии при химических реакциях.
- •41. Влияние температуры на скорость химических реакций
- •32.Кинетика гетерогенных реакций.
- •20. Энтропия и вероятность. Теорема Больцмана-Планка.
- •21. Распределение молекул газа в потенциальном поле.
- •28. Статистический расчет химического равновесия.
- •29. Формальная кинетика химических реакций.
- •31.Теория переходного состояния при химической реакции.
- •14. Зависимость константы равновесия от температуры.
- •38. Порядок реакции и молекулярность.
- •30.Теория активных столкновений Аррениуса.
- •22. Распределение молекул по импульсам.
- •24. Статистика Гиббса.
- •36. Работа образования зародыша конденсации.
43. Гомогенный катализ в растворах.
Простейшая схема гомогенного катализа включает обратимое образование промежуточного комплекса катализатора (К.) с одним из реагирующих веществ и превращение этого комплекса в продукты реакции с
высвобождением катализатора:
А
+ К
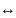 АК,
АК,
АК
+ В
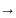 C+D+K.
C+D+K.
Сопоставим
в общем случае скорости в газе и в
жидкости используя теорию переходного
состояния.
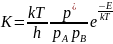 Будем полагать, что газ подчиняется
идеальному закону. Для неидеальных
систем константа равновесия активации
для бимолекулярных уравнений:
Будем полагать, что газ подчиняется
идеальному закону. Для неидеальных
систем константа равновесия активации
для бимолекулярных уравнений:
 .
Отсюда
.
Отсюда
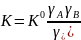 .
При обычных давлениях в газовых реакциях
коэффициент активности близок к 1, в
р-рах – отличается. Поэтому, К0
можно рассматривать как константу
скорости в газовой среде, а К – в р-ре.
.
При обычных давлениях в газовых реакциях
коэффициент активности близок к 1, в
р-рах – отличается. Поэтому, К0
можно рассматривать как константу
скорости в газовой среде, а К – в р-ре.
 .
Влияние взаимодействия с растворителем
может заключаться в степени энергии
реагирующих частиц по величине энергии
сольватации. Если, например, реагирующие
молекулы сольватированы, а переходные
состояния не сольватированы, то ЕА
увеличивается, а скорость – уменьшается,
если сольватированы переходные
состояния, а исходные нет, то реакция
ускоряется. Влияние электронов на
скорость реакции в растворах проявляется
в первичном и вторичном соляных эффектах:
1 – изменяются коэффициенты активации
реагирующих веществ, 2 – фактическое
изменение концентрации ионов реагентов
в результате добавления реагентов.
.
Влияние взаимодействия с растворителем
может заключаться в степени энергии
реагирующих частиц по величине энергии
сольватации. Если, например, реагирующие
молекулы сольватированы, а переходные
состояния не сольватированы, то ЕА
увеличивается, а скорость – уменьшается,
если сольватированы переходные
состояния, а исходные нет, то реакция
ускоряется. Влияние электронов на
скорость реакции в растворах проявляется
в первичном и вторичном соляных эффектах:
1 – изменяются коэффициенты активации
реагирующих веществ, 2 – фактическое
изменение концентрации ионов реагентов
в результате добавления реагентов.
Многие гомогенные реакции катализируются кислотами или основаниями. Влияние кислот и оснований на скорость реакции в водных растворах привела к заключению, что Н+ и ОН- различаются каталитическими свойствами. Кислоты и основания могут обмениваться протонами в реакциях: кислота – донор, основание – акцептор. Подобные реакции, заключающиеся в переходе протона, которые могут переходить и вне водных растворах. Равновесие в таких реакциях наз-ся кислотно-основным. К + О К+ + О-. Катализ кислотой обусловлен переходом протона от К к R(исх.в-во) с образованием неустойчивого соед-ия типа RH, которое, распадаясь, дает конечный продукт, или регенерирует кислоту. К + О RH+ + О-;
RH+
+ О-
 К + X;
RH
+ О-
К + R-;
R-
+ K
X
+ О-.
такие каталитические реакции можно
рассматривать как двустадийные реакции.
R
RH+
X
, где К1,K2,K3
– константы скорости соответствующих
реакций.
К + X;
RH
+ О-
К + R-;
R-
+ K
X
+ О-.
такие каталитические реакции можно
рассматривать как двустадийные реакции.
R
RH+
X
, где К1,K2,K3
– константы скорости соответствующих
реакций.
Если скорость распада промежуточного состояния с образованием продукта Х > обратного превращения R, то между R и RH+ не может установиться равновесие. В этом случае сумма скоростей реакции определиться скоростью первой стадии. Поскольку концентрация кислоты остается постоянной, то должна иметь место реакция первого порядка. Если же скорость превращения комплекса RH+ мала, то будет устанавливаться равновесие между R и RH+ и скорость процесса в целом определяется произведением равновесной концентрации этого комплекса на К3.
33. Внешняя масса передачи.
В подобном процессе, поток газа омывает зернистый материал. Пусть скорость газового потока альфа, концентрация реагирующих вещества С и концентрация на границе зерен Сх. Скорость процесса измеряемая кол-вом прореагирующего вещества в единица объема слоя в единицу времени определяется уравнением: . В случае если скорость диффузии в глубину зерна, что Сх – малая величина, то . признаки того что процесс определяется условиями внешней массы передачи сводится к следующему: 1) диффузионное сопротивление не зависит от времени. 2) если процесс прерывается, а затем возобновляется с теми же параметрами, то процесс рассматривается с теми же параметрами, что и до перерыва. 3) скорость сравнительно мало зависит от температуры. В часто встречающихся в практике задачах, в случае обтекания зернистого материала, абсолютный расчет невозможен. Это обусловлено невозможно учета всех геометрических особенностей вязкого обтекания зернистого потока. В таких случаях целесообразно пользоваться методами теории размерности. Которые позволяют .
Критерий Нуссельда характеризует массу передачи, критерий Рейнольца характер потоков вещества, критерий, критерий Прантля характеризует физхим св-ва газа или жидкости. Рекомендуется из опытных значений зависимости бета от одного из параметров найти связь между критерием Нуссельда и Рейнольца, которые могут быть рассчитаны.
