
- •43. Гомогенный катализ в растворах.
- •33. Внешняя масса передачи.
- •34. Внутренняя масса передачи.
- •42. Катализ.
- •35. Кинетика фазовых превращений.
- •16. 3 Закон термодинамики.
- •44. Гетерогенный катализ
- •19. Изменение энтропии при изотермическом расширении или сжатии.
- •17. Применение третьего закона термодинамики для расчета равновесий.
- •13. Изменение свободной энергии при изотермическом расширении и сжатии
- •18. Изменение энтропии при изобарном нагревании или охлаждении.
- •37. Скорость образования зародыша концентрации.
- •23. Закон распределения энергии по степеням свободы.
- •25. Флуктуации плотности.
- •3. Основные условия существования термодинамического равновесия.
- •1. Первый закон тд. Тд координаты, обобщенные силы.
- •4.Химический потенциал.
- •2. Второй закон термодинамики. Общее понятие энтропии.
- •5.Основные термодинамические потенциалы (тдп).
- •8. Распределение в-ва м/у 2 фазами.
- •6.Механические и калорические ур-ия состояния.
- •7. Тдп идеального газа.
- •9.Фазовые превращения. Уравнения Клаузиуса – Клапейрона и Кирхгофа.
- •10. Хим. Равновесие в гом-ых сис-х.
- •15. Равновесие в гетеро-х системах.
- •12. Изменение энергии Гиббса при изменении температуры.
- •11. Изменение свободной энергии при химических реакциях.
- •41. Влияние температуры на скорость химических реакций
- •32.Кинетика гетерогенных реакций.
- •20. Энтропия и вероятность. Теорема Больцмана-Планка.
- •21. Распределение молекул газа в потенциальном поле.
- •28. Статистический расчет химического равновесия.
- •29. Формальная кинетика химических реакций.
- •31.Теория переходного состояния при химической реакции.
- •14. Зависимость константы равновесия от температуры.
- •38. Порядок реакции и молекулярность.
- •30.Теория активных столкновений Аррениуса.
- •22. Распределение молекул по импульсам.
- •24. Статистика Гиббса.
- •36. Работа образования зародыша конденсации.
15. Равновесие в гетеро-х системах.
Системы, в состав которых входит более одной фазы, называются гетерогенными. Они могут содержать газовую фазу, а также конденсированные фазы - твердые или жидкие. Рассмотрим случай, когда все участвующие в реакции конденсированные фазы представляют собой вещества, которые не образуют друг с другом растворов, и, таким образом, только газовая фаза может быть раствором. К числу таких реакций относятся:
 ;
;

В
общем виде для гетерогенной реакции
Aг + Вк = Dк + 2Eг (индекс "к" означает
конденсированную фазу) условие
равновесия при постоянных темпер-е и
давлении состоит в равенстве нулю
алгебр-ой суммы свободных энергий
Гиббса всех участвующих в реакции
веществ:

Уравнение состояния идеальных газов применимо лишь в том случае, если можно пренебречь собственным объемом молекул газа. Поэтому при использовании законов идеальных газов для расчетов гетерогенных равновесий можно пренебречь объемом конденсированных фаз ввиду его малости. Отсюда следует, что энергия Гиббса веществ, находящихся в твердом или жидком состоянии, практически не зависит от давления. Таким образом, для рассматриваемой реакции:

Преобразуя,
получим:

Это
означает выраж-е для закона действующих
масс для гетерогенных систем остается
таким же, как и для гомогенных систем,
но только парциальные давления (или
концентрации) конденсир-ых фаз не входят
в уравнение константы равнов-я. Изменение
свободной энергии Гиббса при рассмотренной
выше гетерогенной реакции Aг + Вк
составляет:

Константы равновесия ряда реакций не могут быть эксперим-но определены из-за весьма малых величин парциальных давлений (или концентраций) некоторых из компонентов
12. Изменение энергии Гиббса при изменении температуры.
 (1) Подставим
значение
(1) Подставим
значение


 (2) – урав-е изобары
хим-ой р-ции.
(2) – урав-е изобары
хим-ой р-ции.
Знак
производной опред-ся знаком теплов-го
эффекта. В случае эндотерм. р-ции

 повыш-ся при повыш-и T,
для экзотерм-ой
повыш-ся при повыш-и T,
для экзотерм-ой
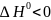 пониж-ся при пониж-и Т.
пониж-ся при пониж-и Т.
 (3) – урав-е изохоры
хим-ой р-ции.
(3) – урав-е изохоры
хим-ой р-ции.
Из
(2) и (3) следует. Что соед-я, образ-е с
помощью тепла при высоких Т-ах яв-ся
более устойчивыми, а экзот. прочны при
низких Т-ах. Для того, чтобы происх.
р-ция, приняли, что
 не яв-ся ф-цией
.
Оно может быть более-менее обусловл.,
если при измен-и теплоемк-ти при р-ции
близко к нулю. Ими рассм. очень узкий
интервал темпер-р.
не яв-ся ф-цией
.
Оно может быть более-менее обусловл.,
если при измен-и теплоемк-ти при р-ции
близко к нулю. Ими рассм. очень узкий
интервал темпер-р.
 (4)
(4)
Соот-е
(4) показ-ет, что м/у
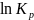 и обр. темпер-ой сущ-ет прямолин-я
завис-ть из кот-ой ч/з tg
угла можно найти
и обр. темпер-ой сущ-ет прямолин-я
завис-ть из кот-ой ч/з tg
угла можно найти
 .
.
11. Изменение свободной энергии при химических реакциях.
А+2В=3D
При
 =0
– равновесие;
<0
– в сторону обр-я соед-я D;
>0
– диссоц-я.
=0
– равновесие;
<0
– в сторону обр-я соед-я D;
>0
– диссоц-я.
Пусть
имеется неравнов-я смесь А, В и D
с давл-ми
 .
Найдем изм-е свобод-ой эн-и при протекании
р-ции, когда А и В превращ-ся в Д при
заданном давлении.
.
Найдем изм-е свобод-ой эн-и при протекании
р-ции, когда А и В превращ-ся в Д при
заданном давлении.
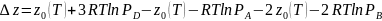 ,
,
 Допустим, что выбор-е давл-е отвечает
состоянию равнов-я, тогда
Допустим, что выбор-е давл-е отвечает
состоянию равнов-я, тогда
 – урав-е Вант-Гоффа или урав-е изотермы
хим-ой р-ции.
– урав-е Вант-Гоффа или урав-е изотермы
хим-ой р-ции.
Т.о яв-ся мерой хим-го сродства, т.е. харак-ет тенденцию в-тв, реагир-х друг с другом самопроизвольн-ми образ-ми продуктов р-ции. При рассм-и особое знач-е имеет особый случай, когда взятый в своих стандарт-ых сост-ях с образ-ем продуктов в таком же сост-и
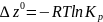 – стандарт-ое
сост-е свободной эн-и.
– стандарт-ое
сост-е свободной эн-и.
