
- •43. Гомогенный катализ в растворах.
- •33. Внешняя масса передачи.
- •34. Внутренняя масса передачи.
- •42. Катализ.
- •35. Кинетика фазовых превращений.
- •16. 3 Закон термодинамики.
- •44. Гетерогенный катализ
- •19. Изменение энтропии при изотермическом расширении или сжатии.
- •17. Применение третьего закона термодинамики для расчета равновесий.
- •13. Изменение свободной энергии при изотермическом расширении и сжатии
- •18. Изменение энтропии при изобарном нагревании или охлаждении.
- •37. Скорость образования зародыша концентрации.
- •23. Закон распределения энергии по степеням свободы.
- •25. Флуктуации плотности.
- •3. Основные условия существования термодинамического равновесия.
- •1. Первый закон тд. Тд координаты, обобщенные силы.
- •4.Химический потенциал.
- •2. Второй закон термодинамики. Общее понятие энтропии.
- •5.Основные термодинамические потенциалы (тдп).
- •8. Распределение в-ва м/у 2 фазами.
- •6.Механические и калорические ур-ия состояния.
- •7. Тдп идеального газа.
- •9.Фазовые превращения. Уравнения Клаузиуса – Клапейрона и Кирхгофа.
- •10. Хим. Равновесие в гом-ых сис-х.
- •15. Равновесие в гетеро-х системах.
- •12. Изменение энергии Гиббса при изменении температуры.
- •11. Изменение свободной энергии при химических реакциях.
- •41. Влияние температуры на скорость химических реакций
- •32.Кинетика гетерогенных реакций.
- •20. Энтропия и вероятность. Теорема Больцмана-Планка.
- •21. Распределение молекул газа в потенциальном поле.
- •28. Статистический расчет химического равновесия.
- •29. Формальная кинетика химических реакций.
- •31.Теория переходного состояния при химической реакции.
- •14. Зависимость константы равновесия от температуры.
- •38. Порядок реакции и молекулярность.
- •30.Теория активных столкновений Аррениуса.
- •22. Распределение молекул по импульсам.
- •24. Статистика Гиббса.
- •36. Работа образования зародыша конденсации.
13. Изменение свободной энергии при изотермическом расширении и сжатии
Свободная
энергия [F]— термодинамический потенциал,
убыль которого в квазистатическом
изотермическом процессе равна работе,
совершённой системой над внешними
телами.
В обратимых изотермических
процессах свободная энергия характеризует
способность системы совершать работу.
Работа в таких процессах совершается
за счет убыли свободной энергии .
 При
изотермическом расширении, когда работа
положительна, то свободная энергия
убывает, и наоборот при сжатии работа
отрицательна, а свободная энергия
возрастает, за счет внешних сил, сжимающих
тело. Система не может совершить работу,
превышающую ее свободную энергию.
В
механике энергия тела равна сумме
потенциальной и кинетической энергий.
Оба этих вида энергий макроскопических
тел могут быть полностью преобразованы
в механическую работу. Внутренняя
энергия молекулярной системы, в
интересующем нас случае, не может быть
целиком превращена в работу. Посмотрим,
чем отличаются свободная энергия и
внутренняя . При изотермическом
расширении идеального газа от объема
до объема работа одного моля
При
изотермическом расширении, когда работа
положительна, то свободная энергия
убывает, и наоборот при сжатии работа
отрицательна, а свободная энергия
возрастает, за счет внешних сил, сжимающих
тело. Система не может совершить работу,
превышающую ее свободную энергию.
В
механике энергия тела равна сумме
потенциальной и кинетической энергий.
Оба этих вида энергий макроскопических
тел могут быть полностью преобразованы
в механическую работу. Внутренняя
энергия молекулярной системы, в
интересующем нас случае, не может быть
целиком превращена в работу. Посмотрим,
чем отличаются свободная энергия и
внутренняя . При изотермическом
расширении идеального газа от объема
до объема работа одного моля
 Правая
часть представляет собой убыль свободной
энергии , и она тем больше, чем больше
отношение объемов, т.е. чем сильнее
сжатие газ. А, напомним, внутренняя
энергия идеального газа не зависит от
объема.
В изотермическом процессе
сжатый газ совершает работу за счет
подводимого тепла, но мы говорим о
свободной энергии газа, т.к. работу
совершает газ.
В общем случае,
когда процесс протекает необратимо,
совершаемая работа меньше чем в обратимом
процессе, т.е. меньше чем изменение
свободной энергии.
Правая
часть представляет собой убыль свободной
энергии , и она тем больше, чем больше
отношение объемов, т.е. чем сильнее
сжатие газ. А, напомним, внутренняя
энергия идеального газа не зависит от
объема.
В изотермическом процессе
сжатый газ совершает работу за счет
подводимого тепла, но мы говорим о
свободной энергии газа, т.к. работу
совершает газ.
В общем случае,
когда процесс протекает необратимо,
совершаемая работа меньше чем в обратимом
процессе, т.е. меньше чем изменение
свободной энергии.
TdS>δQ, δA< -dF Возможны так же случаи, когда изменение свободной энергии не сопровождается совершением работы, например, расширение газа в пустоту. Работ не совершается, внутренняя энергия не изменяется, а способность совершать работу падает. Это так, потому что процесс расширения газа в пустоту необратим полностью, хотя и изотермический. Свободная энергия , так же как и внутренняя энергия является функцией состояния системы. А это вытекает из того, что при обратимом изотермическом процессе, при переходе из состояния 1 в состояние 2 и обратно в 1, работа ΔA=0 следовательно, в таком переходе работа не зависит от пути, а только от начального и конечного состояния системы. Рассмотрим I начало для изотермического процесса TdS=dU+δA, T-const, dTS-dU=δA,
δA=-(dU-dTS)=-d(TS-U)=-dF Мы нашли выражение для функции свободной энергии F=U-TS, U=F+TS Внутренняя энергия системы состоит из суммы свободной и связанной энергий системы. Свободную энергию можно рассматривать как потенциальную энергию системы, находящуюся при постоянных температуре и давлении и . Поэтому условием равновесия
ТД системы будет условие минимума свободной энергии.
18. Изменение энтропии при изобарном нагревании или охлаждении.
Кол-во теплоты, необходимо для изменения температуры системы, выражают с помощью теплоемкости: δQобр=CpdT. (1)
 (2)
(2)
Если теплоемкость не зависит от температуры в интервале от Т1 до T2, то ур-е (2) можно проинтегрировать:
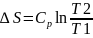 (3)
(3)
При более сложно темпер. зависимости теплоемкости в выраж. (3) появл-ся доп. слагаемые. например, если теплоемкость опис-ся рядом:
Cp = a + bT + c/T
то соотв-щее изменение энтропии:

Если измен-ние температуры происх-т при пост. объеме, то в формулах (2) и (3) надо заменить Cp на CV.
