
- •2. Химическая технология и защита окружающей среды
- •3. Основные направления в развитии химической промышленности.
- •4. Хтп и их классификация
- •5. Уровни анализа, описания и расчета хтп.
- •6. Основные показатели хтп: степень превращения, выход продукта
- •7. Расходные коэф-ты. Избирательность хтп (φ)
- •Скорость хтп. Способы увеличения скорости
- •9. Материальный баланс процесса.
- •10. Тепловой баланс процесса.
- •11. Задачи термодинамического анализа
- •12. Равновесие Принцип Ле-Шателье и его применение в хт. Равновесная степень превращения
- •13.Константа равновесия и способы ее выражения
- •14. Влияние температуры на константу равновесия, ее расчет
- •15.Общая характеристика гомогенных хтп
- •16. Влияние концентраций реагентов на скорость гомогенных процессов и степень превращения
- •Основное кинетическое уравнение:
- •17. Влияние концентрации реагентов на избирательность гомогенных хтп.
- •18. Температура как фактор повышения скорости процесса и управления выходом продукта реакции (необратимые, обратимые, экзо- и эндотермические реакции)
- •19. Влияние температуры на скорость, избирательность процесса и выход продукта при протекании сложных реакций
- •20. Влияние давления на скорость газофазных реакций
- •1 Влияние давления на скорость необратимых процессов
- •2 Влияние давления на скорость обратимых процессов
- •21. Характер изменения основных параметров хтп во времени
- •22. Принципы расчета оптимальных параметров проведения процессов
- •23. Применение катализаторов в гомогенных системах (гомогенный катализ)
- •24. Общая характеристика гетерогенных хтп.
- •25. Процессы протекающие во внешнедиффузионной области.
- •26. Внутредиффузионная область протекания процессов.
- •27. Кинетическая область протекания процессов.
- •28. Основные методы изготовления и требования к катализаторам.
- •29. Особенности протекания каталитических процессов. Гетерогенные каталитические процессы.
- •Области протекания гетерогенных каталитических процессов.
- •Влияние этих торможений на избирательность Кт.
- •Влияние внутридиффузионных торможений на кинетику процесса.
- •30. Переходные области протекания гетерогенного хтп.
- •31. Моделирование хтп. Общие понятия.
- •37. Основные характеристики потоков и их влияние на хтп
- •38. Протекание хтп в потоке идеального вытеснения (ив)
- •39. Температурные режимы протекания хтп.
- •40. Протекание хтп в потоке полного (идеального) смешения.
- •4 0.1. Технологические расчеты.
- •40.2. Закономерность хтп без теплообмена.
- •41. Теплообмен с окружающей средой как фактор интенсификации хтп в потоке.
- •42. Секционирование реакционной зоны потока смешения.
- •42.1. Методы расчета каскада реакционных зон.
- •43. Сопоставление протекания хтп в различных идеальных потоках.
- •43.1. Процессы без тепловых эффектов ( при изотермическом температурном режиме).
- •43.2. Процессы с большими тепловыми эффектами.
- •43.3. Сравнение по избирательности.
- •44. Протекание хтп в неидеальных потоках.
- •45. Химические реакторы
- •45.1. Классификация
- •46. Основные требования к промышленным реакторам:
- •47. Отклонения реальных реакторов от идеализированных моделей
- •48. Реакторы для гомогенных процессов
- •49. Реакторы для проведения гетерогенных процессов в системе г — ж
- •50. Химико-технологические системы (хтс). Основные определение.
- •51. Моделирование химика-технологической системы
- •52. Организация химико-технологического процесса. Выбор схемы процесса
- •53. Основные условные обозначения технолог.Операторов. Основные способы отражения структуры хтс.
- •54. Технологическая схема хтс. Схемы с открытой цепью и циклические
- •55. Элементы анализа и синтеза хтс.
- •56. Основные типы связей.
- •59. Задачи, решаемые при исследовании хтс.
- •60. Сырьё в химической технологии. Комплексное использование сырья.
- •61. Методы очистки воды для производственных процессов. Очистка сточных вод. Замкнутые водооборотные циклы.
- •62. Очистка газообразных промышленных выбросов.
- •63. Обработка твердых отходов
- •64. Виды энергии, применяемые в химической промышленности. Использование тепла отходящих газов: регенераторы, рекуператоры, котлы-утилизаторы.
- •65. Методы обогащения твёрдых, жидких материалов и газов.
19. Влияние температуры на скорость, избирательность процесса и выход продукта при протекании сложных реакций
I Параллельные реакции:
 k1
В
k1
В
А E1
E1
E2 k2
Д
![]() ,
,![]() ,
,
![]() ,
,
n1, n2 – порядки реакций
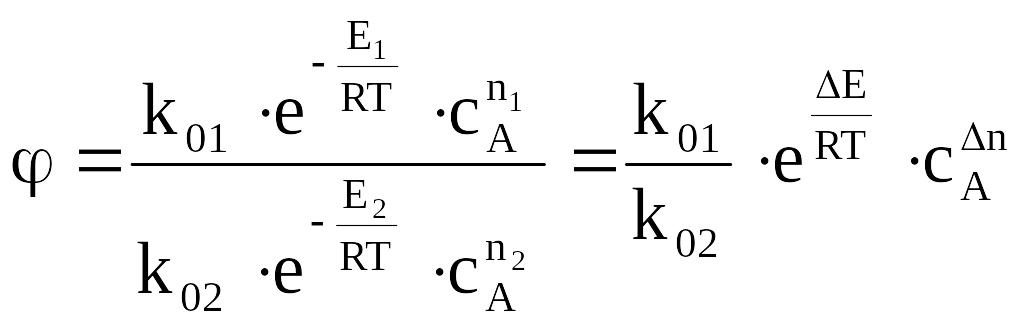 (1)
(1)
ΔЕ=Е2 – Е1, Δn=n1 – n2
Для выявления характера влияния температуры на изб-ть примем все величины кроме тем-ры постоянными, тогда уравнение (1) можно записать:
![]()
Если Еа побочной реакции выше Еа основной реакции, т.е. ΔЕ>0, то для повышения избирательности следует уменьшать температуру. Однако при этом неизбежно уменьшение скорости образования целевого продукта, падает Ха и ФВ(А). В каком направлении работать технологу? Этот вопрос решается графически.
Более просто решается эта задача, если Е1>Е2, ΔЕ<0. В этом случае надо работать при возможно более высоких температурах.
Существуют факторы, ограничивающие повышение температуры в промышленных условиях:
термическая стойкость элементов реакционных аппаратов,
изменение агрегатного состояния в-ва,
техническая инактивация кат-ра (спекание) и разложение (диссоциация) исходных веществ,
экономические факторы.
II Последовательные реакции:
k1 k2
А
 В Д
В Д
Е1 Е2
UВ = k1 ∙cA – k2∙cB, UД = k2∙cB
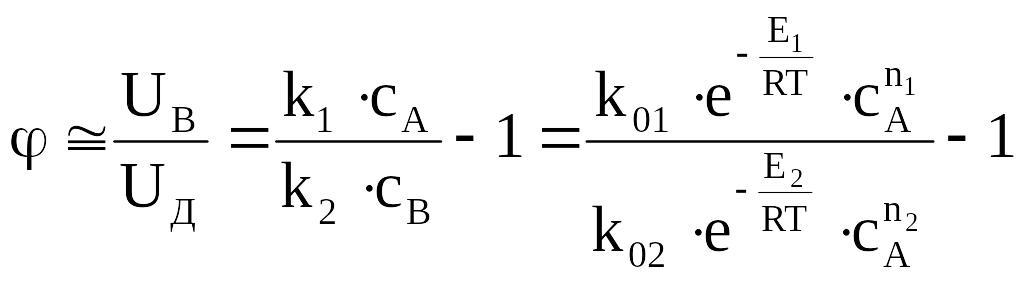
![]() (2)
(2)
где ΔЕ=Е2 – Е1
Если
принять концентрации компонентов
постоянными, то выражение (2) можно
упростить:
![]()
При ΔЕ>0 для повышения избирательности целесообразно понижать температуру, а при ΔЕ<0 увеличивать температуру. Изменяя температиуру, можно направить процесс на образование нужного продукта.
20. Влияние давления на скорость газофазных реакций
1 Влияние давления на скорость необратимых процессов
Однозначно: растут концентрации реагирующих веществ → движущая сила процесса и его скорость растут.
k1
аА(г) + bВ(г) → dД(г)
![]()
n1 – частный порядок реакции по веществу А; n2 – частный порядок реакции по веществу В
n=n1+n2
Считая А и В идеальными газами, их концентрации можно выразить через парциальные давления из уравнения Менделеева – Клапейрона:
![]()
При
Т=const:
![]()
Парциальные давления рА и рВ выразим через общее давление системы:
![]()
![]()
![]()
β – коэффициент, зависящий от константы скорости реакции и концентрации реагирующих веществ;
n – общий порядок реакции
Чем выше порядок реакции и чем чище исходная смесь, тем целесообразнее применять давление. Характер роста скорости реакции будет определяться её порядком:
n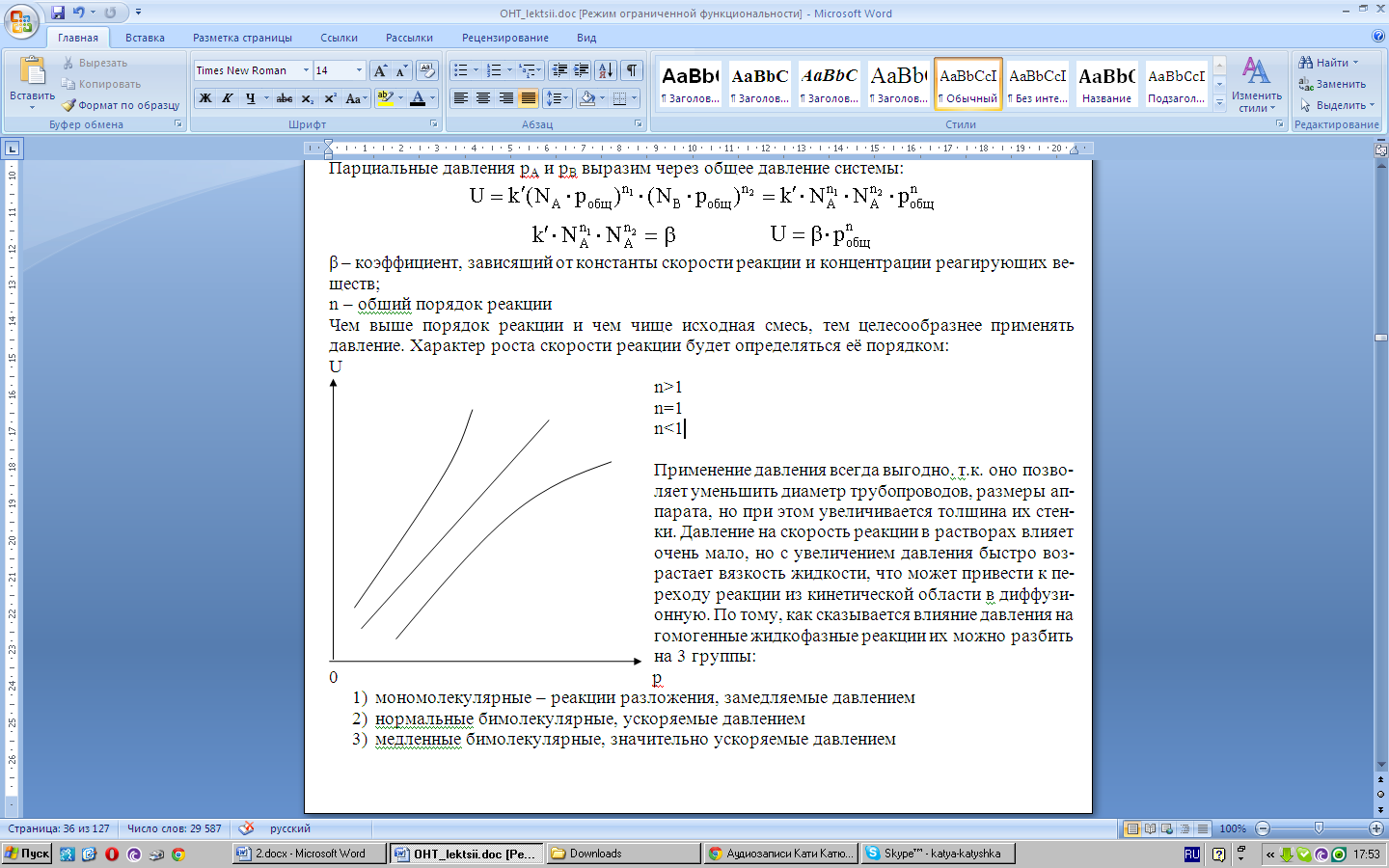 >1
>1
n=1
n<1
Применение давления всегда выгодно. т.к. оно позволяет уменьшить диаметр трубопроводов, размеры аппарата, но при этом увеличивается толщина их стенки. Давление на скорость реакции в растворах влияет очень мало, но с увеличением давления быстро возрастает вязкость жидкости, что может привести к переходу реакции из кинетической области в диффузионную. По тому, как сказывается влияние давления на гомогенные жидкофазные реакции их можно разбить на 3 группы:
мономолекулярные – реакции разложения, замедляемые давлением
нормальные бимолекулярные, ускоряемые давлением
медленные бимолекулярные, значительно ускоряемые давлением
