
- •37 Амфотерные гидроксиды. Характеристика химических свойств с точки зрения теории электролитической диссоциации.
- •38 Фосфор. Оксиды фосфора. Ортофосфорная кислота. Получение, свойства и применение. Качественная реакция на фосфат-анион.
- •Получение
- •Физические свойства
- •Белый фосфор
- •Жёлтый фосфор
- •Красный фосфор
- •Чёрный фосфор
- •Металлический фосфор
- •Химические свойства
- •Взаимодействие с простыми веществами
- •40 Дисперсные системы.
- •43 Истинные растворы. Гидратная теория растворов д. И. Менделеева.
- •49 Теория электролитической диссоциации с. Аррениуса.
- •50 Водородные соединения галогенов, особенности строения и свойств. Получение и применение. Качественные реакции на хлорид, бромид и йодид-анионы.
- •Свойства галогеноводородов
- •52 Гидролиз солей. Факторы, усиливающие или ослабляющие гидролиз.
- •55 Скорость химической реакции. Факторы, влияющие на скорость химической реакции.
- •58 Классификация химических реакций.
- •1. Реакции соединения
- •2. Реакции разложения
- •3. Реакции замещения
- •4. Реакции обмена
- •1. Протолитические реакции.
- •2. Окислительно-восстановительные реакции.
- •3. Лиганднообменные реакции.
- •4. Реакции атомно-молекулярного обмена.
- •61 Обратимые химические реакции. Химическое равновесие. Условия смещения химического равновесия. Принцип Ле-Шателье.
- •64 Окислительно-восстановительные реакции. Окислители и восстановители.
- •Описание
- •Окисление
- •Восстановление
- •Виды окислительно-восстановительных реакций
- •Химические свойства
- •73 Реакции ионного обмена. Условия протекания реакций ионного обмена до конца.
- •Введение, правило Бертолле
- •Изображение реакций ионного обмена
- •Правила написания реакций двойного обмена
- •Условия, при которых реакции ионного обмена протекают до конца
- •1. Если в результате реакции выделяется малодиссоциирующее вещество – вода.
- •2. Если в результате реакции выделяется нерастворимое в воде вещество.
- •3. Если в результате реакции выделяется газообразное вещество.
- •76 Понятие об аллотропии. Аллотропные видоизменения кислорода, водорода, углерода.
- •77 Соединения цинка. Особенности строения, свойства, получения. Применение соединений цинка в медицине. Качественная реакция на катион цинка.
- •79 Электролиз расплавов и растворов солей.
- •80 Соединения хрома. Физические и химические свойства, получение, применение. Превращение хроматов в дихроматы и наоборот.
- •Окись хрома (III)(Зеленый крон, хромовая зелень)
- •Бихромат аммония
- •Хромоаммониевые квасцы
- •Хлорид хрома (III)
- •Гексакарбонил хрома
- •86 Соединения марганца. Физические и химические свойства, получение и применение. Участие соединений марганца в окислительно-восстановительных реакциях.
- •Перманганат калия (Калий марганцовокислый)
- •Стеарат-пальмитат марганца
- •Циклопентадиенилтрикарбонил марганца(цтм)
- •Метилциклопентадиенилтрикарбонил марганца (Метил-цтм)
- •88 Электролиз растворов солей.
- •89 Кислородсодержащие соединения хлора, имеющие наибольшее практическое значение.
73 Реакции ионного обмена. Условия протекания реакций ионного обмена до конца.
Реакция ионного обмена — одна из видов химической реакции, характеризующаяся выделением в продукты реакции воды, газа или осадка.
Введение, правило Бертолле
Химические реакции в растворах электролитов (кислот, оснований и солей) протекают при участии ионов. Если такие реакции не сопровождаются изменением степеней окисления, они называются реакциями двойного обмена.
Изображение реакций ионного обмена
Реакцию обмена в растворе принято изображать тремя уравнениями: молекулярным, полным ионным и сокращённым ионным. В ионном уравнении слабые электролиты, газы и малорастворимые вещества изображают молекулярными формулами.
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ +H2O
2Na+ + CO32- + 2H+ + SO42- → 2Na+ + SO42- + CO2↑ + H2O
CO32- + 2H+ → CO2↑ + H2O
Правила написания реакций двойного обмена
-
При написании ионных уравнений следует обязательно руководствоваться таблицей растворимости кислот, оснований и солей в воде, то есть обязательно проверять растворимость реагентов и продуктов, отмечая это в уравнениях.
-
Следует иметь в виду, что реакции двойного обмена между солями с образованием осадков протекают во всех тех случаях, когда растворимость реагентов выше, чем растворимость одного из продуктов.
-
Для получения малорастворимого вещества всегда надо выбирать хорошо растворимые реагенты и использовать достаточно концентрированные растворы.
Условия, при которых реакции ионного обмена протекают до конца
1. Если в результате реакции выделяется малодиссоциирующее вещество – вода.
Молекулярное уравнение реакции щелочи с кислотой:
![]()
Неизменность степеней окисления элементов во всех веществах до и после реакции говорит о том, что реакции обмена не являются окислительно-восстановительными.
Полное ионное уравнение реакции:
K+ + OH– + H+ + Cl– = K+ + Cl– + H2O.
Cокращенное ионное уравнение реакции:
H+ + OH– = H2O.
Молекулярное уравнение реакции основного оксида с кислотой:
CaO + 2HNO3 = Ca(NO3)2 + H2O.
Полное ионное уравнение реакции:
![]()
Cокращенное ионное уравнение реакции:
CaO + 2H+ = Ca2+ + H2O.
Молекулярное уравнение реакции нерастворимого основания с кислотой:
3Mg(OH)2
+ 2H3PO4
= Mg3(PO4)2![]() + 6H2O.
+ 6H2O.
Полное ионное уравнение реакции:
![]()
В данном случае полное ионное уравнение совпадает с сокращенным ионным уравнением.
Молекулярное уравнение реакции амфотерного оксида с кислотой:
Al2O3 + 6HCl = 2AlCl3 + 3H2O.
Полное ионное уравнение реакции:
Al2O3 + 6H+ + 6Cl– = 2Al3+ + 6Cl– + 3H2O.
Cокращенное ионное уравнение реакции:
Al2O3 + 6H+ = 2Al3+ + 3H2O.
2. Если в результате реакции выделяется нерастворимое в воде вещество.
Молекулярное уравнение реакции растворимой соли со щелочью:
CuCl2
+ 2KOH = 2KCl + Cu(OH)2![]() .
.
Полное ионное уравнение реакции:
Cu2+
+ 2Cl–
+ 2K+
+ 2OH–
= 2K+
+ 2Cl–
+ Cu(OH)2![]() .
.
Cокращенное ионное уравнение реакции:
Cu2+
+ 2OH–
= Cu(OH)2![]() .
.
Молекулярное уравнение реакции двух растворимых солей:
Al2(SO4)3
+ 3BaCl2
= 3BaSO4![]() + 2AlCl3.
+ 2AlCl3.
Полное ионное уравнение реакции:
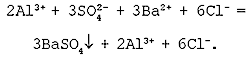
Cокращенное ионное уравнение реакции:

Молекулярное уравнение реакции нерастворимого основания с кислотой:
Fe(OH)3
+ H3PO4
= FePO4![]() + 3H2O.
+ 3H2O.
Полное ионное уравнение реакции:
![]()
В данном случае полное ионное уравнение реакции совпадает с сокращенным. Эта реакция протекает до конца, о чем свидетельствуют сразу два факта: образование вещества, нерастворимого в воде, и выделение воды.
