
- •1. Основные законы химии
- •1.1 Моль. Количество вещества эквивалента (эквивалент) и молярная масса эквивалента (эквивалентная масса) простых и сложных веществ. Закон эквивалентов
- •2. Строение атома и химическая связь
- •2.1 Строение атома
- •2.2 Химическая связь и строение молекул.
- •3. Энергетика химических процессов
- •3.1 Химическое сродство.
- •4. Химическая кинетика и равновесие
- •5. Дисперсные системы
- •5.1 Способы выражения концентрации раствора
- •5.3 Ионно-молекулярные (ионные) реакции обмена
- •5.4 Гидролиз солей
- •6.Окислительно-восстановительные
- •6.1 Электродные потенциалы и электродвижущие силы
- •6.2 Электролиз
- •6.3 Коррозия металлов
- •7. Комплексные соединения
- •8. Жесткость воды и методы ее устранения
- •9.Теория строения органических соединений
- •9.1 Теория а.М. Бутлерова
- •9.2 Углеродные цепи и изомерия
- •9.3 Электронные структуры органических соединений
- •10. Классификация органических соединении.
- •10.1 Радикалы
- •10.2 Функциональные группы
- •10.3 Типы реакций органических соединений
- •11. Реакции полимеризации.
- •11.1 Полимеризация органических соединений
- •11.2 Полимеризация углеводородов с двойной связью
- •11.3 Сополимеризация.
- •11.4 Ионная полимеризация.
- •11.5 Пространственная изомерия
- •12. Кристаллическое состояние
- •12.1 Основные понятия
- •12.2 Симметрия кристаллов. Система кристаллов
- •12.3 Кристаллические решетки
- •13. Сплавы
- •13.1 Диаграммы состояния металлических систем.
4. Химическая кинетика и равновесие
Кинетика
— учение о скорости различных процессов,
в том числе
химических реакций. Критерием
принципиальной осуществимости
реакций является неравенство ∆Gр.Т
< 0. Но это неравенство
не является полной гарантией фактического
течения процесса в данных условиях,
не является достаточным для оценки
кинетических
возможностей реакции. Так,
∆G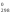 Н2О(г)
= -228,59 кДж/моль,
a
∆G
Н2О(г)
= -228,59 кДж/моль,
a
∆G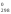 All3
(к) = -313,8 кДж/моль и, следовательно, при
Т
= 298
К и р
=
1,013 * 105
Па возможны реакции, идущие по уравнениям:
All3
(к) = -313,8 кДж/моль и, следовательно, при
Т
= 298
К и р
=
1,013 * 105
Па возможны реакции, идущие по уравнениям:
Н2(г) + ½ О2(г) = Н2О(г) (I)
2А1(к) + 3I2(к) = 2Аll3(к) (II)
Однако эти реакции при стандартных условиях идут только в присутствии катализатора (платина для первой и вода для второй). Катализатор как бы снимает кинетический «тормоз» и проявляется термодинамическая природа вещества. Скорость химических реакций зависит от многих факторов, основные из которых — концентрация (давление) реагентов, температура и действие катализатора. Эти же факторы определяют и достижение равновесия в реагирующей системе.
Пример 1. Во сколько раз изменится скорость прямой и обратной реакции в системе
2SO2(г)
+ О2(г)
 2SO3(r)
2SO3(r)
если объем газовой смеси уменьшится в три раза? В какую сторону сместится равновесие системы?
Решение. Обозначим концентрации реагирующих веществ: [SO2] = а, [Q2] = b, [SO3] = с. Согласно закону действующих масс, скорости прямой и обратной реакций до изменения объема равны
vпр= Ка2b, vобр = К1с2
После уменьшения объема гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза: [SO2] = 3а, [О2] = 3b; [SO3] = 3с. При новых концентрациях скорости v'np прямой и обратной реакций:
v'np = K(3a)2 (3b) = 27 Ka2b; vo6p = K1(3c)2 = 9K1c2 .
Отсюда
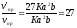 ;
;

 Следовательно,
скорость прямой реакции увеличилась в
27 раз, а обратной — только в девять раз.
Равновесие системы сместилось в
сторону образования SO3.
Следовательно,
скорость прямой реакции увеличилась в
27 раз, а обратной — только в девять раз.
Равновесие системы сместилось в
сторону образования SO3.
Пример 2. Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70 0С, если температурный коэффициент реакции равен 2.
Решение. Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле
 ;
;
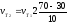 =
=
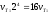
Следовательно,
скорость реакции vT при
70°С больше
скорости
реакции vT
при
70°С больше
скорости
реакции vT при
30° С в 16 раз.
при
30° С в 16 раз.
Пример
3. Константа
равновесия гомогенной системы
СО(г)
+ Н2О(г)
 СО2(г)
+ Н2(г)
СО2(г)
+ Н2(г)
при
850° С равна 1. Вычислите концентрации
всех веществ
 при
равновесии,
если исходные концентрации: [СО]ИСХ
= 3 моль/л, [Н2О]ИСХ
= 2 моль/л.
при
равновесии,
если исходные концентрации: [СО]ИСХ
= 3 моль/л, [Н2О]ИСХ
= 2 моль/л.
Решение. При равновесии скорости прямой и обратной реакций равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы:
Vnp – К 1 [СО][Н2О]; vo6p = К2[СО2][Н2];
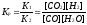
В условии задачи даны исходные концентрации, тогда как в выражение Кр входят только равновесные концентрации всех веществ системы. Предположим, что к моменту равновесия концентрация [СО2]Р = х моль/л. Согласно уравнению системы число молей образовавшегося водорода при этом будет также х моль/л. По столько же молей (х моль/л) СО и Н2О расходуется для образования по х молей СО2 и Н2 . Следовательно, равновесные концентрации всех четырех веществ (моль/л):
[СО2]Р = [Н2]р = х; [СО]Р = (3 –х); [H2O]P =(2-х).
Зная константу равновесия, находим значение х, а затем исходные концентрации всех веществ:
 ;
х2=6-2х-3х
+ х2;
5х
= 6, л = 1,2 моль/л.
;
х2=6-2х-3х
+ х2;
5х
= 6, л = 1,2 моль/л.
Таким образом, искомые равновесные концентрации: [СО2]Р = = 1,2 моль/л; [Н2]р = 1,2 моль/л; [СО]Р= 3 - 1,2 = 1,8 моль/л; [Н2О]Р = = 2- 1,2 = 0,8 моль/л.
Пример 4. Эндотермическая реакция разложения пента-хлорида фосфора протекает по уравнению
РС15(г)
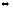 РС13(г)
+ С12(г);
∆Н = +92,59 кДж.
РС13(г)
+ С12(г);
∆Н = +92,59 кДж.
Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции — разложения РСl5?
Решение. Смещением или сдвигом химического равновесия называют изменение равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции. Направление, в котором сместилось равновесие, определяется по принципу Ле Шателье: а) так как реакция разложения РС15 эндотермическая (∆Н > 0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру: б) так как в данной системе разложение РС15 ведет к увеличению объема (из одной молекулы газа образуются две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление; в) смещения равновесия в указанном направлении можно достигнуть как увеличением концентрации РС15, так и уменьшением концентрации РСl3 или С12
