
- •1 Вопрос. Основные этапы развития эо АиТ.
- •2 Вопрос. Состав и классификация систем эо.
- •3 Вопрос. Виды схем эо АиТ, принципы их построения, условные обозначения.
- •Электрооборудования, применяемых на отечественных автомобилях
- •4 Вопрос. Условия эксплуатации эо АиТ.
- •1 Вопрос. Назначение, условия эксплуатации и требования к аккумуляторным батареям (акб).
- •2 Вопрос. Принцип действия, устройство и конструктивные схемы
- •2 Вопрос. Принцип действия, устройство и конструктивные схемы акб.
- •1 Вопрос. Характеристики акб.
- •4 Вопрос. Эксплуатация и основные неисправности акб.
- •1 Вопрос. Тенденции развития автомобильных генераторных установок.
- •2 Вопрос. Принцип действия, конструкция и характеристики генераторных установок.
- •1 Вопрос. Схемы генераторных установок и принципы регулирования напряжения.
- •2 Вопрос. Параллельная работа генератора и аккумуляторной батареи.
- •Электрические схемы генераторных установок.
- •На автомобиле генератор и аккумуляторная батарея включены параллельно и работают совместно, дополняя друг друга в зависимости от нагрузки.
- •Iгmax – требуемый максимальный ток генератора.
- •1 Вопрос. Пусковые качества двигателей внутреннего сгорания.
- •2 Вопрос. Назначение, схема системы электростартерного пуска и основные требования к ней.
- •1. Автономным источником электроэнергии системы является аккумуляторная батарея, обладающая ограниченной мощностью.
- •1 Вопрос. Устройство электростартеров.
- •2 Вопрос. Схемы управления электростартерами.
- •1 Вопрос. Эксплуатация электростартеров.
- •2 Вопрос. Основные неисправности электростартеров, способы их
- •1 Вопрос. Приборы накаливания и подогрева воздуха.
- •1.3. Электрофакельные подогреватели воздуха.
- •2 Вопрос. Устройства для подачи пусковой жидкости.
- •3 Вопрос. Электрические и предпусковые подогреватели.
- •1 Вопрос. Назначение и классификация систем зажигания.
- •2 Вопрос. Требования к системам зажигания. Основные параметры систем зажигания.
- •1 Вопрос. Принцип действия контактной (классической) системы зажигания. Характеристики системы зажигания.
- •2 Вопрос. Конструкция элементов системы зажигания.
- •1 Вопрос. Основные направления развития систем зажигания.
- •2 Вопрос. Конструкция элементов и узлов электронных систем зажигания.
- •1 Вопрос. Электронные системы управления топливоподачей бензиновых двигателей.
- •2 Вопрос. Электронные системы управления топливоподачей дизелей.
2 Вопрос. Принцип действия, устройство и конструктивные схемы акб.
Химическим источником тока называется устройство, в котором за счет протекания пространственно разделенных окиспитльно-восстановительных химических реакций их свободная энергия преобразуется в электрическую.
По xарактеру работы эти источники делятся на две группы:
• первичные химические источники тока или гальванические элементы;
• вторичные источники или электрические аккумуляторы.
Первичные источники допускают только однократное использование, так как вещества, образующиеся при их разряде не могут быть превращены в исходные активные материалы. Полностью разряженный гальванический элемент, как правило, к дальнейшей работе непригоден − он является необратимым источником энергии.
Вторичные химические источники тока являются обратимыми источниками энергии — после как угодно глубокого разряда их работоспособность можно полностью восстановить путем заряда. Для этого через вторичный источник достаточно пропустить, электрический ток в направлении, обратном тому, в котором он протекал при разряде. В процессе заряда образовавшиеся при разряде вещества, превращаются в первоначальные активные материалы. Так происходит многократное превращение свободной энергии химического источника тока в электрическую энергию (разряд аккумулятора) и обратное превращение электрической энергии в свободную энергию химического источника тока (заряд аккумулятора).
Прохождение тока через электрохимические системы связано с происходящими при этом химическими реакциями (превращениями). Поэтому между количеством вещества, вступившего в электрохимическую реакцию и подвергшегося превращениям, и количеством затраченного или высвободившегося при этом электричества существует зависимость, которая была установлена Майклом Фарадеем.
Согласно первому закону Фарадея масса вещества, вступившего в электродную реакцию или получившегося в результате ее протекания (Δm), пропорциональна количеству электричества (q), прошедшего через систему:
Δm = kэ q = kэ I t ,
где I- сила тока, проходящего через электрохимическую систему;
t- время, в течении которого проходит ток;
kэ- коэффициент пропорциональности, который называется электрохимическим эквивалентом и характеризует количество вещества, прореагировавшего при прохождении через систему единицы электрического заряда.
Согласно второму закону Фарадея, при равном количестве прошедшего через систему электричества массы прореагировавших веществ относятся между собой как их химические эквиваленты А (А = mА / Z, где mА- атомный вес вещества, Z- заряд иона):
Δm1 / А1 = Δm2 / А2 = const.
На практике этот закон не соблюдается, так как параллельно основным электрохимическим реакциям идут побочные. Это учитывает параметр Bm- выход по току:
Bm = (qi / Σq) 100%.
где qi- количество электричества, расходуемого на основную реакцию;
Σq- общее количество прошедшего через систему электричества.
Свинцовые аккумуляторы являются вторичными химическими источниками тока, которые могут использоваться многократно. Активные материалы, израсходованные в процессе разряда, восстанавливаются при последующем заряде.
Химический источник тока представляет собой совокупность реагентов (окислителя и восстановителя) и электролита. Восстановитель (отрицательный электрод) электрохимической системы в процессе токообразующей реакции отдает электроны и окисляется, а окислитель (положительный электрод) восстанавливается. Электролитом, как правило, является жидкое химическое соединение, обладающее хорошей ионной и малой электронной проводимостью.
В свинцовом аккумуляторе в токообразующих процессах участвуют двуокись свинца (диоксид свинца) РЬО2 (окислитель) положительного электрода, губчатый свинец РЬ (восстановитель) отрицательного электрода и электролит (водный раствор серной кислоты H2SО4). Активные вещества электродов представляют собой относительно жесткую пористую электронопроводящую массу с диаметром пор 1,5 мкм у PbO2 и 5-10 мкм у губчатого свинца. Объемная пористость активных веществ в заряженном состоянии - около 50%.
Часть серной кислоты в электролите диссоциирована на положительные ионы водорода Н+ и отрицательные ионы кислотного остатка SO42-. Губчатый свинец при разряде аккумулятора выделяет в электролит положительные ионы .(двухвалентного свинца РЬ2+. Избыточные электроны отрицательного электрода по внешнему участку замкнутой электрической цепи перемещаются к положитепьному электроду, где восстанавливают четырехвалентные ионы свинца РЬ4+ до двухвалентного свинца РЬ2+. Положительные ионы свинца РЬ2+ соединяются с отрицательными ионами кислотного остатка SO42-, образуя на обоих электродах сернокислый свинец PbSО4 (сульфат свинца).
При подключении аккумулятора к зарядному устройству электроны движутся к отрицательному электроду, нейтрализуя двухвалентные ионы свинца РЬ2+. На электроде выделяется губчатый свинец РЬ. Отдавая под влиянием напряжения внешнего источника тока по два электрона, двухвалентные ионы свинца РЬ2+ у положительного электрода окисляются в четырехвалентные ионы РЬ4+. Через промежуточные реакции ионы РЬ4+. соединяются с двумя ионами кислорода и образуют двуокись свинца PbO2,
Химические реакции в свинцовом аккумуляторе описываются уравнением:
разряд
Р
 ЬО2
+ 2H2SО4
+ РЬ
2PbSО4
+ 2Н2О.
ЬО2
+ 2H2SО4
+ РЬ
2PbSО4
+ 2Н2О.
заряд
RН
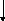 ●
●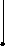
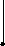




I ●

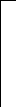
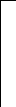 +
─
+
─


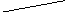 Pb
→ Pb2+
Pb
→ Pb2+
P
 b4+→
Pb2+
b4+→
Pb2+

 ↑
↑
P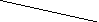
 b
O2
H2
SO4
+ H2
O
b
O2
H2
SO4
+ H2
O
↓ ↓ ↓

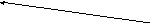 H+
← 2O2–
2H+
SO42-
H+
← 2O2–
2H+
SO42-


 ↓
↓
H2 O
Pb SO4
Рис. 2.1. Процесс разряда аккумулятора.
Содержание в электролите серной кислоты и плотность электролита уменьшаются при разряде и увеличиваются при заряде. По плотности электролита судят о степени разряженности свинцового аккумулятора:
100 (pЗ - p25)
 ΔСр
= ,
ΔСр
= ,
pЗ - pр
где ΔСр - степень разряженности аккумулятора, %;
Рз и Рр ~ плотность электролита соответственно полностью заряженного и полностью разряженного аккумулятора при температуре 25°С, г/см2;
p25- измеренная плотность электролита, приведенная к температуре 25°С, г/см3.
Расход кислоты у положительных электродов больше, чем у отрицательных. Если учитывать количество воды, образующейся у положительных электродов, то количество кислоты, необходимое для них в течение разряда, в 1,6 раза больше, чем для отрицательных. При разряде происходит незначительное увеличение объема электролита, а при заряде - уменьшение (около 1 см3 на 1 А·ч). На 1 А·ч электрической емкости расходуется: при разряде - свинца 3,86 г, диоксида свинца 4,44 г, серной кислоты 3,67 г, а при заряде - воды 0,672 г, сульфата свинца 11,6 г.
Устройство.
Различные типы стартерных АКБ имеют свои конструктивные особенности, однако в их устройстве много общего. Каждый аккумулятор состоит из пространственно разделенных разноименных электродов, погруженных в раствор электролита и помещенных в прочный сосуд, который устойчив к химическому воздействию электролита, механическим нагрузкам и температурным колебаниям.
П


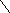 робка
Борн
Полюсной мостик
робка
Борн
Полюсной мостик






















 Сепаратор
Сепаратор




Корпус Сепаратор
Перемычка

 Электроды
Электроды





Призма





Рис. 2.2. Устройство аккумулятора с отдельными крышками.
По конструктивно-функциональному признаку АКБ классифицируют следующим образом: обычной (классической) конструкции- а) в моноблоке с ячеечными крышками и межэлементными перемычками над крышками; б) в моноблоке с общей крышкой и межэлементными перемычками под крышкой; батареи необслуживаемые – с общей крышкой, не требующие ухода в эксплуатации; герметизированные батареи с иммобилизованным электролитом.
Электролит.
Электролит готовится из серной кислоты (ГОСТ 667-73) и дистиллированной воды (ГОСТ 6709-72). От химической чистоты электролита зависят характеристики и срок службы батареи. Кислоту подразделяют на два сорта (А и Б) в зависимости от количества примесей (железа, марганца, меди, мышьяка, оксидов азота и т.д.). Концентрированная серная кислота – прозрачная жидкость без цвета и запаха плотностью 1,83 г/см3, в которой содержится 94% чистой серной кислоты. Температура кипения кислоты равна 33 0С. Температура заливаемого в аккумуляторы электролита должна быть в пределах 15-30 0С. Плотность электролита заряженной батареи зависит от климатического района (для Казани – 1,28 г/см3). Температура замерзания электролита зависит от плотности электролита и составляет от –7 0С (ρ = 1,09) до –680С (ρ = 1,30 г/см3).
Необслуживаемые батареи.
Традиционные стартерные батареи имеют достаточно высокие электрические характеристики, однако обладают рядом существенных недостатков. В процессе эксплуатации батареи снижается уровень электролита, что требует периодического (1-2 раза в месяц) добавления дистиллированной воды, проверки плотности электролита и в случае необходимости выравнивания значений плотности по отдельным аккумуляторам
При хранении происходит саморазряд батареи, который обычно составляет 0,5-0,8 % в сутки, увеличиваясь с повышением температуры. В случае хранения батареи при положительных температурах ее следует подзаряжать. Интенсивность электролиза электролита и сопутствующей ему коррозии решеток возрастает при перезарядке, повышении температуры и длительном использовании батареи.
Выделяемая при работе свинцовой батареи кислородно-водородная смесь взрывоопасна, газы и пары электролита могут вызвать коррозию металлических деталей автомобиля, расположенных рядом с батареей, а также полюсных выводов и деталей крепления самой батареи. Некоторые вещества, образующиеся при эксплуатации батареи, например стибин-сурьмянистый водород, токсичны.
Отмеченные недостатки, характерные для обычных (традиционных) батарей, связаны с содержанием 4-6 % сурьмы в сплаве свинца, из которого отливаются решетки электродов.
Появление необслуживаемых батарей стало возможным благодаря применению решеток из свинцово-кальциевого сплава или свинцово-сурьмянистого сплава с уменьшенным содержанием сурьмы.
Необслуживаемые батареи со свинцово-кальциевыми решетками отличаются не только малыми газовыделением и саморазрядом, но и другими преимуществами. Эти батареи можно устанавливать в местах, не требующих удобного доступа для обслуживания. Коррозия решеток электродов меньше. Батареи имеют лучшие характеристики стартерного режима разряда. Добавления воды в процессе эксплуатации не требуется, это конструкцией батареи не предусмотрено.
Отличительными особенностями необслуживаемых батарей являются:
-
применение сепараторов-конвертов;
-
установка блока электродов с сепараторами-конвертами на дно моноблока и их приклейка к дну, что позволяет повысить стойкость к вибрации и увеличить объем электролита;
-
уменьшение толщины и сопротивления решеток электродов;
-
применение укороченных межэлементных соединений, проходящих через
перегородки пластмассовых моноблоков;
-
расположение ушек электродов не у их краев, а ближе к середине, что
обеспечивает лучшее токораспределение при разряде и заряде;
-
использование полипропилена для изготовления моноблоков и общих
крышек;
-
использование индикаторов состояния батареи;
-
применение выводов из коррозионно-стойкой стали под болт или гайку;
-
прикрепление блока электродов к баретке с помощью полиуретана для
повышения стойкости к вибрации.
К недостаткам необслуживаемых батарей со свинцово-кальциевыми решетками электродов можно отнести:
-
невозможность определить состояние батареи по плотности электролита,
так как отсутствуют заливные пробки; заряженность таких батарей определяется только по индикатору заряженности;
-
при интенсивном заряде возможно снижение емкости, поэтому
рекомендуется регулировать напряжение генератора в пределах 14,2-14,4 В.
Перспективно применение на автомобилях конструкций герметичных необслуживаемых батарей с рекомбинацией выделяющихся газов и встроенными в крышки регулировочными клапанами, которые открываются при избыточном давлении газов. Такие батареи имеют обозначение VRLА.
Герметизированные батареи с иммобилизованным электролитом.
Создание полностью необслуживаемой батареи свинцово-кислотной системы
становится возможным, если ее конструкцию изменить таким образом, чтобы связать выделяющийся газ (реализация кислородного цикла). Для этого емкость отрицательных электродов в аккумуляторе должна быть на несколько процентов больше емкости положительных. Тогда в процессе заряда положительные электроды полностью зарядятся раньше, чем отрицательные. Поэтому активное выделение кислорода на положительном электроде начнется до начала заметного выделения водорода на отрицательном. Выделяющийся кислород вступает в химическую реакцию с активной массой отрицательного электрода.
Поэтому для производства герметизированных батарей разработаны методы связывания жидкого электролита:
• создание загущенного (гелеобразного) электролита;
• абсорбция жидкого электролита в сепараторах с высокой объемной пористостью.
Искусственное ограничение емкости положительных электродов и объема электролита приводят к тому, что емкость герметизированных свинцовых батарей с иммобилизованным электролитом на 15-20 % ниже, чем батарей со свободным электролитом того же объема и массы.
В качестве загустителя для получения гелеобразного электролита применяют силикагель, аллюмогель и другие вещества. При смачивании серной кислотой эти вещества образуют тиксотропный гель. В качестве сепараторов в подавляющем большинстве герметизированных аккумуляторов применяют стекломаты из ультратонких волокон. Объемная пористость современных стеклосепараторов достигает 80-85 %. Поэтому их используют не только для батарей с гелеобразным электролитом, но и для батарей с абсорбированным жидким электролитом. Свинцовые батареи с иммобилизованным электролитом являются герметизированными, но не являются герметичными как, например, никель-кадмиевые герметичные аккумуляторы. Во всех свинцовых герметизированных батареях (аккумуляторах) имеется предохранительный клапан. Он служит для того, чтобы давление внутри аккумулятора не превышало величины, которая является допустимой по условиям работоспособности и прочности корпусных деталей. Дело в том, что, несмотря на применяемые ограничения емкости положительных электродов, выделение водорода на отрицательном электроде в процессе заряда, особенно на заключительной его стадии, полностью подавить невозможно. Причем скорость его выделения в конце зарядного процесса несколько выше, чем скорость выделения кислорода. Избыточная часть водорода вызывает рост давления внутри аккумулятора, для ограничения которого и служит клапан.
Нормальная эксплуатация герметизированных свинцовых батарей возможна при соблюдении гораздо более жесткого диапазона регулирования зарядного напряжения, чем при эксплуатации необслуживаемых батарей с жидким электролитом (даже не имеющих отверстий для доливки воды). Максимальная величина зарядного напряжения для батарей с загущенным (гелеобразным) электролитом составляет 14,35 В. В случае превышения этой величины на 0,05 В скорость газовыделения становится так велика, что нарушается равновесие кислородного цикла. Образующийся из-за этого избыток выделяющихся газов приводит к нарушению контакта активной массы электродов с электролитом и батарея теряет работоспособность У батарей с абсорбированным электролитом максимально допустимая величина зарядного напряжения ограничена 14,8 В.
Весьма жесткие ограничения уровня зарядного напряжения, наряду с гораздо более высокой стоимостью герметизированных батарей в сравнении с необслуживаемыми создают в определенные трудности для их широкого применения на автомобильной технике.
Маркировка батареи.
Условное обозначение типа батареи (например, батарея 6СТ-50А) содержит указание на число последовательно соединенных аккумуляторов в батарее (3 или 6), характеризующих ее номинальное напряжение UН (6 или 12 В), указание на назначение по функциональному признаку (СТ - стартерная), номинальную емкость С20 в ампер-часах и исполнение (при необходимости): А означает наличие общей крышки; Н - несухозаряженная; 3 - необслуживаемая, залитая электролитом и полностью заряженная.
В условных обозначениях широко применяемых в настоящее время батарей буквы Э и Т после значения номинальной емкости указывают на материал моноблока (соответственно эбонит и термопласт). Последующие буквы обозначают материал сепаратора (М - мипласт, Р - мипор).
На батарею должна быть нанесена маркировка по ГОСТ 18620-86Е, содержащая:
-
товарный знак предприятия-изготовителя;
-
условное обозначение (тип) батареи;
-
знаки полярности "+" и "—";
-
дату изготовления (месяц, год);
-
обозначение стандарта и технических условий на батарею конкретного
типа: номинальную емкость в ампер-часах и номинальное напряжение в вольтах для батарей с общей крышкой и необслуживаемых; силу разрядного тока в амперах, если он больше 3С20 при —18 °С; клеймо технического контроля. На батареях обычной конструкции, предназначенных для эксплуатации в странах с тропическим климатом, дополнительно наносят букву Т.
Лекция 3. Система генерирования. Характеристики и эксплуатация аккумуляторных батарей.
1 вопрос. Характеристики АКБ.
2 вопрос. Эксплуатация и основные неисправности АКБ.
