
- •1.Переміщення, швидкість, прискорення
- •5.Перший закон Ньютона: в інерціальній системі відліку матеріальна точка зберігає стан спокою або рівномірного прямолінійного руху, якщо на неї не діють інші тіла або дія зовнішніх тіл скомпенсована.
- •Робота змінної сили.
- •Кінетична та потенціальна енергії. Енергія пружно деформованого тіла.
- •Закон збереження енергії в механіці. Консервативні та дисипативні системи.
- •Поняття абсолютно твердого тіла. Обертання твердого тіла навкруги нерухомої осі, його момент інерції. 13.Кінетична енергія обертаючогося твердого тіла.
- •Основний закон динаміки обертального руху.
- •14.Закон збереження моменту імпульсу для системи тіл.
- •16. Гравітаційне поле та його напруженість. Поняття потенціалу та його градієнт.(16.03лекция)
- •17. Застосування законів збереження до пружного та непружного удару.
- •18.Термодинамічний та молекулярно-кінетичний методи вивчення тіл. Термодинамічні параметри.
- •19.Поняття ідеального газу. Основне рівняння молекулярно-кінетичної теорії газів.
- •20.Середня енергія молекули. Молекулярно-кінетичне тлумачення температури.
- •21.Рівняння стану ідеального газу. Суміші газів.
- •Максвелівський розподіл молекул за швидкостями. Середньостатистичні значення швидкостей руху молекул та їх взаємозв’язок
- •Барометрична формула.
- •1 Предмет дослідження. Термодинамічні системи. Термодинамічні параметри. Термодинамічний та статистичний методи дослідження термодинамічних систем.
- •2 Ідеальний газ як модельне тіло для дослідження термодинамічних систем. Дослідні газові закони. Рівняння стану ідеальних газів.
- •Термодинаміка. Перший закон термодинаміки
- •1 Термодинамічна система. Внутрішня енергія термодинамічної системи. Робота та кількість теплоти. Перший закон термодинаміки
- •2 Теплоємність тіл. Застосування першого закону термодинаміки до ізопроцесів. Теплоємність ідеальних газів в ізопроцесах
- •1 Предмет дослідження. Термодинамічні системи. Термодинамічні параметри. Термодинамічний та статистичний методи дослідження термодинамічних систем.
- •2 Ідеальний газ як модельне тіло для дослідження термодинамічних систем. Дослідні газові закони. Рівняння стану ідеальних газів.
- •Адіабатичний процес. Внутрішня енергія та робота в адіабатичному процесі. Рівняння Пуасона
- •29.Робота, яка здійснюється газом в різних процесах.
- •30.Явище переносу в газах: дифузія, теплопровідність (вивести), внутрішнє тертя
- •31.Колові, незворотні та зворотній процеси. Принцип дії теплової та холодильної машин
- •32. Ідеальна теплова машина Карно та її ккд. Абсолютна шкала температур.
- •33.Ентропія.
- •34.Друге начало термодинаміки та його статистичний зміст. Зв'язок ентропії та ймовірності стану.
- •35. Відступ від законів ідеальних газів. Сили тяжіння та відштовхування у реальних газів
- •36. Рівняння Ван-дер-Вальса та його аналіз. Критичний стан.
- •Внутрішня енергія реального газу.
- •38. Ефект Джоуля-Томсона. Точка інверсії.
- •39. Зниження газів, роботи Капиці.
- •Характеристика рідинного стану рідини. Поверхневий шар. Поверхневе на тяжіння. Формула Лапласа.
- •Явище змочення. Капілярні явища.
- •Кристалічні та аморфні тіла. Типи кристалічних решіток.
- •Фазові перетворення
- •[Править]Теорема Гаусса для электрической индукции (электрическое смещение)
- •[Править]Теорема Гаусса для магнитной индукции
- •49.]Применение теоремы Гаусса
- •[Править]Расчёт напряжённости бесконечной плоскости
- •[Править]Расчёт напряжённости бесконечной нити
- •[Править]Следствия из теоремы Гаусса
- •50. Робота сил поля при переміщенні заряду.
- •52. Провідники та діелектрики. Полярні та неполярні діелектрики. Поляризація орієнтаційна та деформаційна.
- •53. Вектор поляризації. Напруга поля діелектрика. Діелектрична проникненність.
- •54. Електричне зміщення. Теорема Гауса для поля у діелектрику.
- •55. П’єзоелектричний та електрострикційний ефекти. Сегнетоелектрики.
- •56. Електроємність провідників. Конденсатори.
- •57. Енергія зарядженого провідника. Енергія електростатичного поля.
- •58. Сила струму. Вектор густини струму.
- •60. Диференційна форма законів Ома.
- •61. Диференційна форма закону Джоуля-Ленца.
- •62. Закон Ома для однорідної ділянки ланцюга, для замкненого ланцюга.
Барометрична формула.
Закон, що встановлює загальній розподіл рівноважного ідеального газу за енергіями був теоретично побудований австрійським фізиком Людвігом Больцманом в 1866 році. Формула рівноважного больцманівського розподілу лягла в основу класичної статистичної фізики. Не вдаючись в складні викладки зроблені Больцманом, ми зможемо записати закон розглянувши розподіл молекул рівноважної термодинамічної системи, що знаходиться під впливом зовнішнього потенціального силового поля, поля сили земного тяжіння, наприклад. Цей підхід має самостійне значення, тому що дозволяє встановити розподіл концентрації молекул повітря та тиску атмосфери по висоті. Взагалі кажучи, стовп атмосфери має різну температуру по висоті підняття над поверхнею Землі. Але взявши середню температура за 250 К маємо зміни температури від 200 К до 300 К тобто 50К або 20% в верхніх шарах атмосфери та біля поверхні Землі. Для отримання теоретичної залежності будемо вважати атмосферу рівноважним ідеальним газом з молекулярною масою 29 г/моль, що знаходиться під дією поля сил тяжіння.
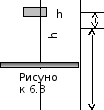
Виділимо елемент висоти стовпа повітря dh, що відповідає зміні тиску на dp (рис. 6.3):
 (6.19)
(6.19)
Для отримання інтегральної форми звернемо увагу на те, що в виразі (6.19) три змінні величини. Зменшимо кількість змінних скориставшись рівнянням стану ідеальних газів (5.10) для виразу густину повітря через тиск:
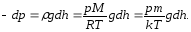 (6.20)
(6.20)
Рівняння
(6.20) інтегрується розділенням змінних: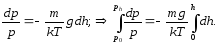
Після інтегрування маємо:
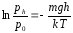 або
або
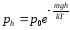 (6.21)
(6.21)
де рh та p0 відповідно тиск повітря на висоті h та біля поверхні Землі. Формула (6.21) встановлює залежність тиску повітря від висоти підняття на нульовим рівнем і носить назву барометричної формули. Скориставшись рівнянням стану ідеальних газів у формі (5.11), барометричну формулу можна переписати для залежності концентрації молекул від висоти підняття над нульовим рівнем:
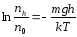 або
або
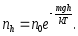 (6.22)
(6.22)
Якщо температура атмосфери планети прагне до нескінченості, тиск та концентрація молекул повітря не залежать від висоти, молекули рівномірно розподіляться по висоті, атмосфера залишить планету. Навпаки, якщо температура атмосфери прагне до нуля всі молекули повітря ляжуть на нульовий рівень. Звісно йдеться про теоретичні можливості, що випливають з барометричної формули.
Використання
барометричної формули дало можливість
французькому досліднику Жану Батисту
Перену в 1909 році експериментально
визначити число Авогадро. В дослідах
Перена вивчався розподіл концентрації
дрібнодисперсних часток смоли гумігуту
в воді. Тому що використовувались не
молекули а частинки значно більших
розмірів, замість маси необхідно було
брати до уваги ефективну масу з врахуванням
виштовхувальної сили
 ,
де ,
0
відповідно густина речовини гумігуту
і води, а
– діаметр частинок. Таким чином
,
де ,
0
відповідно густина речовини гумігуту
і води, а
– діаметр частинок. Таким чином
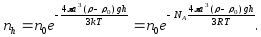 (6.23)
(6.23)
Звідки
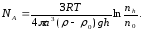 (6.24)
(6.24)
Концентрація часток в шарах емульсії та відстань між ними h вимірювалась за допомогою мікроскопа.
В дослідах Перена змінювались температура та розмір зерен частинок емульсії. У всіх дослідах значення постійної Авогадро отримано близьким до 6,8·1023 моль-1, що непогано співпадає з сучасним значенням цієї константи.
Якщо зважити на те що mgh = Еп – потенціальна енергія молекул повітря в полі сили тяжіння, то барометричну формулу (6.22) можна переписати у вигляді, що дає розподіл молекул у потенціальному полі:
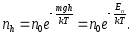 (6.25)
(6.25)
Больцмана
показав, що такий закон має місце для
розподілу концентрації молекул ідеальних
газів в довільному потенціальному полі.
Він також довів, що розподіл (6.11)
виконується в мікро об’ємах рівноважних
газів, що знаходяться в зовнішніх
потенціальних полях. Зважаючи на той
факт, що
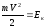 та на незалежність розподілів молекул
за кінетичною та за потенціальною
енергіями, можна стверджувати, що функція
розподілу молекул рівноважного ідеального
газу за енергіями
та на незалежність розподілів молекул
за кінетичною та за потенціальною
енергіями, можна стверджувати, що функція
розподілу молекул рівноважного ідеального
газу за енергіями


де А – постійна величина, що знаходиться з умови нормування (6.7). Функція
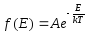 (6.26)
(6.26)
репрезентує закон розподілу молекул рівноважного класичного ідеального газу за енергіями, розподіл Больцмана.
24
Атомний радіус для вільного атома визначається розмірами його електронної оболонки і дорівнює середній відстані між ядром атома та найвіддаленішою орбітальною електронною оболонкою атома. Атомний радіус вимірюється в пікометрах або ангстремах.
В молекулах і кристалах атоми мають певний ефективний атомний радіус, який залежить від типу хімічного зв'язку. Для позначення такого атомного радіуса використовують поняття ковалентний радіус, який дорівнює половині відстані між ядрами двох суміжних атомів (які є ковалентно пов'язаними або сусідять в кристалічній решітці) простих речовин.
Для відносних величин атомних радіусів існує їх залежність від номеру хімічного елементу в періодичній таблиці:
-
В періодах орбітальні атомні радіуси по мірі збільшення заряду ядра Z монотонно зменшуються по причині росту сили взаємодії зовнішніх електронів з ядром.
-
В підгрупах радіуси в основному збільшуються по причині збільшення кількості електронних оболонок.
25
Одним із фундаментальних положень класичної теорії є теорема про рівномірний розподіл енергії по ступенях свободи термодинамічної системи.
Під ступенями свободи розуміють кількість незалежних координат, необхідних для визначення положення тіла в просторі. Теорема стверджує, що на довільну ступінь свободи тіла в середньому приходиться одна і та сама енергія [з цим положенням і узгоджується рівняння (5.6)]:
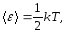 (5.16)
(5.16)
де
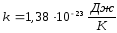 - стала Больцмана.
- стала Больцмана.
-
Теорема про рівнорозподіл енергії за ступенями свободи (принцип Больцмана) Внутрішня енергія ідеального газу.
