
- •1.Переміщення, швидкість, прискорення
- •5.Перший закон Ньютона: в інерціальній системі відліку матеріальна точка зберігає стан спокою або рівномірного прямолінійного руху, якщо на неї не діють інші тіла або дія зовнішніх тіл скомпенсована.
- •Робота змінної сили.
- •Кінетична та потенціальна енергії. Енергія пружно деформованого тіла.
- •Закон збереження енергії в механіці. Консервативні та дисипативні системи.
- •Поняття абсолютно твердого тіла. Обертання твердого тіла навкруги нерухомої осі, його момент інерції. 13.Кінетична енергія обертаючогося твердого тіла.
- •Основний закон динаміки обертального руху.
- •14.Закон збереження моменту імпульсу для системи тіл.
- •16. Гравітаційне поле та його напруженість. Поняття потенціалу та його градієнт.(16.03лекция)
- •17. Застосування законів збереження до пружного та непружного удару.
- •18.Термодинамічний та молекулярно-кінетичний методи вивчення тіл. Термодинамічні параметри.
- •19.Поняття ідеального газу. Основне рівняння молекулярно-кінетичної теорії газів.
- •20.Середня енергія молекули. Молекулярно-кінетичне тлумачення температури.
- •21.Рівняння стану ідеального газу. Суміші газів.
- •Максвелівський розподіл молекул за швидкостями. Середньостатистичні значення швидкостей руху молекул та їх взаємозв’язок
- •Барометрична формула.
- •1 Предмет дослідження. Термодинамічні системи. Термодинамічні параметри. Термодинамічний та статистичний методи дослідження термодинамічних систем.
- •2 Ідеальний газ як модельне тіло для дослідження термодинамічних систем. Дослідні газові закони. Рівняння стану ідеальних газів.
- •Термодинаміка. Перший закон термодинаміки
- •1 Термодинамічна система. Внутрішня енергія термодинамічної системи. Робота та кількість теплоти. Перший закон термодинаміки
- •2 Теплоємність тіл. Застосування першого закону термодинаміки до ізопроцесів. Теплоємність ідеальних газів в ізопроцесах
- •1 Предмет дослідження. Термодинамічні системи. Термодинамічні параметри. Термодинамічний та статистичний методи дослідження термодинамічних систем.
- •2 Ідеальний газ як модельне тіло для дослідження термодинамічних систем. Дослідні газові закони. Рівняння стану ідеальних газів.
- •Адіабатичний процес. Внутрішня енергія та робота в адіабатичному процесі. Рівняння Пуасона
- •29.Робота, яка здійснюється газом в різних процесах.
- •30.Явище переносу в газах: дифузія, теплопровідність (вивести), внутрішнє тертя
- •31.Колові, незворотні та зворотній процеси. Принцип дії теплової та холодильної машин
- •32. Ідеальна теплова машина Карно та її ккд. Абсолютна шкала температур.
- •33.Ентропія.
- •34.Друге начало термодинаміки та його статистичний зміст. Зв'язок ентропії та ймовірності стану.
- •35. Відступ від законів ідеальних газів. Сили тяжіння та відштовхування у реальних газів
- •36. Рівняння Ван-дер-Вальса та його аналіз. Критичний стан.
- •Внутрішня енергія реального газу.
- •38. Ефект Джоуля-Томсона. Точка інверсії.
- •39. Зниження газів, роботи Капиці.
- •Характеристика рідинного стану рідини. Поверхневий шар. Поверхневе на тяжіння. Формула Лапласа.
- •Явище змочення. Капілярні явища.
- •Кристалічні та аморфні тіла. Типи кристалічних решіток.
- •Фазові перетворення
- •[Править]Теорема Гаусса для электрической индукции (электрическое смещение)
- •[Править]Теорема Гаусса для магнитной индукции
- •49.]Применение теоремы Гаусса
- •[Править]Расчёт напряжённости бесконечной плоскости
- •[Править]Расчёт напряжённости бесконечной нити
- •[Править]Следствия из теоремы Гаусса
- •50. Робота сил поля при переміщенні заряду.
- •52. Провідники та діелектрики. Полярні та неполярні діелектрики. Поляризація орієнтаційна та деформаційна.
- •53. Вектор поляризації. Напруга поля діелектрика. Діелектрична проникненність.
- •54. Електричне зміщення. Теорема Гауса для поля у діелектрику.
- •55. П’єзоелектричний та електрострикційний ефекти. Сегнетоелектрики.
- •56. Електроємність провідників. Конденсатори.
- •57. Енергія зарядженого провідника. Енергія електростатичного поля.
- •58. Сила струму. Вектор густини струму.
- •60. Диференційна форма законів Ома.
- •61. Диференційна форма закону Джоуля-Ленца.
- •62. Закон Ома для однорідної ділянки ланцюга, для замкненого ланцюга.
-
Явище змочення. Капілярні явища.
Якщо
взаємодія молекул рідини менша, ніж їх
взаємодія з молекулами контактного
твердого тіла, то маємо випадок змочування
і навпаки, коли ця взаємодія більша -
незмочування.
Інтенсивність змочування характеризується
кутом змочування Q,
який утворюється між дотичною до поверхні
рідини і поверхнею твердого тіла. Відлік
кута виконують у бік рідини. Якщо
![]() -
поверхня тіла змочувана, а якщо
-
поверхня тіла змочувана, а якщо
![]() -
незмочувана.Явища змочування і
незмочування відіграють важливе значення
в побуті і техніці, якби вода не змочувала
тіло людини, то марним було б купання.
Добре змочування потрібне під час
фарбування і прання, паяння, збагачення
руд цінних порід та інших технічних
процесів.Явище змочування і незмочування
виявляється у піднятті і спусканні
рідини в тонких трубках (капілярах).
Розглянемо капілярні
явища.Підняття
рідини в капілярі припиниться тоді,
коли сила тяжіння піднятого стовпа
рідини зрівноважить силу поверхневого
натягу:Fпов = Fтяж.Сила
поверхневого натягу Fпов = 2prs.
Сила тяжіння Fт = mg.
Оскільки m = rV = rpr2
h,
рівність (4) набуде вигляду:2prs = rpr2hg.
Із
рівності знаходимо висоту підняття
рідини для циліндричного капіляра:
-
незмочувана.Явища змочування і
незмочування відіграють важливе значення
в побуті і техніці, якби вода не змочувала
тіло людини, то марним було б купання.
Добре змочування потрібне під час
фарбування і прання, паяння, збагачення
руд цінних порід та інших технічних
процесів.Явище змочування і незмочування
виявляється у піднятті і спусканні
рідини в тонких трубках (капілярах).
Розглянемо капілярні
явища.Підняття
рідини в капілярі припиниться тоді,
коли сила тяжіння піднятого стовпа
рідини зрівноважить силу поверхневого
натягу:Fпов = Fтяж.Сила
поверхневого натягу Fпов = 2prs.
Сила тяжіння Fт = mg.
Оскільки m = rV = rpr2
h,
рівність (4) набуде вигляду:2prs = rpr2hg.
Із
рівності знаходимо висоту підняття
рідини для циліндричного капіляра:![]() де
h
- висота підняття рідини в циліндричному
капілярі; s - коефіцієнт поверхневого
натягу рідини; r - густина рідини; r
- радіус капіляра; g
- прискорення вільного падіння.Капілярні
явища мають велике значення в природі
і техніці. Завдяки цим явищам відбувається
проникнення вологи з ґрунту в стебла і
листя рослин. Саме в капілярах відбуваються
основні процеси, пов'язані з диханням
і живленням організмів. У тілі дорослої
людини приблизно 160·109
капілярів, загальна довжина яких сягає
60 - 80 тис. км.
У будівництві
враховують можливість підняття вологи
по капілярних порах будівельних
матеріалів. Для захисту фундаменту і
стін від дії ґрунтових вод та вологи
застосовують гідроізоляційні матеріали:
толь, смоли тощо.Завдяки капілярному
підняттю вдається фарбувати тканини.Часто
капілярні явища використовують і в
побуті. Застосування рушників, серветок,
гігроскопічної вати, марлі, промокального
паперу можливе завдяки наявності в них
капілярів.
де
h
- висота підняття рідини в циліндричному
капілярі; s - коефіцієнт поверхневого
натягу рідини; r - густина рідини; r
- радіус капіляра; g
- прискорення вільного падіння.Капілярні
явища мають велике значення в природі
і техніці. Завдяки цим явищам відбувається
проникнення вологи з ґрунту в стебла і
листя рослин. Саме в капілярах відбуваються
основні процеси, пов'язані з диханням
і живленням організмів. У тілі дорослої
людини приблизно 160·109
капілярів, загальна довжина яких сягає
60 - 80 тис. км.
У будівництві
враховують можливість підняття вологи
по капілярних порах будівельних
матеріалів. Для захисту фундаменту і
стін від дії ґрунтових вод та вологи
застосовують гідроізоляційні матеріали:
толь, смоли тощо.Завдяки капілярному
підняттю вдається фарбувати тканини.Часто
капілярні явища використовують і в
побуті. Застосування рушників, серветок,
гігроскопічної вати, марлі, промокального
паперу можливе завдяки наявності в них
капілярів.
-
Кристалічні та аморфні тіла. Типи кристалічних решіток.
Кристалічні тіла мають певну температуру плавлення, незмінну при сталому тиску; в’язкість аморфних речовин під час нагрівання зменшується; вони переходять у рідкий стан, розм’якшуючись поступово.Кристали характеризуються наявністю значних сил міжмолекулярної взаємодії і зберігають сталим не лише свій об’єм, а й форму. Правильна геометрична форма є істотною зовнішньою ознакою будь-якого кристала в природних умовах. Розглядаючи окремі кристали, можна переконатися, що вони обмежені плоскими, ніби шліфованими гранями у вигляді правильних багатокутників.Кристали певної речовини можуть мати різну форму, оскільки вона залежить від умов їх утворення. Монокристали і полікристали. Іноді весь шматок твердої речовини може становити собою один кристал. Такі, наприклад, шматочки цукру, солі, гірського кришталю тощо. Це все окремі кристали, їх називають монокристалами. В інших випадках тіла складаються з безлічі кристалів, які зрослися між собою. Кристалічну будову мають всі метали у твердому стані. Тіло, яке складається з безлічі невпорядковано розміщених дрібних кристалів називають полікристалічним, або полікристалом. Полікристалічні тіла є ізотропними, тобто їх фізичні властивості, як і аморфних тіл, у всіх напрямках однакові. Це пояснюється тим, що полікристали складають з величезної кількості невпорядковано орієнтованих дрібних кристаликів, які зрослися між собою.Широке застосування в сучасній фізиці і техніці дістали монокристали. Майже всі напівпровідникові прилади – це монокристали зі спеціально введеними домішками, які надають їм тих чи інших властивостей.Внутрішня будова кристалів. Залежність фізичних властивостей кристалів від напряму і правильність їхніх геометричних форм давали підстави для припущення про впорядкованість частинок, які утворюють кристал. Частинки, з яких складається кристал, при тепловому русі коливаються навколо положень рівноваги, які називають вузлами.Інші кристали мають складнішу будову. В їхніх вузлах містяться атоми вуглецю. Вузол – це положення рівноваги частинки, яка входить до складу кристала, тобто точка. Відстань між вузлами умовно позначає відстань між центрами атомів і молекул.Розрізняють чотири типи кристалів (і кристалічних решіток): іонні, атомні, металічні і молекулярні.Іонні кристали. У вузлах решітки іонних кристалів знаходяться позитивно і негативно заряджені іони. Сили взаємодії між ними в основному електростатичні.Атомні кристали. Їхні кристалічні решітки утворюються внаслідок щільної упаковки атомів, найчастіше однакових (під час взаємодії однакових атомів іони не утворюються. Атоми, що знаходяться у вузлах, зв’язані із своїми найближчими сусідами ковалентним зв’язком.За умови ковалентного зв’язку електрони не переходять від одного атома до іншого (іони не утворюються), а виникає одна чи кілька спільних електронних пар.Молекулярні кристали. У вузлах їх кристалічної решітки знаходяться молекули речовини, зв’язок між якими забезпечується силами молекулярної взаємодії. Металічні кристали. У всіх вузлах гратки металічних кристалів розміщені позитивні іони металу. Між ними хаотично, подібно до молекул газу, рухаються електрони, які відокремилися від атомів під час кристалізації металу. Разом з тим і електрони утримуються іонами в її межах. Наявність вільних електронів у металі забезпечує добру електропровідність і теплопровідність цих речовин.Кожна частинка в кристалі (молекула, атом чи іон) знаходиться в певному положенні рівноваги, в якому сили відштовхування і притягання з боку інших частинок, які утворюють кристал, однакові.Спостерігати і безпосередньо вимірювати сили, які діють на окремі молекули, атоми чи іони, не можна.Щодо деформації тіл. При малих деформаціях напруга σ прямо пропорційна відносному видовженню ε. У формулі закону Гука: σ = εЕ.
Властивість
твердих тіл (або матеріалів, з яких вони
виготовлені) відновлювати свою форму
і об’єм після припинення дії сили
називають пружністю.Деформацію, яку
має тіло після припинення дії сили,
називають залишковою. Найбільше
навантаження, яке витримує зразок перед
розриванням, називають навантаженням
межі міцності, а напругу, яка відповідає
цьому максимальному навантаженню, -
межею міцності.На пружність і пластичність
тіл істотно впливає температура.Однією
з найважливіших механічних характеристик
матеріалів є їхня міцність, тому в
основному саме завдяки їй стають
надійними різні споруди і машини. Під
міцністю розуміють здатність матеріалу
опиратися руйнуванню і залишковій
деформації, які виникають внаслідок
зовнішніх впливів.На відміну від
кристалічних аморфні тіла повністю
ізотропні, тобто їх властивості однакові
в усіх напрямах. Аморфні
тіла не мають певної температури
плавлення. Якщо, наприклад, нагрівати
скло, воно стає м’яким і тягучим. Друга
їх характерна властивість – пластичність.
Таким чином, залежно від характеру
впливу (зокрема часу, протягом якого
діє сила) аморфні речовини поводять
себе або як крихкі тверді тіла, або як
дуже в’язкі рідини.Аморфний
стан речовини нестійкий:
через певний час аморфна речовина
переходить у кристалічну.![]()
43. Закон Дюлонга-Пті визначає питому теплоємність твердого тіла за формулою
де c - питома теплоємність, R - універсальна газова стала, M - молярна маса.
Закон Дюлонга-Пті можна переписати для теплоємності твердого тіла у вигляді:
![]() ,де
С - теплоємність, kB - стала
Больцмана,
N
- число атомів у кристалі.
,де
С - теплоємність, kB - стала
Больцмана,
N
- число атомів у кристалі.
Для справедливості закону Дюлонга-Пті необхідно, щоб енергії теплового руху вистачало для збудження всіх можливих типів коливань у твердому тілі. При низьких температурах деякі з коливань не збуджуються. Це явище зумовлене законами квантової статистики (в даному випадку - статистики Бозе-Ейнштейна). Тому при низьких температурах закон Дюлонга-Пті не діє.
44.Однокомпонентні системи. Якщо система складається тільки з одного компонента, тобто являє собою чисту індивідуальну речовину, те можливість одночасного існування всіх трьох фаз - твердої, рідкої і газоподібної, за правилом фаз визначається відсутністю ступенів свободи, тому що в цьому випадку: С=1-3+2=0 і система безваріантна. Така система може існувати тільки при строго визначених значеннях температури і тиску (для води t=0,0075°С и р=4,579 мм рт. ст.). Зміна шкірного з цих розумів приводити до зникнення однієї з фаз і система стає двохфазною.
двофазна система-рідина і насичена пари. У цьому випадку: С=1-2+2=1 і система є одноваріантною. Отже, не порушуючи фазової рівноваги, можна довільно змінювати або температуру або тиск.
У таких системах строго однозначна залежність між температурою і тиском насиченої парі. при зміні температури парі буде о змінюватися тиск і, навпаки. крива тиску водяної парі (мал.1).
При будь-якому рівноважному переході речовини з однієї фази в іншу дотримується залежність, що виражається рівнянням Клаузіуса — Клапейрона
![]() де r —
теплота фазового переходe
(випаровування, плавлення, сублімації
і ін.) у ккал/кг·мол;
де r —
теплота фазового переходe
(випаровування, плавлення, сублімації
і ін.) у ккал/кг·мол;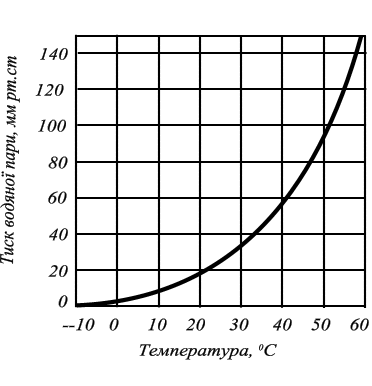
— тепловий
еквівалент роботи в ккал/кгс; ![]()
Т — абсолютна температура фазового переходу в °К;
Р —
тиск у кгс/м2;
![]() —
зміна мольного об’єму речовини при
фазовому переході в м3/кг·мол.
Рис.1.
Крива тиску насиченої водяної
пари.
Стосовно
до двохфазної системи рідина — пара
перепишемо це рівняння так:
—
зміна мольного об’єму речовини при
фазовому переході в м3/кг·мол.
Рис.1.
Крива тиску насиченої водяної
пари.
Стосовно
до двохфазної системи рідина — пара
перепишемо це рівняння так:
![]() де r –
теплота випаровування при даній
температурі в ккал1кг·мол;
де r –
теплота випаровування при даній
температурі в ккал1кг·мол;
Vп — молярний об’єм пари в м3/кг·мол;
Vж — молярний об’єм рідини в ма/кг-мол
. В області невисоких тисків пари молярний об’єм рідини дуже малий у порівнянні з молярним об’ємом пари, тому
без
великої похибки можна величиною
Vж знехтувати,
приймаючи Vж=0.
Тоді
![]() де
R=1,99 ккал/кг·мол·°К.
де
R=1,99 ккал/кг·мол·°К.
При цих умовах рівняння приймає наступний вид:
або
або
При
невеликих інтервалах температур
величина r має
приблизно постійне значення. Тоді
інтегрування рівняння дає
![]() де C –
стала інтегрування.
де C –
стала інтегрування. ![]()
![]()
![]()
По
цьому рівнянню зручно вести практичні
розрахунки, тому що воно є рівнянням
прямої залежності логарифма тиску від
зворотньої величини абсолютної
температури. Якщо для якої-небудь однієї
температури Т відомий тиск Р, то, знаючи
величину r, можна
з знайти числове значення константи C,
після чого побудувати пряму в координатах
lgP, ![]() і
по ній знаходити значення Р для будь-яких
інших температур.
Якщо
величина r також
невідома, те для побудови діаграми
необхідно знати тиски при двох
температурах, скласти два рівняння і,
вирішуючи їх, визначити значення r і С.
і
по ній знаходити значення Р для будь-яких
інших температур.
Якщо
величина r також
невідома, те для побудови діаграми
необхідно знати тиски при двох
температурах, скласти два рівняння і,
вирішуючи їх, визначити значення r і С.
Рівняння можна інтегрувати в межах від T1 до Т2 і відповідно від Р1 до Р2, тоді одержимо нове рівняння для визначення тиску насичених парів в залежності від температури:
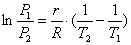 .
.
Потрі́йна то́чка — точка на фазовій діаграмі, при якій можуть співіснувати у рівновазі тверда, рідка й газова фаза однієї речовини.
Для води потрійна точка реалізується при температурі 0.01 oC і тиску 611.73 Па .
За правилом фаз для однокомпонентної термодинамічної системи потрійна точка єдина.
45. Клапейрона — Клаузіуса рівняння, термодинамічне рівняння, що відноситься до процесів переходу речовини з однієї фази в іншу (випар, плавлення, сублімація, поліморфне перетворення і ін.). Згідно До. — До. в., теплота фазового переходу(наприклад, теплота випару, теплота плавлення) при рівноважно протікаючому процесі визначається вираженням
КЛАПЕЙРОНА-КЛАУЗІУСА РІВНЯННЯ
-
диференціальне рівняння, яке встановлює зв'язок між тиском р і абс. температурою Т чистої речовини у станах, що відповідають фазовим переходам 1-го роду (випаровуванню, сублімації, плавленню тощо). Має вигляд;
![]()
де r — питома теплота фазового переходу, ∆V — різниця питомих об'ємів фаз. Рівняння вивів Б. П. Е. Клапейрон (1834) і обгрунтував Р. Клаузіус (1850).
