
- •49 Петля Гистерезиса.
- •48. Электрическое поле в диэлектриках
- •47 Диполь в электрическом поле
- •46. Поле диполя
- •36. Распределение Больцмана
- •34. Распределение молекул по скоростям Максвелла.
- •Основное уравнение мкт
- •[Править]Вывод основного уравнения мкт
- •[Править]Уравнение среднеквадратичной скорости молекулы
- •27. Вынужденные колебания. Резонанс.
- •[Править]Осевой момент инерции
- •[Править]Теорема Гюйгенса-Штейнера
- •[Править]Осевые моменты инерции некоторых тел
- •16. Динамика вращательного движения
- •15. Вращение вокруг неподвижной оси
- •Определение
- •Основные понятия
- •[Править]Синхронизация времени
- •[Править]Линейность преобразований
- •[Править]Согласование единиц измерения
- •[Править]Изотропность пространства
- •[Править]Принцип относительности
- •[Править]Постулат постоянства скорости света
- •[Править]Непротиворечивость теории относительности
- •Третий закон Ньютона
- •[Править]Современная формулировка
- •4. Криволинейное движение
- •1 Кинематика поступательного движения
- •2. Кинематика вращательного движения.
46. Поле диполя
Электрическое поле диполя можно найти в любой интересующей нас точке, опираясь на принцип суперпозиции («Физика 9», § 42). Сделаем это, например, для точки А (рис. 2).
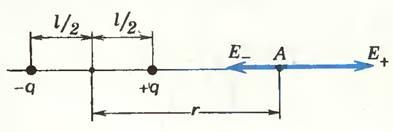
Рис. 2
Напряженность поля в этой точке равна векторной сумме напряженностей, создаваемых точечными зарядами +q и —q:
![]() ,
,
или
.
где r — расстояние от середины диполя до точки А.
На больших расстояниях, когда r >> l получаем
![]() ,
,
где р = ql называется
электрическим моментом диполя. Говоря
точнее, ql —
это модуль дипольного электрического
момента ![]() ,
а направлен этот вектор от отрицательного
заряда к положительному. Электрический
момент — основная характеристика
диполя. В данном случае он определяет
электрическое поле диполя на больших
расстояниях от него.
,
а направлен этот вектор от отрицательного
заряда к положительному. Электрический
момент — основная характеристика
диполя. В данном случае он определяет
электрическое поле диполя на больших
расстояниях от него.
Как
видно из последнего выражения, вдали
от диполя напряженность поля убывает
с расстоянием как ![]() ,
то есть быстрее, чем поле точечного
заряда (пропорциональное
,
то есть быстрее, чем поле точечного
заряда (пропорциональное ![]() ).
Это справедливо не только для точек,
которые лежат на линии, проходящей через
заряды +q и
—q,
но и для
).
Это справедливо не только для точек,
которые лежат на линии, проходящей через
заряды +q и
—q,
но и для
45
44. Теорема Гаусса (закон Гаусса) — один из основных законов электродинамики, входит в системууравнений Максвелла. Выражает связь (а именно равенство с точностью до постоянного коэффициента) между потоком напряжённости электрического поля сквозь замкнутую поверхность и зарядом в объёме, ограниченном этой поверхностью.
Применяется отдельно для вычисления электростатических полей.
Аналогичная теорема, также входящая в число уравнений Максвелла, существует и для магнитного поля (см. ниже).
Также теорема Гаусса верна для любых полей, для которых верен закон Кулона или его аналог (например, для ньютоновской гравитации). При этом она является, как принято считать, более фундаментальной, так как позволяет в частности вывести степень расстояния[1] в законе Кулона «из первых принципов», а не постулировать ее (или не находить эмпирически).
В этом можно видеть фундаментальное значение теоремы Гаусса (закона Гаусса) в теоретической физике.
Существуют аналоги (обобщения) теоремы Гаусса и для более сложных полевых теорий, чем электродинамика.
43.
Напряжённость электри́ческого
по́ля — векторная физическая
величина, характеризующая электрическое
поле в
данной точке и численно равная
отношению силы ![]() действующей
на пробный
заряд,
помещенный в данную точку поля, к величине
этого заряда q:
действующей
на пробный
заряд,
помещенный в данную точку поля, к величине
этого заряда q:
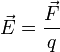 .
.
Также иногда называется силовой характеристикой электрического поля.
Математически
зависимость вектора ![]() от
координат пространства само задаёт векторное
поле.
от
координат пространства само задаёт векторное
поле.
Модуль напряжённости электрического поля в СИ измеряется в В/м (Вольт на метр).
Электростатический потенциа́л (см. также кулоновский потенциал) — скалярная энергетическая характеристика электростатического поля, характеризующая потенциальную энергию поля, которой обладает единичный заряд, помещённый в данную точку поля. Единицей измерения потенциала является, таким образом, единица измерения работы, деленная на единицу измерения заряда (для любой системы единиц; подробнее о единицах измерения — см. ниже).
Электростатический потенциал — специальный термин для возможной замены общего термина электродинамики скалярный потенциал в частном случае электростатики (исторически электростатический потенциал появился первым, а скалярный потенциал электродинамики — его обобщение). Употребление термина электростатический потенциал определяет собой наличие именно электростатического контекста. Если такой контекст уже очевиден, часто говорят просто о потенциале без уточняющих прилагательных.
Электростатический потенциал равен отношению потенциальной энергии взаимодействия заряда с полем к величине этого заряда:
![]()
Напряжённость
электростатического поля ![]() и
потенциал
и
потенциал ![]() связаны
соотношением[1]
связаны
соотношением[1]
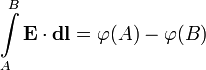
или обратно[2]:
![]()
Здесь ![]() — оператор
набла,
то есть в правой части равенства стоит
минус градиент потенциала —
вектор с компонентами, равными частным
производным от
потенциала по соответствующим
(прямоугольным) декартовым координатам,
взятый с противоположным знаком.
— оператор
набла,
то есть в правой части равенства стоит
минус градиент потенциала —
вектор с компонентами, равными частным
производным от
потенциала по соответствующим
(прямоугольным) декартовым координатам,
взятый с противоположным знаком.
Воспользовавшись
этим соотношением и теоремой
Гаусса для
напряжённости поля ![]() ,
легко увидеть, что электростатический
потенциал удовлетворяет уравнению
Пуассона.
В единицах системы СИ:
,
легко увидеть, что электростатический
потенциал удовлетворяет уравнению
Пуассона.
В единицах системы СИ:
![]()
где ![]() —
электростатический потенциал
(в вольтах),
—
электростатический потенциал
(в вольтах), ![]() —
объёмная плотность
заряда (в кулонах на
кубический метр), а
—
объёмная плотность
заряда (в кулонах на
кубический метр), а ![]() — диэлектрическая
проницаемость вакуума
(в фарадах на
метр).
— диэлектрическая
проницаемость вакуума
(в фарадах на
метр).
42.
Закон
взаимодействия неподвижных точечных
электрических зарядов открыт в 1785 г.
французским физиком Ш. Кулоном. Точечнымназывается
заряд, сосредоточенный на теле, у которого
линейные размеры пренебрежимо малы по
сравнению с расстоянием до других
заряженных тел, с которыми он
взаимодействует. Понятие точечного
заряда, как и материальной точки, есть
физическая абстракция.
Закон
Кулона:
сила взаимодействия F между двумя
неподвижными точечными зарядами,
находящимися в вакууме, пропорциональна
зарядам Q1 и
Q2 и
обратно пропорциональна квадрату
расстояния r между ними:
![]() где
k — коэффициент пропорциональности,
который зависит от выбора системы
единиц.
Сила F направлена
по прямой, которая соединяет
взаимодействующие заряды, т. е. является
центральной, и соответствует притяжению
(F<0) в случае зарядов разных знаков и
отталкиванию (F>0) в случае зарядов
одного знака. Эта сила называется кулоновской
силой.
В векторной форме закон Кулона представлен
в виде
где
k — коэффициент пропорциональности,
который зависит от выбора системы
единиц.
Сила F направлена
по прямой, которая соединяет
взаимодействующие заряды, т. е. является
центральной, и соответствует притяжению
(F<0) в случае зарядов разных знаков и
отталкиванию (F>0) в случае зарядов
одного знака. Эта сила называется кулоновской
силой.
В векторной форме закон Кулона представлен
в виде
![]() (1)
где F12 —
сила, которая действуюет на заряд Q1 со
стороны заряда Q2, r12 —
радиус-вектор, который соединяет заряд
Q2 с
зарядом Q1,
r = |r12|
(рис. 1). На заряд Q2 со
стороны заряда Q1 действует
сила F21 =
–F12.
В
СИ коэффициент пропорциональности
равен
(1)
где F12 —
сила, которая действуюет на заряд Q1 со
стороны заряда Q2, r12 —
радиус-вектор, который соединяет заряд
Q2 с
зарядом Q1,
r = |r12|
(рис. 1). На заряд Q2 со
стороны заряда Q1 действует
сила F21 =
–F12.
В
СИ коэффициент пропорциональности
равен
![]() Тогда
закон Кулона будет в окончательном
виде:
Тогда
закон Кулона будет в окончательном
виде:
![]() (2)
Величина
ε0 называется электрической
постоянной;
она относится к числу фундаментальных
физических постоянных и равна ε0 =
8,85•10-12 Кл2/(Н•м2)
где фарад (Ф)
— единица электрической емкости (см.
раздел "конденсаторы"). Тогда
(2)
Величина
ε0 называется электрической
постоянной;
она относится к числу фундаментальных
физических постоянных и равна ε0 =
8,85•10-12 Кл2/(Н•м2)
где фарад (Ф)
— единица электрической емкости (см.
раздел "конденсаторы"). Тогда
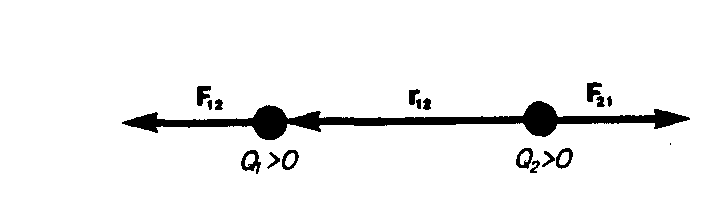
Рис.1
41. Тройна́я то́чка — точка на фазовой диаграмме, где сходятся три линии фазовых переходов. Тройная точка — это одна из характеристик химического вещества. Обычно тройная точка определяется значением температуры и давления, при котором вещество может равновесно находиться в трёх (отсюда и название) агрегатных состояниях — твёрдом, жидком и газообразном. В этой точке сходятся линии плавления, кипения и сублимации.
В более общем случае могут рассматриваться и другие фазы вещества, не соответствующие различным агрегатным состояниям. На достаточно богатых фазовых диаграммах может быть несколько тройных точек. Вещество в тройной точке в состоянии термодинамического равновесия может частично находиться во всех трёх фазах. На многомерных фазовых диаграммах (то есть если крометемпературы и давления присутствуют иные интенсивные величины) могут существовать четверные и т. д. точки.
40.?
39 ЭНТРОПИЯ - (от греч. entropia - поворот - превращение) (обычно обозначаетсяS), функция состояния термодинамической системы, изменение которой dS в равновесном процессе равно отношению количества теплоты dQ, сообщенного системе или отведенного от нее, к термодинамической температуре Т системы. Неравновесные процессы в изолированной системе сопровождаются ростом энтропии, они приближают систему к состоянию равновесия, в котором S максимальна. Понятие "энтропия" введено в 1865 Р. Клаузиусом.Статистическая физика рассматривает энтропию как меру вероятности пребывания системы в данном состоянии (Больцмана принцип). Понятием энтропии широко пользуются в физике, химии, биологии и теории информации. -------------------------------------------------------------------------------- Энтропия - Мера неопределенности случайного события или опыта, которая определяется следующим образом: Пусть имеется некоторый опыт x с k, не зависимыми друг от друга исходами: A1, A2, ..Ak. Каждый исход имеет соответствующую вероятность - p(A1), p(A2), ..p(Ak). Тогда энтропия опыта x обозначается как H(x): H(x) = - p(A1)Tlog p(A1) - p(A2)Tlog p(A2) -..- p(Ak)Tlog p(Ak). На основе энтропии можно определить и точно измерить информацию (математическое определение, не совпадающее с общепринятым понятием). Пусть возможен опыт x и его энтропия равна H(x), и есть возможность произвести вспомогательный опыт у до опыта x, который уменьшит количество исходов (степень неопределенности) опыта x; и условная энтропия Hy(x) - энтропия опыта x при условии выполнения y, тогда H(x) - Hy(x) = I(y,x), где I(y,x) - количество информации, содержащееся в опыте y относительно опыта x, или информация, содержащаяся в y об x. Ядро операционной системы -------------------------------------------------------------------------------- ЭНТРОПИЯ - (от греч. entropia — поворот, превращение) — часть внутренней энергии замкнутой системы или энергетической совокупности Вселенной, которая не может быть использована, в частности не может перейти или быть преобразована в механическую работу. Точное определение энтропии производится с помощью математических расчетов. Наиболее отчетливо эффект энтропии виден на примере термодинамических процессов. Так, тепло никогда совершенно не переходит в механическую работу, преобразуясь в др. виды энергии. Примечательно, что при обратимых процессах величина энтропии остается неизменной, при необратимых, наоборот, неуклонно возрастает, причем этот прирост происходит за счет уменьшения механической энергии. Следовательно, все то множество необратимых процессов, которые происходят в природе, сопровождается уменьшением механической энергии, что в конечном итоге должно привести к всеобщему параличу, или, говоря иначе, «тепловой смерти». Но такой вывод правомочен лишь в случае постулирования тоталитарности Вселенной как замкнутой эмпирической данности. Христ. теологи, основываясь на энтропии, говорили о конечности мира, используя ее как доказательство существования Бога.
38. Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами.
Второе начало термодинамики гласит, что невозможен самопроизвольный переход тепла от тела, менее нагретого, к телу, более нагретому.
Второе начало термодинамики запрещает так называемые вечные двигатели второго рода, показывая чтокоэффициент полезного действия не может равняться единице, поскольку для кругового процесса температура холодильника не должна равняться 0.
Второе начало термодинамики является постулатом, не доказываемым в рамках термодинамики. Оно было создано на основе обобщения опытных фактов и получило многочисленные экспериментальные подтверждения.
Существуют несколько эквивалентных формулировок второго начала термодинамики:
-
Постулат Клаузиуса: «Невозможен процесс, единственным результатом которого являлась бы передача тепла от более холодного тела к более горячему»[1] (такой процесс называется процессом Клаузиуса).
-
Постулат Томсона (Кельвина): «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара» (такой процесс называетсяпроцессом Томсона).
Эквивалентность этих формулировок легко показать. В самом деле, допустим, что постулат Клаузиуса неверен, то есть существует процесс, единственным результатом которого была бы передача тепла от более холодного тела к более горячему. Тогда возьмем два тела с различной температурой (нагреватель и холодильник) и проведем несколько циклов тепловой машины, забрав тепло Q1 у нагревателя, отдав Q2холодильнику и совершив при этом работу A = Q1 − Q2. После этого воспользуемся процессом Клаузиуса и вернем тепло Q2 от холодильника нагревателю. В результате получается, что мы совершили работу только за счет отъёма теплоты от нагревателя, то есть постулат Томсона тоже неверен.
С другой стороны, предположим, что неверен постулат Томсона. Тогда можно отнять часть тепла у более холодного тела и превратить в механическую работу. Эту работу можно превратить в тепло, например, с помощью трения, нагрев более горячее тело. Значит, из неверности постулата Томсона следует неверность постулата Клаузиуса.
Таким образом, постулаты Клаузиуса и Томсона эквивалентны.
Другая формулировка второго начала термодинамики основывается на понятии энтропии:
-
«Энтропия изолированной системы не может уменьшаться» (закон неубывания энтропии).
Такая формулировка основывается на представлении об энтропии как о функции состояния системы, что также должно быть постулировано.
Второе начало термодинамики в аксиоматической формулировке Рудольфа Юлиуса Клаузиуса (R. J. Clausius, 1865) имеет следующий вид[2]:
Для любой квазиравновесной термодинамической системы существует однозначная функция термодинамического состояния S= S(T,x,N), называемая энтропией, такая, что ее полный дифференциал dS = δQ / T.
В состоянии с максимальной энтропией макроскопические необратимые процессы (а процесс передачи тепла всегда является необратимым из-за постулата Клаузиуса) невозможны.
[править]Ограничения
С точки зрения статистической физики второе начало термодинамики имеет статистический характер: оно справедливо для наиболее вероятного поведения системы. Существование флуктуаций препятствует точному его выполнению, однако вероятность сколь-нибудь значительного нарушения крайне мала. Смотри также Демон Максвелла.
[править]Второе начало термодинамики и «тепловая смерть Вселенной»
Клаузиус, рассматривая второе начало термодинамики, пришёл к выводу, что энтропия Вселенной как замкнутой системы стремится к максимуму, и в конце концов во Вселенной закончатся все макроскопические процессы. Это состояние Вселенной получило название «тепловой смерти». С другой стороны, Больцман высказал мнение, что нынешнее состояние Вселенной — это гигантская флуктуация, из чего следует, что большую часть времени Вселенная все равно пребывает в состоянии термодинамического равновесия («тепловой смерти»)[3].
По мнению Ландау, ключ к разрешению этого противоречия лежит в области общей теории относительности: поскольку Вселенная является системой, находящейся в переменном гравитационном поле, закон возрастания энтропии к ней неприменим[4].
Поскольку второе начало термодинамики (в формулировке Клаузиуса) основано на предположении о том, что вселенная является замкнутой системой, возможны и другие виды критики этого закона. В соответствии с современными физическими представлениями мы можем говорить лишь о наблюдаемой части вселенной. На данном этапе человечество не имеет возможности доказать, ни то, что вселенная есть закрытая система, ни обратное.
[править]Энтропия и критика эволюционизма
Второе начало термодинамики (в формулировке неубывания энтропии) иногда используется критиками эволюционной теории с целью показать, что развитие природы в сторону усложнения невозможно.[5][6]. Однако подобное применение физического закона является некорректным, так как энтропия не убывает только в замкнутых системах (сравн. с диссипативной системой), в то время как живые организмы и планета Земля в целом являются открытыми системами.
37. Первое начало термодинамики — один из трёх основных законов термодинамики, представляет собойзакон сохранения энергии для термодинамических систем.
Первое начало термодинамики было сформулировано в середине XIX века в результате работ немецкого учёного Ю. Р. Майера, английского физика Дж. П. Джоуля и немецкого физика Г. Гельмгольца[1]. Согласно первому началу термодинамики, термодинамическая система может совершать работу только за счёт своейвнутренней энергии или каких-либо внешних источников энергии. Первое начало термодинамики часто формулируют как невозможность существования вечного двигателя первого рода, который совершал бы работу, не черпая энергию из какого-либо источника.
Существует несколько эквивалентных формулировок первого начала термодинамики
В любой изолированной системе запас энергии остаётся постоянным.[2] Это — формулировка Дж. П. Джоуля (1842 г.).
Количество теплоты, полученное системой, идёт на изменение её внутренней энергии и совершение работы против внешних сил
Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе, то есть, оно зависит только от начального и конечного состояния системы и не зависит от способа, которым осуществляется этот переход. Это определение особенно важно для химической термодинамики[2] (ввиду сложности рассматриваемых процессов). Иными словами, внутренняя энергия является функцией состояния. В циклическом процессе внутренняя энергия не изменяется.
![]()
Изменение полной энергии системы в квазистатическом процессе равно количеству теплоты Q, сообщённому системе, в сумме с изменением энергии, связанной с количеством вещества N при химическом потенциале μ, и работы A'[3], совершённой над системой внешними силами и полями, за вычетом работы A, совершённой самой системой против внешних сил
ΔU = Q − A + μΔN + A'.
Для элементарного количества теплоты δQ, элементарной работы δA и малого приращения dU внутренней энергии первый закон термодинамики имеет вид:
dU = δQ − δA + μdN + δA'.
Разделение работы на две части, одна из которых описывает работу, совершённую над системой, а вторая — работу, совершённую самой системой, подчёркивает, что эти работы могут быть совершены силами разной природы вследствие разных источников сил.
Важно заметить, что dU и dN являются полными дифференциалами, а δA и δQ — нет.
[править]Частные случаи
Рассмотрим несколько частных случаев:
-
Если δQ > 0, то это означает, что тепло к системе подводится.
-
Если δQ < 0, аналогично — тепло отводится.
-
Если δQ = 0, то система не обменивается теплом с окружающей средой и называется адиабатически изолированной.
Обобщая:
в конечном процессе ![]() элементарные
количества теплоты могут быть любого
знака. Общее количество теплоты, которое
мы назвали просто Q —
это алгебраическая сумма количеств
теплоты, сообщаемых на всех участках
этого процесса. В ходе процесса теплота
может поступать в систему или уходить
из неё разными способами.
элементарные
количества теплоты могут быть любого
знака. Общее количество теплоты, которое
мы назвали просто Q —
это алгебраическая сумма количеств
теплоты, сообщаемых на всех участках
этого процесса. В ходе процесса теплота
может поступать в систему или уходить
из неё разными способами.
При отсутствии работы над системой и потоков энергии-вещества, когда δA' = 0, δQ = 0, dN = 0, выполнение системой работы δA приводит к тому, что ΔU < 0, и энергия системы U убывает. Поскольку запас внутренней энергии U ограничен, то процесс, в котором система бесконечно долгое время выполняет работу без подвода энергии извне, невозможен, что запрещает существование вечных двигателей первого рода.
Первое начало термодинамики:
-
при изобарном процессе
![]()
-
при изохорном процессе (A = 0)
![]()
-
при изотермическом процессе (ΔU = 0)
![]()
Здесь ![]() — масса газа,
— масса газа, ![]() — молярная
масса газа,
— молярная
масса газа, ![]() — молярная
теплоёмкость при
постоянном объёме,
— молярная
теплоёмкость при
постоянном объёме, ![]() — давление, объём итемпература газа
соответственно, причём последнее
равенство верно только для идеального
газа.
— давление, объём итемпература газа
соответственно, причём последнее
равенство верно только для идеального
газа.
