
Образование поверхностных фаз
Экспериментами Б. В. Дерягина и его последователей [18 – 20, 47] доказано изменение физико-механических свойств жидких поверхностных слоев в зависимости от расстояния их от поверхности твердых тел. Допускается образование в жидких поверхностных слоях при некоторых условиях квазикристаллической структуры [19, 24]. Для водных тонких пленок (связанная вода), возникших на твердых поверхностях, отмечены аномальные вязкость, плотность, теплопроводность, электропроводность, диэлектрическая проницаемость и др.
Связанная вода образуется у поверхности твердых минеральных гидрофильных частиц за счет ориентировки и притяжения молекул воды силами Ван-дер-Ваальса, электрического поля созданного избыточным зарядом твердой поверхности минерала зарядов адсорбированных и диффузионных ионов, расположенных во внешней части двойного электрического слоя, а также счет водородных связей [3, 5, 22, 58].
Молекулярные силы при малых расстояниях между атомами или молекулами проявляются в виде сил отталкивания, а при больших расстояниях — в виде сил притяжения, монотонно убывающих с увеличением расстояния между взаимодействующими частицами. Энергия взаимодействия двух частиц с учетом теорий Ван-дер-Ваальса, Лондона и Дебая может быть записана в виде
![]()
здесь Uпр — энергия ван-дер-ваальсового притяжения между молекулами
![]()
где Uор – энергия ориентационного взаимодействия
![]()
U![]() д
— энергия лондоновского дисперсионного
взаимодействи
д
— энергия лондоновского дисперсионного
взаимодействи
Uинд — энергия индукционного взаимодействия
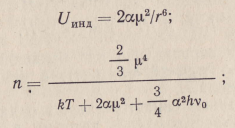
Uот = m/r12—энергия отталкивания молекул; r — расстояние между молекулами; μ, — постоянный дипольный момент; α, υо поляризуемость и частота колебания молекул соответственны; h – постоянная Планка; kT— энергия теплового движения; m – константа отталкивания.
Уравнение (3) отражает конкуренцию сил отталкивания и притяжения в зависимости от расстояния между частицами. По данным А. А. Ананяна [2], энергия ориентационного взаимодействия для молекул воды составляет около 77%.
![]()
Лондоновская теория притяжения частиц имеет ограничения и несправедлива как для весьма малых расстояний между атомами, когда перекрываются их собственные волновые функции, так и для расстояний, значительно превышающих длину волн поглощения и испускания данного атома, при которых необходимо учитывать эффект электромагнитного запаздывания [24].
Дальнейшее развитие теория взаимодействия между частицами получила в трудах Е. М. Лифшица, X. Б. Казимира, Д. Польдера, Б. В. Дерягина, И. Ф. Ефремова, Г. И. Дистлера и др. Особенно выдающиеся теоретические исследования в этом направлении выполнены Е. М. Лифшицем [40—42]. Им разработана строгая теория молекулярного взаимодействия макроскопических тел, базирующаяся на флуктуационной электродинамике. Для энергии молекулярного взаимодействия двух тел, разделенных зазором H, получена формула
![]()
здесь А — постоянная молекулярных сил притяжения; n = 2 при λ<H; п = 3 при λ>H, где H — основная длина волны в спектре поглощения данного тела.
Т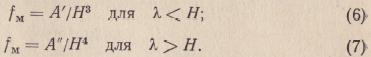 аким
образом, молекулярные силы взаимодействия
между телами
согласно теории Лифшица обратно
пропорциональны третьей
и четвертой степеням расстояния, т. е.
аким
образом, молекулярные силы взаимодействия
между телами
согласно теории Лифшица обратно
пропорциональны третьей
и четвертой степеням расстояния, т. е.
Выражение (6) справедливо для большой толщины зазора между телами (0,5 мкм<H<5 мкм), а уравнение (7)—для малой толщины зазора H.
Изложенные данные свидетельствуют о дальнодействии молекулярных поверхностных сил, которые оказывают влияние на образование поверхностных фаз, обладающих аномальными физико-химическими свойствами. Так как аномальные поверхностные слои обнаружены в полярных жидкостях, например в воде, высказаны предположения о существенном объемном влиянии на их формирование активных центров твердой поверхности, которое распространяется в глубь жидкости по эстафетному механизму за счет образования водородных связей |19, 20]. Водородная связь заключается в том, что свободная электронная пара одной молекулы воды способна притягивать
водород, удерживаемый парой электронов другой молекулы, в результате обе молекулы воды оказываются связанными. Н.Д. Соколов объясняет возникновение водородной связи между молекулами не с точки зрения электростатического взаимодействия, а для донорно-акцепторной модели. Энергия одной водородной связи для различных соединений колеблется от 2 до 9 ккал, в то время как энергия ван-дер-ваальсового взаимодействия составляет обычно несколько десятых килокалорий [60].
Исследованиями Б. В. Дерягина и С. С. Духина [18, 23] показано, что ионио-электростатическое поле частиц возникает не только за счет избыточных поверхностных дискретных зарядов и не нарушенного двойного электрического слоя, но и благодаря деформации его под влиянием внешнего поля или конвективного движения жидкости; при этом возникает электрическое поле, радиус действия которого на несколько порядков выше, чем при термодинамическом равновесии системы. При разноименных потенциалах твердой поверхности или одноименных, но различных по величине возникают электроповерхностные силы притяжения между молекулами и частицами. Благодаря суммарному действию всех сил электрической природы толщина аномальных слоев в дисперсных системах может достигать сотен и даже тысяч ангстрем.
Н![]() айдем
величину электрической силы, возникающей
за счет ионно-электростатического
поля и действующей на ион заряда ezi
вблизи заряженной
минеральной частицы [32]:
айдем
величину электрической силы, возникающей
за счет ионно-электростатического
поля и действующей на ион заряда ezi
вблизи заряженной
минеральной частицы [32]:
(8)
где Eи= grad U — напряженность ионно-электростатического поля; U – электрический потенциал; е = F/N — единичный заряд иона (F – число Фарадея; N — число Авогадро); zi — валентность иона; α — угол между вектором напряженности внешнего поля и нормалью к твердой минеральной поверхности.
Чтобы определить напряженность поля Еи, необходимо найти электрический потенциал; U(х) вблизи плоской граничной поверхности. Поскольку радиус минеральной частицы весьма велик по сравнению с размером иона и толщиной пленки связанного раствора электролита, поверхность раздела минерал - электролит может быть принята плоской. Функция U(х) должна удовлетворять уравнению Пуассона для объемного распрделения зарядов в среде
![]()
где δ – плотность заряда ионов; ε0 — электрическая постоянная, равная 8,85-10-12 Ф/м;ε — относительная диэлектрическая проницаемость.
В соответствии с законом распределения Больцмана для симметричного электролита
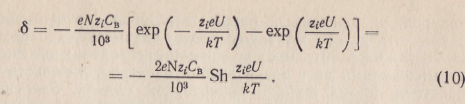
Полагая
отношение электрической энергии к
кинетической
![]() ,
можно приближенно записать
,
можно приближенно записать
![]()
Сделанное приближение справедливо только для разбавленных растворов. В концентрированных растворах энергия электростатического взаимодействия ионов на самом деле не мала по сравнению с тепловой энергией движения частиц кТ. Используя указанное выше допущение и для концентрированных растворов, мы фактически отказываемся от экспоненциального распределения Больцмана и заменяем его линейным.
Таким образом
![]()
здесь Св — концентрация электролита, моль/л; k – постоянная Больцмана.
Зависимость (9) с учетом (12) запишем в виде
![]() -•№, (13)
-•№, (13)
где χ — величина, обратная среднему значению радиуса дебаевской ионной атмосферы:
![]()
Направим ось х по нормали к твердой поверхности; отсчет значений х будем вести от поверхности раздела минеральная частица — раствор в сторону последнего.
Для
плоской поверхности уравнение (13) м![]() ожет
быть представлено
в виде
ожет
быть представлено
в виде
Д![]() ифференциальное
уравнение (14) имеет решение
ифференциальное
уравнение (14) имеет решение
Постоянные
интегрирования С1
и
С2
находим из граничных условий.
При х→∞ потенциал Uх→∞→0.
Первый член выражения
(15) обращается в нуль при С1
= 0. Постоянную С2
находим из
граничного условия x
= hн
(здесь hн
— толщина неподвижного
слоя связанной воды, равная 7,5∙10-10
м). Потенциал при х
= hн
равен
электрокинетическому дзета-потенциалу
Uх=hн
=ζ;
![]()
В окончательном виде зависимость потенциала U от координаты х может быть написана таким образом
![]()
Дифференцируя (16) по х, находим напряженность ионно-мектростатического поля в исследуемой точке слоя жидкости
![]()
![]()
Рис.
2. Характер изменения средней
силы взаимодействия
![]() между
плоской заряженной
поверхностью и ионом
в зависимости от расстояния
х между ними. Шифр
кривых —Св
между
плоской заряженной
поверхностью и ионом
в зависимости от расстояния
х между ними. Шифр
кривых —Св
Подставив (17) в (8), получим выражение для силы ионно-электростатического поля:
![]()
Среднее значение ионно-электростатической силы в 23 слое связанной воды толщиной hв св=х—хо на основании (18) равно
![]()
где ; хо — значение координаты, при которой скорость поступательного движения частицы близка к нулю
![]()
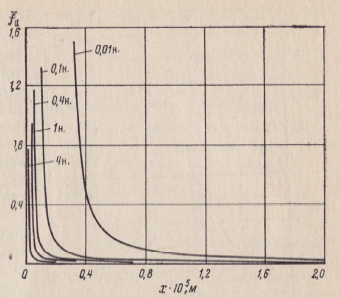
Н![]() а
рис. 2 приведены расчетные
кривые fи
=
φ(х), полученные на основании
формулы (19) с учетом
всех констант. Из
рисунка
следует, что ионно-электростатическая
сила
для слабоминерализованных
растворов при х<0,4∙10-5
см значительно увеличивается,
а при х>0,4∙10-5
см имеет небольшую величину.
Исходя
из (19), можно сказать, что
действие ионно-электростатической
силы на
молекулы воды и ионы электролита в
растворах с концентрацией
0,01 н. проявляется
на расстоянии до (0,5÷0,8)∙10-5
см. Это достаточно
хорошо согласуется
с экспериментальными
данными разных исследователей
[18, 20]. С увеличением
концентрации электролита
действие ионно-электростатической
силы
с расстоянием существенно
а
рис. 2 приведены расчетные
кривые fи
=
φ(х), полученные на основании
формулы (19) с учетом
всех констант. Из
рисунка
следует, что ионно-электростатическая
сила
для слабоминерализованных
растворов при х<0,4∙10-5
см значительно увеличивается,
а при х>0,4∙10-5
см имеет небольшую величину.
Исходя
из (19), можно сказать, что
действие ионно-электростатической
силы на
молекулы воды и ионы электролита в
растворах с концентрацией
0,01 н. проявляется
на расстоянии до (0,5÷0,8)∙10-5
см. Это достаточно
хорошо согласуется
с экспериментальными
данными разных исследователей
[18, 20]. С увеличением
концентрации электролита
действие ионно-электростатической
силы
с расстоянием существенно
уменьшается и для минерализованных растворов (СВ>0,1÷0,4 н) при х>(0,1÷0,2)∙10-3 см величина имеет весьма малые значения, что объясняется экранирующим действием поля поверхности значительным числом катионов во внешней части двойного электрического слоя.
Расчетные значения толщины пленок hво остаточной воды для песчано-алевритовых коллекторов продуктивных пластов (АВ1 АВ2, АВ3-5, БВ8, БВ10) месторождений нефти и газа Западной Сибири, определенные по открытой пористости, остаточной воде и проницаемости с помощью известной формулы [34], колеблются от сотых до десятых долей микрометра (рис. 3). Именно на такие расстояния распространяется действие ионно-электростатической силы при взаимодействии минеральных частиц с растворами электролитов разной концентрации согласно формуле (19). Можно утверждать, что значительная часть пленочной воды находится в связанном состоянии.
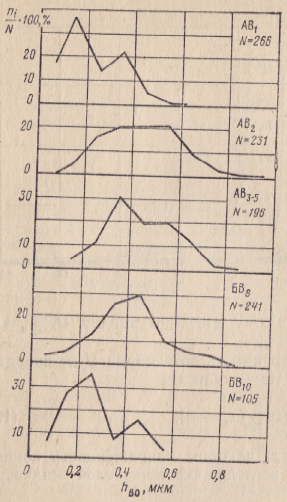
Рис. 3. Распределение значений толщин пленок остаточной воды hво песчано-алевритовых пород (Западная Сибирь, Самотлорское месторождение нефти).
N — общее число определений; пi—число определений в интервале изменения hво
АНОМАЛЬНЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА СВЯЗАННОЙ ВОДЫ
Плотность. Интегральные значения плотности пленки связанной воды, образовавшейся на глинистых минералах, колеблется в пределах 1,2—1,5 г/см3 [3, 22, 25, 29, 58]. Ф. М. Куни и А.И.Русановым [31] с помощью методов статистической механики получена асимптотическая формула, показывающая изменение плотности δв св связанной связанной воды в зависимости от расстояния исследуемой точки среды от твердой поверхности:
![]()
Где х – расстояние исследуемой точки от твердой среды поверхности δ0 и χ0 — плотность и изометрическая сжимаемость однородной жидкости; В и В' — константы ван-дер-ваальсового взаимодействия молекул жидкости друг с другом и с молекулами другой фазы; δ' — плотность другой фазы.
В формуле (20) учтены только силы молекулярного взаимодействия, поэтому из расчетов следует, что разница плотностей поверхностной и объемной фаз становится весьма малой на удалении от твердой фазы лишь до сотен межмолекулярных расстояний.
Н![]() а
основании (20) нами получено выражение
для среднего эффективного
значения плотности пленки связанной
воды толщиной hв
св=х—х0:
а
основании (20) нами получено выражение
для среднего эффективного
значения плотности пленки связанной
воды толщиной hв
св=х—х0:
где
![]()
Вязкость. По данным различных исследователей вязкость связанной воды в несколько раз превышает вязкость свободной воды [26, 34]. К. Терцаги, исследуя фильтрацию жидкостей через различные грунты, песок и глину, установил, что их вязкость в тонких капиллярах (<10-7 м) изменяется обратно пропорционально восьмой'степени их радиуса. Однако Е. Ма-К. Зольф, а позднее О. Н. Григоров и другие, исследуя протекаемость коллодиевых мембран с широким интервалом пор, не отметили такого резкого изменения коэффициента вязкости воды.
Нами на основании изучения объемной скорости удаления капиллярного впитывания и сорбции установлена эмпирическая зависимость вязкости связанной воды ηв св от толщины ее пленки [32|.
![]()
где η0 –вязкость раствора электролита в объемной фазе; hв св –вероятно максимальная толщина пленки связанной воды (координата внешней границы пленки); hв – толщина пленки воды при данном водонасышении kв;
n – показатель степени, характеризующий физико-химические свойства раствора и литологические особенности породы (изменяется от1,5 до 2,5, среднее значение равно 2).
Средняя эффективная вязкость для слоя связанНОЙ ВОДЫ ТОЛЩИНОЙ h’в св=х—х0 выражается фор муллой

Связанная вода наиболее существенно отличается по вязкости от объемной при толщине пленки 0,1∙10-6 м и менее (рис. 4).

Рис. 4. Изменение относительной вязкости связанной воды ηв св/η0 в зависимости от расстояния х, исследуемой точки среды от твердой фазы породы (по Е. И. Леонтьеву [32]; З.М. Товбиной [61]; З. М. Зорину, В. Д. Соболеву, Н. В. Чураеву [26].
