
- •Кинетика гидролиза сахарозы
- •Общие сведения
- •Зависимость скорости реакции от концентрации реагирующих веществ
- •Определение порядка и константы скорости реакции
- •Зависимость скорости реакции от температуры
- •Зависимость скорости реакции от присутствия катализатора
- •Поляриметрический метод
- •Полутеневой поляриметр
- •Реакция гидролиза сахарозы
- •Методика выполнения работы Порядок проведения эксперимента
- •Обработка результатов эксперимента
- •Вопросы к лабораторной работе №1
- •Перегонка
- •Общие сведения
- •Давление пара над бинарными жидкими смесями
- •Температуры кипения бинарных жидких смесей
- •Рефрактометрический метод
- •Рефрактометр Аббе
- •Методика измерения показателей преломления
- •Методика проведения работы Порядок проведения эксперимента
- •Обработка результатов эксперимента
- •Вопросы к лабораторной работе №2
- •Коэффициент распределения
- •Общие сведения
- •Распределение растворённого вещества между двумя несмешивающимися растворителями
- •Экстракция
- •Титриметрический метод
- •Методика проведения работы Порядок проведения эксперимента
- •Обработка результатов эксперимента
- •Вопросы к семинарскому занятию №3
Зависимость скорости реакции от температуры
Изменение температуры приводит к изменению константы скорости реакции (чем выше температура, тем больше константа скорости).
Зависимость константы скорости реакции от температуры описывается уравнением Аррениуса:
![]()
где: EA – энергия активации – минимальный запас энергии, которым должны обладать исходные вещества, чтобы они могли превратиться в продукты реакции;
k0 – константа скорости реакции при EA = 0 (гипотетическое состояние), величину k0 называют также предэкспоненциальным фактором;
e – основание натурального логарифма;
R
= 8,31
![]() – универсальная газовая постоянная;
– универсальная газовая постоянная;
T – абсолютная температура, выраженная в Кельвинах.
Значения EA и k0 могут быть определены из экспериментальных данных зависимости скорости реакции от температуры.
Если известны константы скорости реакции при двух температурах, поступают следующим образом:
– записывают уравнение Аррениуса для одной и другой температуры:

– делят первое уравнение на второе:

– логарифмируют уравнение и переходят к десятичным логарифмам:
![]()
– выражают энергию активации (единицы измерения EA – Дж/моль):
 (1)
(1)
– находят величину k0, подставляя найденное значение EA и k(T1) в уравнение Аррениуса (единицы измерения k0 такие же как единицы измерения k ):
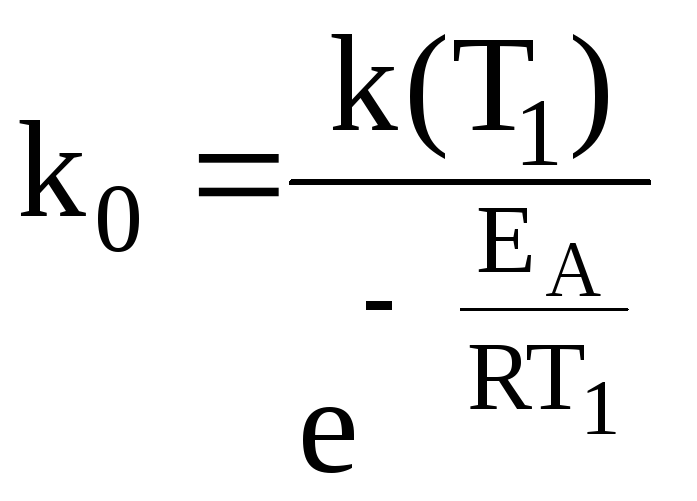 (2)
(2)
Зависимость скорости реакции от присутствия катализатора
Катализаторами называются вещества, изменяющие скорость реакции, но по окончании реакции, остающиеся в неизменном виде.
Если реакция проходит по схеме:
A + B → C + D
то её кинетическое уравнение будет иметь вид: V = k∙c(A)∙c(B).
Схема той же реакции в присутствии катализатора может быть представлена таким образом:
A + B + K → ABK → C + D + K
где: K – катализатор.
Исходные вещества взаимодействуют с катализатором с образованием промежуточного неустойчивого соединения ABK, которое распадается с образованием продуктов реакции и катализатора в неизменном виде.
Механизм действия катализаторов основан на изменении энергии активации реакции и соответственно изменении константы её скорости.
Если введение катализатора приводит к увеличению константы скорости, то такой катализ называется положительным, а если к снижению – отрицательным. Катализаторы, понижающие скорость реакции называются ингибиторами.
Каталитические реакции играют исключительно важную роль в процессе жизнедеятельности растительных и животных организмов.
Ферментами (энзимами) называются специфические белковые катализаторы природного происхождения, вырабатываемые живыми организмами.
Действие ферментов по сравнению с действием неорганических катализаторов имеет три отличительные особенности:
– исключительно высокая эффективность действия (увеличение скорости реакции в 1010 – 1013 раз);
– специфичность (избирательность) действия (каждый фермент катализирует строго определённую реакцию, не влияя на скорости протекания других);
– регулируемость – (ферменты обладают способностью увеличивать или уменьшать свою активность в зависимости от потребностей организма).
Несмотря на сложность строения молекул ферментов механизм их действия описывается теми же законами, которым подчиняются обычные химические реакции.
Ферментативные процессы находят широкое применение в пищевой промышленности, в частности при изготовлении молочнокислых продуктов, при производстве хлебобулочных изделий, при сбраживании вина и др.
Исследование кинетики любой реакции основано на изучении изменения концентрации одного из участников реакции во времени. Для этого необходимо применение метода анализа, чувствительного к концентрации данного вещества. Одним из таких методов является метод поляриметрии.
