
- •4.2.3.Основное уравнение молекулярно-кинетической теории
- •4.2.4.Внутренняя энергия идеального газа.
- •4.2.4.1. Число степеней свободы молекулы
- •4.2.4.2.Теорема о равнораспределении энергии по степеням свободы молекулы
- •4.2.4.3.Внутренняя энергия идеального газа
- •4.3.1.2.Термодинамическая система
- •4.3.1.3.Термодинамические параметры.
- •4.3.1.4. Равновесное состояние. Равновесные процессы.
- •4.3.2.2. Законы и уравнения термодинамики идеального газа
- •4.3.3. Внутренняя энергия термодинамической системы.
- •4.3.4.Первое начало термодинамики.
- •4.3.5.Теплоемкость идеального газа.
- •4.3.5.1.Понятие теплоемкости.
- •4.3.5.2. Изохорическая теплоемкость.
- •4.3.5.3. Изобарическая теплоемкость.
- •4.3.5.4.Теплоемкость в других изопроцессах
- •4.3.5.5.Трудности классической теории теплоемкости.
- •4.4.5.2.Изобарический процесс
- •4.7.Конденсированное состояние вещества.
- •4.7.1.Жидкости
- •4.7.2.Поверхностное натяжение
- •4.7.3.Смачивание. Капиллярные явления
4.3.1.2.Термодинамическая система
Термодинамической системой называют совокупность макроскопических тел, которые могут взаимодействовать между собой и с другими телами (внешней средой) – обмениваться с ними энергией и веществом. Термодинамическая система состоит из столь большого числа атомов, молекул и т.п., что ее состояние можно характеризовать макроскопическими параметрами: плотностью, давлением, концентрацией веществ, образующих термодинамическую систему. Простейшей термодинамической системой является идеальный газ.
Тела, не входящие в систему, называются внешними телами или окружающей средой.
Термодинамическая система может считаться замкнутой, если отсутствует обмен веществом между системой и окружающей средой.
Если система не поглощает и не отдает тепла, то она называется адиабатически изолированной.
4.3.1.3.Термодинамические параметры.
Одна и та же система может иметь различные свойства, или находиться в различных состояниях. Состояние системы определяется совокупностью измеренных физических величин – параметров. Различают внешние и внутренние параметры системы.
Внутренние параметры – это величины, характеризующие свойства самой системы - например, давление P и температура T.
Внешние параметры – это величины, характеризующие свойства внешних тел. В отсутствие внешних полей газ имеет единственный внешний параметр – объем V.
4.3.1.4. Равновесное состояние. Равновесные процессы.
Если все параметры системы имеют определенные значения, остающиеся при неизменных внешних условиях постоянными сколь угодно долго, то такое состояние системы называется равновесным, или квазистатическим. Любое равновесное состояние изображается точкой на диаграммах P-V, V-T или P-T.
Неравновесное состояние. состояние термодинамической системы называется неравновесным, если c течением времени параметры термодинамической системы изменяются. Неравновесное состояние не может быть изображено графически. Замкнутая и изолированная термодинамическая система c течением времени всегда самопроизвольно переходит в равновесное состояние и никогда самопроизвольно выйти из него не может.
термодинамический процесс - это переход термодинамической системы из одного состояния в другое, сопровождающийся изменением хотя бы одного из параметров системы.
Все количественные выводы термодинамики применимы, строго говоря, только к равновесным процессам.
Процесс называют равновесным, если внешние условия меняются так медленно, что в любой момент времени систему можно считать равновесной. Именно равновесный процесс может быть изображен графически.
Термодинамика базируется на двух основных экспериментально установленных законах (началах) термодинамики, которые будут рассматриваться ниже.
4.3.2.2. Законы и уравнения термодинамики идеального газа
Законы и уравнения термодинамики идеального газа установлены в результате обобщения очень большого количества экспериментальных данных. Это такие законы и уравнения как закон Бойля - Мариотта:
![]() (4.3.5)
(4.3.5)
(изотермический процесс);1
закон Гей-Люссака:
 (4.3.6
)
(4.3.6
)
(изобарический процесс);
закон Шарля:
 (4.3.7
)
(4.3.7
)
(изохорический процесс).
На рисунках 4.3.1 . . . 4.3.3 представлены графики изотермических,
и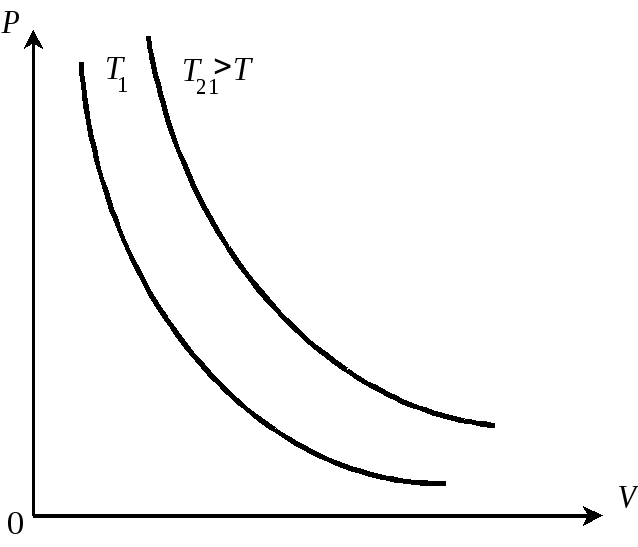 зобарических
и изохорических процессов, соответственно.
зобарических
и изохорических процессов, соответственно.
Рис. 4.3.1.Изотермы идеального газа
Р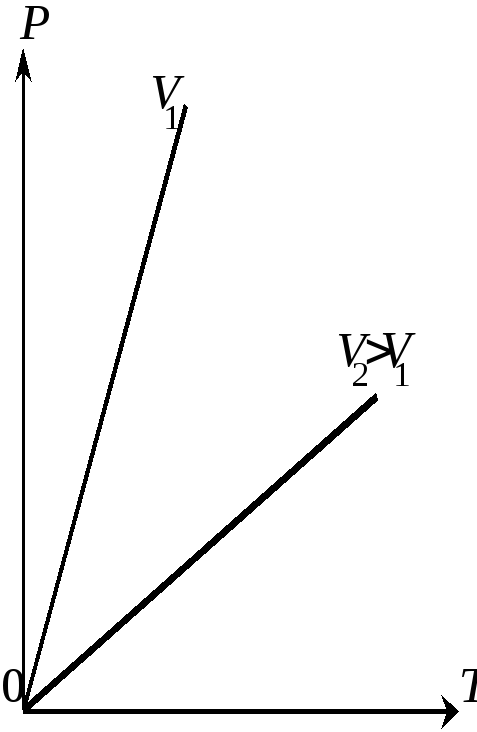
 ис.
4.3.2.Изобары идеального газа
ис.
4.3.2.Изобары идеального газа
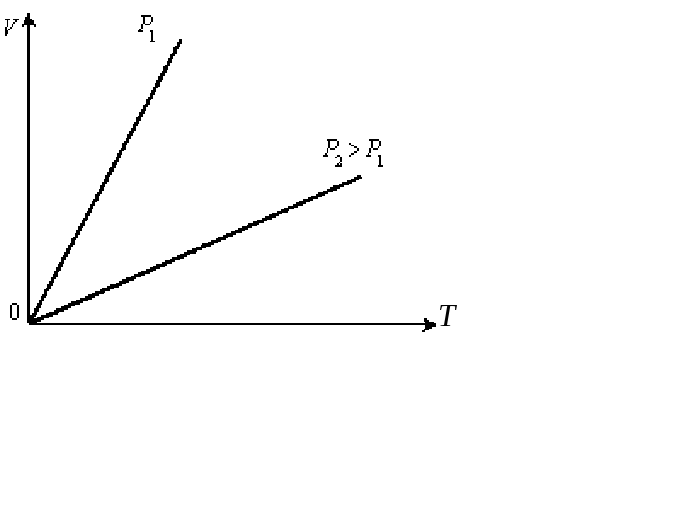
Рис. 4.3.3.Изохоры идеального газа
