
- •Глава 6 водяной пар и его свойства
- •§6.1. Основные понятия и определения
- •§ 6.2. Термодинамическая фазовая рТ – диаграмма. Уравнение клапейрона - клаузиуса
- •§ 6.6. Основные параметры воды и водяного пара
- •§ 6.7. Процессы изменения состояния водяного пара в pν -,ts - и is -диаграммах
- •§ 6.8. Влажный воздух. Абсолютная влажность, влагосодержание и относительная влажность воздуха
- •§ 6.9. Теплоемкость и энтальпия влажного воздуха
- •Глава 7 термодинамика газового потока
- •§ 7.1. Уравнение энергии газового потока
- •§7.2. Располагаемая работа газового потока
- •§ 7.3. Основные закономерности соплового и диффузорного адиабатного течения газа
- •§ 7.4. Истечение идеального газа из суживающихся сопел
- •§ 7.5 Истечение идеального газа из комбинированного сопла лаваля
- •§ 7.6. Расчет истечения реальных газов и паров
- •7.7 Адиабатное дросселирование
- •§ 7.8. Дроссельный эффект (эффект джоуля-томсона)
- •§ 7.9. Газовые смеси
- •Глава 8 компрессорные машины
- •§ 8.1. Мощность привода и коэффициенты полезного действия компрессора
- •§ 8.2. Многоступенчатый компрессор
- •Глава 9 циклы поршневых двигателей внутреннего сгорания
- •§ 9.1. Краткие исторические сведения
- •§ 9.2. Классификация двс
- •§ 9.3. Циклы двс с подводом теплоты при постоянном объёме
- •§9.4. Циклы двс с подводом теплоты при постоянном давлении
- •§ 9.5. Циклы двс со смешанным подводом теплоты
- •Глава 10 циклы газотурбинных установок и реактивных двигателей
- •§ 10.1. Циклы гту с подводом теплоты при постоянном давлении
- •§10.2. Циклы гту с подводом теплоты при постоянном объеме
- •§ 10.3. Методы повышения термического кпд гту
- •§ 10.4. Циклы реактивных двигателей. Жидкостные реактивные двигатели
- •10.5. Воздушно-реактивные двигатели
- •§ 10.6. Пульсирующий воздушно-реактивный двигатель
- •§ 10.7. Компрессорные воздушно-реактивные двигатели
- •§ 10.8. Термодинамические методы сравнения циклов тепловых двигателей
- •Глава 11 циклы паросиловых установок мгд-генератор
- •§ 11.1. Цикл карно во влажном паре и его недостатки
- •§ 11.2. Основной цикл псу-цикл ренкина
- •§ 11.3. Полезная работа цикла ренкина. Работа питательного насоса
- •§ 11.4. Термический кпд цикла ренкина
- •§ 11.5. Влияние параметров пара на термический кпд цикла ренкина
- •§ 11.6. Промежуточный перегрев пара
- •§ 11.7. Регенеративный цикл паросиловой установки
- •§ 11.8. Бинарные (двойные) циклы
- •§ 11.9. Циклы парогазовых установок
- •§ 11.10. Циклы атомных электростанций
- •§ 11.11. Циклы электрических станций с магнитогидродинамическими генераторами
- •Глава 12 циклы холодильных машин
- •§12.1. Цикл воздушной холодильной установки
- •§ 12.2. Цикл паровой компрессорной холодильной установки
- •§ 12.3. Цикл холодильной установки абсорбционного типа
- •§ 12.4. Цикл пароэжекторной холодильной установки
- •§ 12.5. Тепловой насос
- •§ 12.6. Вихревая труба
- •§ 12.7. Термотрансформаторы
- •Глава 13 элементы химической термодинамики
- •§ 13.1. Классификация химических реакций
- •§13.2. Первый закон термодинамики в применении к химическим реакциям
- •§ 13.3. Тепловой эффект реакции
- •§ 13.4. Теплоты химических реакций
- •§ 13.5. Закон гесса
- •§13.6..Закон кирхгофа
- •§ 13.7. Применение второго закона термодинамики к химическим процессам
- •§ 13.8. Изохорно-изотермический и изобарно-изотермический потенциалы
- •§13.9. Максимальная работа реакции
- •§ 13.10. Уравнения максимальной работы (уравнения гиббса-гельмгольца)
- •13.11. Химический потенциал
- •§ 13.12. Условия равновесия в изолированных однородных (гомогенных) системах
- •§ 13.13. Условия равновесия в изолированных неоднородных (гетерогенных) системах и химических реакциях
- •§13.14. Равновесие в химических реакциях
- •§ 13.15. Закон действующих масс. Константы равновесия химических реакций
- •§ 13.16. Термическая диссоциация. Степень диссоциации
- •§ 13.17. Зависимость между константой равновесия и степенью диссоциации
- •§ 13.18. Зависимость между константой равновесия и максимальной работой. Уравнение изотермы химической реакции
- •§ 13.19. Влияние температуры реакции на химическое равновесие. Принцип ле-шателье
- •§ 13.20, Тепловая теорема нернста. Третье начало термодинамики
- •§ 13.21. Третье начало термодинамики в формулировке планка (постулат планка)
§ 13.15. Закон действующих масс. Константы равновесия химических реакций
Соотношения (13.22), (13.25), (13.39), выведенные на основе второго закона термодинамики, позволяют установить условия химического равновесия. Рассмотрим газовую химическую реакцию для гомогенной системы
а
 А+
bB
cC+dD,
А+
bB
cC+dD,
где а, b, с, d - числа молей (стехиометрические коэффициенты) соответственно веществ А, В, С, D. Соотношение (13.39) можно записать в виде
![]() (13.42)
(13.42)
где
![]() -
химические
потенциалы веществ А В,
С, D
при
равновесии.
-
химические
потенциалы веществ А В,
С, D
при
равновесии.
В случае идеальных газов значение химического потенциала компонентов определяется по формуле (13.40). На основе этой формулы можно записать
![]() .
.
Отсюда
 . (13.43)
. (13.43)
Ввиду постоянства
правой части при определенной температуре
левая часть также должна быть постоянной.
Тогда, обозначая левую часть через
![]() ,
получим
,
получим
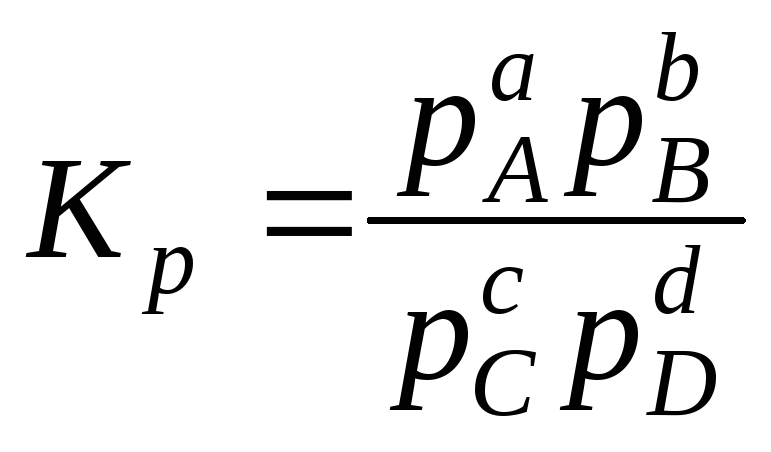 , (13.44)
, (13.44)
 где
Кр
-
константа равновесия химической реакции
по парциальным давлениям.
где
Кр
-
константа равновесия химической реакции
по парциальным давлениям.
Соотношение (13.44) является математическим выражением закона действующих масс. Подставляя (13.41) в (13.44), получим выражение константы химической реакции по концентрациям

или
 , (13.45)
, (13.45)
где
![]()
Для реакций, в которых не происходит изменение числа молей, Кc=Кp ,
так
как
![]() .
Рассмотрим химическую реакцию вида
.
Рассмотрим химическую реакцию вида
A
 + B
C+D.
+ B
C+D.
Выше было показано, что при определенных условиях скорость химической реакции определяется концентрациями реагирующих веществ. Скорости прямой и обратной реакций будут
![]() ;
; ![]() ,
,
где к1 и к2- константы скорости прямой и обратной реакций; CA , СB, СC ,CD - концентрации веществ в данный момент времени.
Рассмотрим более сложную реакцию, в которую входит равное количество молей веществ
а
 А+bВ
сС + dD.
А+bВ
сС + dD.
Скорости прямой и обратной реакции будут
![]() ;
;
Например, для реакции вида
C
 O+H2O CO2+H2
O+H2O CO2+H2
можно записать
![]()
![]() .
.
В
процессе реакции скорость прямой реакции
вследствие уменьшения концентрации
исходных веществ будет уменьшаться, а
скорость обратной - возрастать. В какой-то
момент скорости будут равны
![]() ,
и
наступает химическое равновесие,
являющееся динамическим, так как и
прямая, и обратная реакции продолжают
идти, но с равными скоростями.
,
и
наступает химическое равновесие,
являющееся динамическим, так как и
прямая, и обратная реакции продолжают
идти, но с равными скоростями.
Приравнивая значения скоростей реакций, получим
![]() .
.
Отсюда
 .
.
Закон действующих масс (см. уравнения (13.44), (13.45)), полученный для смеси идеальных газов, применим и к процессам диссоциации (разложения сложных веществ на более простые).
§ 13.16. Термическая диссоциация. Степень диссоциации
Термической диссоциацией называется разложение сложных веществ на более простые. Приведем примеры диссоциации водяного пара и углекислоты
2
 Н2O
2Н2+O2;
Н2O
2Н2+O2;
2
 СO2
2СО+O2.
СO2
2СО+O2.
При температурах 2500 °С и более двухатомные газы разлагаются на одноатомные, например,
O
 2
2O;
2
2O;
Н
 2
2Н.
2
2Н.
Диссоциация - это эндотермическая реакция, т.е. для ее осуществления необходимы затраты энергии извне.
Доля моля конечного вещества реакции, превратившегося к моменту равновесия в исходные продукты, называется степенью диссоциации а. Например, при горении водорода
Н
 2+0,5О2
Н2O
2+0,5О2
Н2O
при полном сгорании одного моля водорода с участием половины моля кислорода получается один моль водяного пара. Однако в результате диссоциации к моменту равновесия в смеси будет не 1 моль водяного пара, а (1-α) молей. В смеси будут присутствовать продукты диссоциации (водород и кислород), причем молей водорода будет вдвое больше, чем кислорода, ввиду того, что при разложении водяного пара образуется одна молекула водорода и половина молекулы кислорода.
Степень диссоциации позволяет определить состав смеси реагирующих веществ в момент равновесия. Ввиду того, что константы равновесия также позволяют определить этот состав, то они должны быть связаны между собой зависимостями вида
![]() и
и
![]() .
.
