
- •Оглавление
- •2 Электрохимические системы
- •2.1. Определение электрохимической системы
- •2.2. Прохождение электрического тока в электрохимической системе. Законы фарадея
- •2.3. Термодинамически обратимые и необратимые электрохимические системы
- •2.4. Классификация термодинамически обратимых электрохимических систем
- •2.5. Составляющие электрохимической системы
- •2.6. Идеальные и реальные электрохимические системы
- •3 Метод активности
- •3.1. Формальный метод активности льюиса
- •3.2. Расчет коэффициента активности по дебдш и хюккелю
- •3.3. Расчет коэффициента активности по робинсону и стоксу
- •3.4. Эмпирические способы расчета коэффициентов активности
- •4 Ионные равновесии
- •4.1. Ионные равновесия в растворах электролитов
- •4.2. Сольволиз и буферные свойства
- •4.3. Константы образования комплексных ионов
- •4.4. Ступенчатая диссоциация электролитов
- •4.5. Ионные равновесия в растворах электролитов в присутствии твердой фазы
- •5 Процессы переноса в электрохимических системах
- •5.1. Электрическая проводимость
- •5.1.1. Электронная проводимость
- •Ионная проводимость
- •Электрическая проводимость газов
- •5.1.2.2. Электрическая проводимость твердых тел
- •5.1.2.3. Электрическая проводимость расплавленных соединений
- •5.1.2.4. Электрическая проводимость растворов
- •5.1.3. Теории электрической проводимости растворов
- •5.1.3.1. Простая гидродинамическая теория
- •5.1.3.2. Теория дебая – хюккеля – онзагера
- •5.1.3.3. Теория эйринга
- •5.1.3.4. Протолитическая теория электролитической проводимости
- •5.1.3.5. Применение средней ионной активности для расчета проводимости
- •5.2. Диффузия в растворах электролитов
- •5.3. Диффузионный, или жидкостный, потенциал
- •5.4. Конвективный перенос в растворах
- •5.5. Термодиффузия
- •6. Напряжение электрохимических систем
- •6.1. Возникновение напряжения в электрохимической системе
- •6.2. Равновесные потенциалы на границах раздела фаз
- •6.3. Уравнения равновесного электродного потенциала
- •6.4. Влияние температуры на электродный потенциал
- •6.5. Выбор относительной шкалы потенциалов
- •6.6. Электроды сравнения
- •6.7. Правило лютера
- •6.8. Термодинамическое равновесие с растворителем
- •6.9. Расчет напряжения электрохимических систем с помощью потенциалов в относительной шкале
- •6.9.1. Напряжение электрохимических систем с химической реакцией
- •Напряжение электрохимических систем без химической реакции
- •Напряжение электрохимических систем без химической реакции
- •6.10. Методы устранения диффузионного потенциала
- •4,2 Кмоль/м3 20,4 кмоль/м3
- •6.11. Термодинамика электрохимических систем
- •6.12. Ионоселективные электроду
- •6.12.1. Уравнение мембранного потенциала
- •6.12.2. Электроды с твердыми ионитовыми мембранами
- •6.12.3. Электроды с жидкими ионитовыми memбpahaми
- •6.12.4. Измерение напряжения электрохимических систем с ионоселективными электродами
- •7 Двой ной электрический слой
- •Явления адсорбции при образовании двойного электрического слоя
- •Злектрокапиллярные явления на ртути и твердых металлах
- •7.3. Емкость двойного электрического слоя
- •7.3.1. Влияние специфической адсорбции ионов на поверхностное натяжение и емкость двойного электрического слоя
- •7.3.2. Заряжение емкости двойного электрического слоя
- •7.4. Теории строения двойного электрического слоя
- •7.5. Двойной слой на твердых электродах
- •7.6. Двойной слой на электродах в расплавленных и твердых электролитах
- •%(%8 Кинетика электродных процессов
- •8.1. Поляризационные кривые
- •8.2. Перенапряжение электрохимической стадии
- •8.2.1. Уравнение поляризационной кривой без учета специфической адсорбции и ψ’-потенциала
- •Влияние ψ’-потенциала на скорость реакции разряда — ионизации
- •8.2.3. Стандартная константа скорости реакции переноса электрона и стандартная плотность тока обмена
- •8.2.4. Способы определения коэффициентов переноса из поляризационных кривых
- •8.3. Стадийные электродные реакции
- •8.4. Электрохимические реакции, включающие быстрые химические стадии
- •8.5. Определение порядков электрохимических реакций
- •8.6. Безбарьерные и безактивациониые электрохимические реакции
- •8.7. Кинетика реакций при конечных степенях заполнения поверхности
- •9 Диффузионная кинетика
- •9.1. Перенапряжение диффузии
- •9.2. Перенапряжение диффузии с учетом миграции
- •9.3. Поляризационные кривые при замедленной стадии диффузии
- •9.4. Окислительно-восстановительные реакции
- •9.5. Сложные окислительно-восстановительные реакции
- •9.6. Наложение перенапряжения диффузии и замедленного переноса электронов (смешанная кинетика)
- •10 Перенапряжение химической реакции
- •10.1. Перенапряжение, обусловленное предшествующей гомогенной химической реакцией в катодном процессе и последующей химической реакцией в анодном процессе
- •10.2. Общий случай электрохимической реакции с замедленной гомогенной химической стадией
- •10.3. Перенапряжение, обусловленное гетерогенными химическими стадиями
- •10.4. Зависимость плотности тока от концентрации и порядок химической реакции
- •11 Примеры различных механизмов электрохимических реакций
- •11.1. Реакция выделения водорода
- •11.2. Кинетика реакций в расплавах и твердых электролитах
- •12 Кинетика реакций электрохимического выделения металлов
- •12.1. Кинетика реакций выделения металлов на жидких катодах
- •12.2. Кинетика реакций при электроосаждении металлов на твердых электродах
- •12.3. Влияние поверхностно-активных веществ на рост кристаллов
- •12.4. Влияние природы металла и состава раствора на кинетические параметры
- •12.5. Электроосаждение металлов из расплавов
- •12.6. Электрохимическое восстановление оксидов
- •13 Анодное растворение и пассивность металлов
- •13.1. Анодное растворение металлов
- •13.2. Пассивность металлов
- •13.2.1. Теория пассивности
- •13.2.2. Кинетика процесса пассивирования
- •14 Короткозамкнутые электрохимические системы
- •14.1. Общие положения
- •14.2. Электрохимическая коррозия
- •14.2.1. Скорость коррозии металла и коррозионный потенциал
- •14.2.2. Растворение металлов под током в коррозйонноактивных средах
- •14.2.3. Коррозия технических металлов
- •14.2.4. Способы снижения скорости коррозионного процесса
- •14.3. Контактное вытеснение металлов (цементация)
- •14.3.1. Общие положения
- •14.3.2. Кинетика процесса цементации
- •14.3.3. Конечный период цементации
- •15 Параллельные электрохимические реакции
- •15.1. Условия протеканий параллельных реакций
- •15.2. Распределение плотности тока между параллельными реакциями
- •16 Основы методов исследования электрохимических реакций
- •16.1. Общие требования к методам исследования
- •16.2. Электроды, применяемые в кинетических исследованиях
- •16.3. Измерение потенциалов под током
- •16.4. Методы исследования
- •Литература
14.3.2. Кинетика процесса цементации
Скорость процесса цементации при отсутствии побочных реакций выражается массой вытесняемого металла, осевшего на поверхности вытесняющего металла в единицу времени, или массой вытесняющего металла, переходящего в ионное состояние. Поскольку при токе I (А), протекающем от катодных участков к анодным, скорость (моль/с) процесса катодного восстановления ионов или анодного окисления металла выражается отношением I/zF, то именно эта величина и будет скоростью процесса цементации. С другой стороны, если цементацию ведут при постоянном объеме электролита V (м3), то уменьшение массы вытесняемого металла в единицу времени составит –VdC2/dτ (где C2 — концентрация ионов вытесняемого металла) и основное уравнение процесса цементации запишется так:
![]()
где К = 1/zFV.
Заменим в этом уравнении ток I плотностью тока i = I/S (здесь S — поверхность, м2):
![]()
Это уравнение справедливо во всех случаях, когда отсутствуют побочные реакции. В более общем виде уравнение скорости можно
записать так:
![]()
Здесь С1 — концентрация ионов вытесняющего металла.
Для решения уравнения необходимо все величины, которые могут изменяться со временем, выразить через функции, связывающие изменение этих величин с изменением концентрации ионов вытесняемого металла. В связи с разнообразием контролирующих стадий процесса и их возможной сменой в ходе цементации описание всех случаев кинетики цементации единым уравнением не пред- ставляется возможным. Поэтому рассмотрим наиболее важные уравнения скорости цементации для главного периода, отвечающие той или иной контролирующей стадии *.
Случай 1. Скорость контролируется процессом восстановления ионов вытесняемого металла, протекающим на предельном токе. Осаждение идет на внешней поверхности катодных участков. Катодная поверхность все время остается постоянной.
Подставим в основное уравнение кинетики выражение для предельного тока диффузии:
![]()
Если толщина δ диффузионного слоя не изменяется, т. е. процесс идет при постоянных гидродинамических условиях, то в правой части уравнения все величины в скобках постоянны и
![]()
Интегрирование уравнения приводит к выражению:
ln С2 = – Κτ + const
При
τ
= 0
концентрация ионов вытесняемого металла
равна начальной их концентрации
![]() откуда
откуда
const
= ln
![]()
и окончательно:
ln
С2
= ln
![]() – Κτ
– Κτ
Это уравнение оправдывается в большом числе случаев как в условиях неопределенного гидродинамического режима (например, при вытеснении ионов селена медью по данным В. К. Гаркуна и И. А. Кузина, приведенным на рис. 14.16), так и при проведении процесса на вращающемся диске. В последнем случае, как установили М. А. Епископосян и И. А, Каковский на примерах цементации ионов меди и серебра железом, подтверждается требуемая теорией зависимость скорости процесса от корня квадратного из скорости вращения диска, соответствие рассчитанных и экспериментальных значений констант скоростей и, наконец, значение энергии активации (12 — 16 кДж/моль), характерное для процессов, контролируемых диффузией.
* В процессе цементации коэффициент активности, как правило, изменяется незначительно. Поэтому в этом разделе активности заменены концентрациями.

Рис. 14.16. Зависимость логарифма остаточной концентрации селена от времени цементации.
Случай 2. Разряд ионов вытесняемого металла происходит при предельном токе на внешней поверхности вытесняемого металла, но значение активной поверхности обратно пропорционально количеству осевшего металла. Тогда
S
= K1/(![]() – C2)
– C2)
и после разделения переменных уравнение –dC2/dτ = (DS/δV)C2 превращается в
![]()
Записываем это уравнение в виде
![]()
и после интегрирования получаем
–![]() ln
C2
+ C2
= K1τ
+ const
ln
C2
+ C2
= K1τ
+ const
Как
и раньше, при τ
=
0 С2
=
![]() .
Тогда
.
Тогда
const
= –![]() ln
ln
![]() +
+
![]()
Следовательно

и окончательно

Это уравнение, выведенное Б. В. Дроздовым, охватывает случай цементации ионов меди из сульфатного раствора никелевым порошком (рис. 14.17).
Случай 3. Восстановление ионов вытесняемого металла происходит на наружной поверхности, а скорость процесса определяется диффузией ионов вытесняющего ме-талла через поры цементного осадка.
В начальный период цементации увели- чивается концентрация ионов вытесняемого

Рис. 14.17. Проверка уравнения Дроздова на примере цементации ионов меди никелем:
а — зависимость концентрации ионов меди от времени; б —тоже в координатах Дроздова.
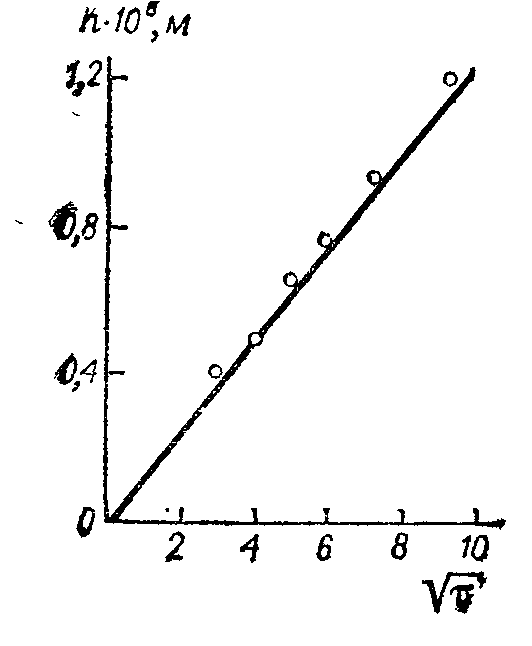
Рис. 14.18. Проверка уравнения Бермана на примере цементации ионов меди железом.
h — толщина слоя меди, пропорциональная уменьшению концентрации ионов меди в электролите.
металла
у его поверхности и достигает величины,
близкой к насыщению. Диф-фузия в раствор
происходит со скоростью (D1/δ)(![]() –
C1).
Поскольку концентрация C1
изменяется в течение опыта незначительно,
можно принять (
–
C1).
Поскольку концентрация C1
изменяется в течение опыта незначительно,
можно принять (![]() –
C1)
= const.
Толщина диффузионного слоя изменяется
во времени пропорционально количеству
сцементированного металла (
–
C1)
= const.
Толщина диффузионного слоя изменяется
во времени пропорционально количеству
сцементированного металла (![]() –
C2).
–
C2).
Тогда
– dC2/dτ
= K/(![]() –
C2)
и
–
C2)
и
![]() dC2
– C2dC2
= – Kdτ
dC2
– C2dC2
= – Kdτ
Интегрирование дает:
![]() C2
– ½C22
= – Kτ
+ const
C2
– ½C22
= – Kτ
+ const
При
τ
= 0 С2
=
![]() .
Следовательно, const
= ½
.
Следовательно, const
= ½![]() и
и
![]() – 2
– 2![]() С2
+ + C22
= 2Kτ
или
С2
+ + C22
= 2Kτ
или
![]() .
Это уравнение впервые предложил И. А.
Берман. Его справедливость подтверждается
рис. 14.18.
.
Это уравнение впервые предложил И. А.
Берман. Его справедливость подтверждается
рис. 14.18.
Случай 4. Осаждение происходит на внешней поверхности вытесняемого металла. Омическое сопротивление пренебрежимо мало. Следовательно, поверхность эквипотенциальна. Скорости как катодной, так и анодной реакций определяются практически целиком электрохимической поляризацией. Поверхности, на которых протекают катодная и анодная реакции, все время остаются постоянными. Область потенциалов при цементации достаточно удалена от потенциалов чистых металлов, так что скоростями обратных реакций в кинетических уравнениях можно пренебречь. При соблюдении указанных допущений
Ik = Ia
причем
Ik = ikSk; Ia = iaSa
Для плотности катодного и анодного токов напишем кинетические выражения теории замедленного разряда в виде:
![]() и
и
![]() Здесь р
—
порядок реакций; αк*
и αа*
— кажущиеся коэффициенты переноса.
Здесь р
—
порядок реакций; αк*
и αа*
— кажущиеся коэффициенты переноса.
Запишем для тока:
![]() и
и
![]()
Прологарифмируем эти выражения и исключим из них потенциал
![]()
С учетом выражения Iк = Ia получим
![]() или
или
![]()
Подставив значение Iк в основное уравнение, имеем:

Здесь в константу K’ собраны все постоянные величины. Выражение получили В. Л. Хейфец и А. Л. Ротинян.
Отличительной особенностью данного уравнения является зависимость порядка реакции от величин коэффициентов переноса и порядка катодной реакции по восстанавливающимся ионам. Если p = 1 (что наиболее часто встречается), то уравнение приводит к дробному показателю степени у концентрации С2. И только при αk* = 0, т. е. если допустить, что катодный процесс протекает в режиме безактивационного разряда, скорость реакции цементации будет первого порядка. Довольно часто при двухэлектронной суммарной реакции катодный процесс восстановления ионов металла протекает при замедленной стадии присоединения первого электрона (αк* = 0,5), а анодный — при замедленной стадии отщепления второго электрона (αа* = 1,5), В этом случае показатель степени у концентрации оказывается равным 3/4, если р = 1, и 3/2, если р = 2, т. е. если в катодном процессе участвуют двухъядерные комплексы цементируемого металла.
М. И. Алкацев установил, что при цементации ионов меди железом в условиях воздействия на электролит ультразвука зависимость скорости процесса от концентрации ионов меди в растворе перестает быть прямолинейной, т. е. уравнение скорости первого порядка перестает оправдываться (рис. 14.19, а). Это может быть обусловлено тем обстоятельством, что в условиях ультразвукового перемешивания процесс не контролируется диффузионными ограничениями. Тогда можно ожидать, что скорость процесса будет определяться электрохимическим контролем. Если это предположение справедливо, то в координатах lg i — lg C кривая рис. 14. 19, а должна превратиться в прямую линию.
Прямая на рис. 14.19, б действительно подтверждает приведенное выше предположение, причем тангенс угла наклона равен 0,7. Таким образом, эти данные свидетельствуют о том, что в условиях

Рис. 14.19. Проверка уравнения на примере цементации ионов меди железом из подкисленного сульфатного раствора в условиях перемешивания раствора ультразвуком:
а
— зависимость скорости цементации iц
от концентрации ионов меди
![]() ;
б
— то же в логарифмических
координатах.
;
б
— то же в логарифмических
координатах.
опытов процесс контролируется электрохимическими стадиями, причем в катодном процессе восстановления ионов меди замедленным является присоединение первого электрона, а в анодном процессе ионизации атомов железа — отщепление второго электрона.
