
- •Оглавление
- •2 Электрохимические системы
- •2.1. Определение электрохимической системы
- •2.2. Прохождение электрического тока в электрохимической системе. Законы фарадея
- •2.3. Термодинамически обратимые и необратимые электрохимические системы
- •2.4. Классификация термодинамически обратимых электрохимических систем
- •2.5. Составляющие электрохимической системы
- •2.6. Идеальные и реальные электрохимические системы
- •3 Метод активности
- •3.1. Формальный метод активности льюиса
- •3.2. Расчет коэффициента активности по дебдш и хюккелю
- •3.3. Расчет коэффициента активности по робинсону и стоксу
- •3.4. Эмпирические способы расчета коэффициентов активности
- •4 Ионные равновесии
- •4.1. Ионные равновесия в растворах электролитов
- •4.2. Сольволиз и буферные свойства
- •4.3. Константы образования комплексных ионов
- •4.4. Ступенчатая диссоциация электролитов
- •4.5. Ионные равновесия в растворах электролитов в присутствии твердой фазы
- •5 Процессы переноса в электрохимических системах
- •5.1. Электрическая проводимость
- •5.1.1. Электронная проводимость
- •Ионная проводимость
- •Электрическая проводимость газов
- •5.1.2.2. Электрическая проводимость твердых тел
- •5.1.2.3. Электрическая проводимость расплавленных соединений
- •5.1.2.4. Электрическая проводимость растворов
- •5.1.3. Теории электрической проводимости растворов
- •5.1.3.1. Простая гидродинамическая теория
- •5.1.3.2. Теория дебая – хюккеля – онзагера
- •5.1.3.3. Теория эйринга
- •5.1.3.4. Протолитическая теория электролитической проводимости
- •5.1.3.5. Применение средней ионной активности для расчета проводимости
- •5.2. Диффузия в растворах электролитов
- •5.3. Диффузионный, или жидкостный, потенциал
- •5.4. Конвективный перенос в растворах
- •5.5. Термодиффузия
- •6. Напряжение электрохимических систем
- •6.1. Возникновение напряжения в электрохимической системе
- •6.2. Равновесные потенциалы на границах раздела фаз
- •6.3. Уравнения равновесного электродного потенциала
- •6.4. Влияние температуры на электродный потенциал
- •6.5. Выбор относительной шкалы потенциалов
- •6.6. Электроды сравнения
- •6.7. Правило лютера
- •6.8. Термодинамическое равновесие с растворителем
- •6.9. Расчет напряжения электрохимических систем с помощью потенциалов в относительной шкале
- •6.9.1. Напряжение электрохимических систем с химической реакцией
- •Напряжение электрохимических систем без химической реакции
- •Напряжение электрохимических систем без химической реакции
- •6.10. Методы устранения диффузионного потенциала
- •4,2 Кмоль/м3 20,4 кмоль/м3
- •6.11. Термодинамика электрохимических систем
- •6.12. Ионоселективные электроду
- •6.12.1. Уравнение мембранного потенциала
- •6.12.2. Электроды с твердыми ионитовыми мембранами
- •6.12.3. Электроды с жидкими ионитовыми memбpahaми
- •6.12.4. Измерение напряжения электрохимических систем с ионоселективными электродами
- •7 Двой ной электрический слой
- •Явления адсорбции при образовании двойного электрического слоя
- •Злектрокапиллярные явления на ртути и твердых металлах
- •7.3. Емкость двойного электрического слоя
- •7.3.1. Влияние специфической адсорбции ионов на поверхностное натяжение и емкость двойного электрического слоя
- •7.3.2. Заряжение емкости двойного электрического слоя
- •7.4. Теории строения двойного электрического слоя
- •7.5. Двойной слой на твердых электродах
- •7.6. Двойной слой на электродах в расплавленных и твердых электролитах
- •%(%8 Кинетика электродных процессов
- •8.1. Поляризационные кривые
- •8.2. Перенапряжение электрохимической стадии
- •8.2.1. Уравнение поляризационной кривой без учета специфической адсорбции и ψ’-потенциала
- •Влияние ψ’-потенциала на скорость реакции разряда — ионизации
- •8.2.3. Стандартная константа скорости реакции переноса электрона и стандартная плотность тока обмена
- •8.2.4. Способы определения коэффициентов переноса из поляризационных кривых
- •8.3. Стадийные электродные реакции
- •8.4. Электрохимические реакции, включающие быстрые химические стадии
- •8.5. Определение порядков электрохимических реакций
- •8.6. Безбарьерные и безактивациониые электрохимические реакции
- •8.7. Кинетика реакций при конечных степенях заполнения поверхности
- •9 Диффузионная кинетика
- •9.1. Перенапряжение диффузии
- •9.2. Перенапряжение диффузии с учетом миграции
- •9.3. Поляризационные кривые при замедленной стадии диффузии
- •9.4. Окислительно-восстановительные реакции
- •9.5. Сложные окислительно-восстановительные реакции
- •9.6. Наложение перенапряжения диффузии и замедленного переноса электронов (смешанная кинетика)
- •10 Перенапряжение химической реакции
- •10.1. Перенапряжение, обусловленное предшествующей гомогенной химической реакцией в катодном процессе и последующей химической реакцией в анодном процессе
- •10.2. Общий случай электрохимической реакции с замедленной гомогенной химической стадией
- •10.3. Перенапряжение, обусловленное гетерогенными химическими стадиями
- •10.4. Зависимость плотности тока от концентрации и порядок химической реакции
- •11 Примеры различных механизмов электрохимических реакций
- •11.1. Реакция выделения водорода
- •11.2. Кинетика реакций в расплавах и твердых электролитах
- •12 Кинетика реакций электрохимического выделения металлов
- •12.1. Кинетика реакций выделения металлов на жидких катодах
- •12.2. Кинетика реакций при электроосаждении металлов на твердых электродах
- •12.3. Влияние поверхностно-активных веществ на рост кристаллов
- •12.4. Влияние природы металла и состава раствора на кинетические параметры
- •12.5. Электроосаждение металлов из расплавов
- •12.6. Электрохимическое восстановление оксидов
- •13 Анодное растворение и пассивность металлов
- •13.1. Анодное растворение металлов
- •13.2. Пассивность металлов
- •13.2.1. Теория пассивности
- •13.2.2. Кинетика процесса пассивирования
- •14 Короткозамкнутые электрохимические системы
- •14.1. Общие положения
- •14.2. Электрохимическая коррозия
- •14.2.1. Скорость коррозии металла и коррозионный потенциал
- •14.2.2. Растворение металлов под током в коррозйонноактивных средах
- •14.2.3. Коррозия технических металлов
- •14.2.4. Способы снижения скорости коррозионного процесса
- •14.3. Контактное вытеснение металлов (цементация)
- •14.3.1. Общие положения
- •14.3.2. Кинетика процесса цементации
- •14.3.3. Конечный период цементации
- •15 Параллельные электрохимические реакции
- •15.1. Условия протеканий параллельных реакций
- •15.2. Распределение плотности тока между параллельными реакциями
- •16 Основы методов исследования электрохимических реакций
- •16.1. Общие требования к методам исследования
- •16.2. Электроды, применяемые в кинетических исследованиях
- •16.3. Измерение потенциалов под током
- •16.4. Методы исследования
- •Литература
13.2.2. Кинетика процесса пассивирования
Пассивирующие слои на металле не являются вполне устойчивыми по отношению к раствору. Поэтому стационарное состояние при растворении пассивного металла характеризуется параллельно протекающими реакциями образования и растворения пассивирую-щего слоя. Пассивность металла может возрастать с увеличением положительного значения потенциала, причем обычно сдвиг
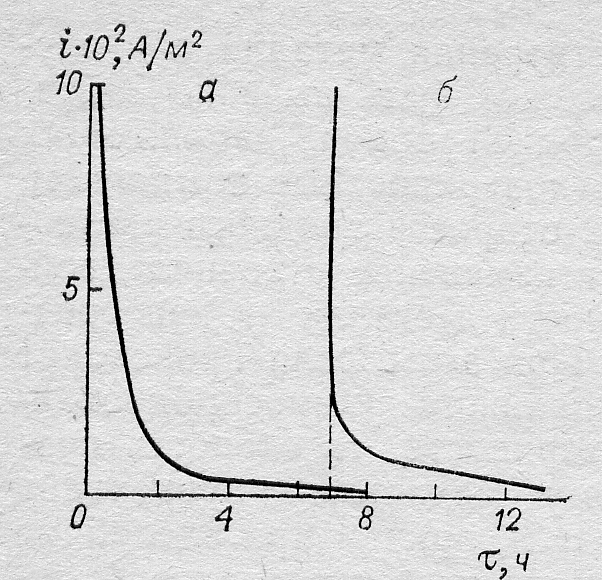
Рис. 13.2. Изменение скорости растворения хрома во времени после подачи на электрод анодного потенциала: а – Е = 0,019 В; б – Е = 0,227 В.
потенциала в положительную сторону (в область пассивности) вызывает вначале рост плотности тока, а затем ее уменьшение, иногда в течение длительного времени (рис. 13.2). Такое снижение плотности тока обусловлено двумя причинами: либо заполнением поверхности пассивирующим агентом (адсорбированным кислородом) при более положительном потенциале, либо процессом изменения состава и структуры пассивирующего слоя.
Процесс роста беспористого пассивирующего слоя на металле до толщины, большей, чем мономолекулярная, может происходить, если в нем возможна диффузия катионов к границе раздела оксид — электролит или диффузия анионов через слой оксида к поверхности металла. Другими словами, пассивирующий слой должен обладать ионной проводимостью. Движение ионов в пассивирующем слое обусловлено разностью химических потенциалов на границах и миграцией. Так как пассивирующие слои обладают сравнительно невысокой электрической проводимостью, то в них наблюдается падение потенциала, поэтому потенциал электрода в пассивном состоянии определится выражением
Е = Еп + ΔЕ
где ΔЕ — падение потенциала в слое оксида.
По мере увеличения толщины слоя при постоянной плотности тока (при постоянном ионном токе через оксид) значение ΔЕ возрастает пропорционально толщине оксида. Поэтому для таких условий должен наблюдаться линейный рост потенциала во времени. Зная толщину пленки и падение потенциала в оксиде, можно рассчитать градиент потенциала в слое, который составляет примерно 108 В/м.
Область линейной зависимости потенциала от времени пассивирования наблюдается и при образовании адсорбционных мономолекулярных слоев на благородных металлах.
Плотность ионного тока через пассивирующий оксид связана с градиентом потенциала экспоненциальной зависимостью
![]()
(где δ — толщина оксидного слоя), которая после логарифмирования имеет вид:
ln i = const + (k2/δ)ΔE
Отсюда следует линейная зависимость между логарифмом плотности ионного тока и потенциалом при постоянной толщине пленки. Экспериментальная проверка этой зависимости осуществлена на железе следующим образом. Сначала пассивируют железо в растворе серной кислоты (0,5 кмоль/м3) при потенциале 1,0 В до установления постоянной плотности тока. При этом на железе образуется пассивирующий слой толщиной δ. Затем снимают на таком электроде поляризационную кривую с достаточно быстрой разверткой потенциала от 0,8 до 1,2 В. Если за время снятия кривой не происходит изменения толщины слоя, то из предыдущих уравнений следует:
ln i = const + (k2/δ)(E – Eп)
ln i = const’ + (K2/δ)E
Зависимость плотности ионного тока от потенциала для железа в растворе H2SO4 концентрации 0,5 кмоль/м3 приведена на рис. 13.3. Аналогичная зависимость наблюдается и для запассивированного никеля.
Из последнего уравнения получается также зависимость роста толщины пленки от времени τ. Поскольку i = Q/τ, то
ln Q – 1n τ = const’ + (К2/δ)Е
или
1/δ = a – b ln τ
Это уравнение соблюдается для случаев роста пассивирующих пленок на металлах, если пассивирующие слои не растворяются в электролите (А1, Та, Ti и др.) и пассивирование проводят при постоянном потенциале и Q (рис. 13.4).
Поскольку в зависимости от состава раствора и природы металла на поверхности могут образовываться пассивирующие слои, растворяющиеся в электролите, процесс пассивирования, как указано выше, связан с соотношением скоростей образования и растворения пассивирующего слоя и, следовательно, с плотностью пассивирующего тока. Например, при анодной поляризации
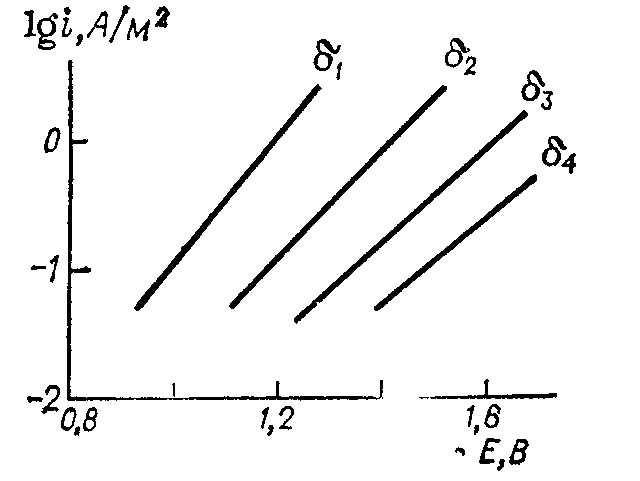
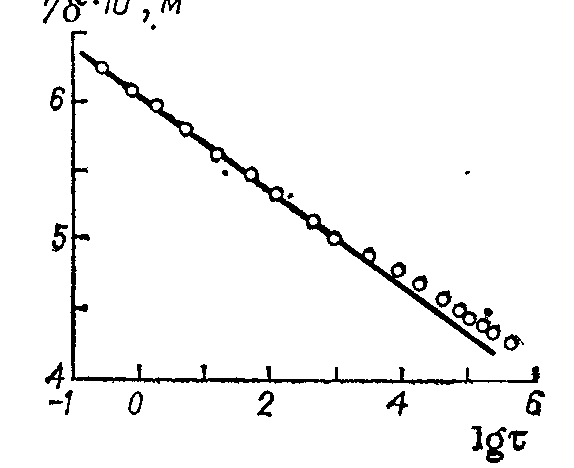
Рис. 13.3. Зависимость анодной плотности тока от потенциала пассивного железного электрода при различных толщинах оксидной пленки: δ1 < δ2 < δ3 < δ4.
Рис. 13.4. Зависимость обратной величины толщины пассивирующего слоя на тантале (Ta2O5) от времени пассивирования в потенциостатических условиях.
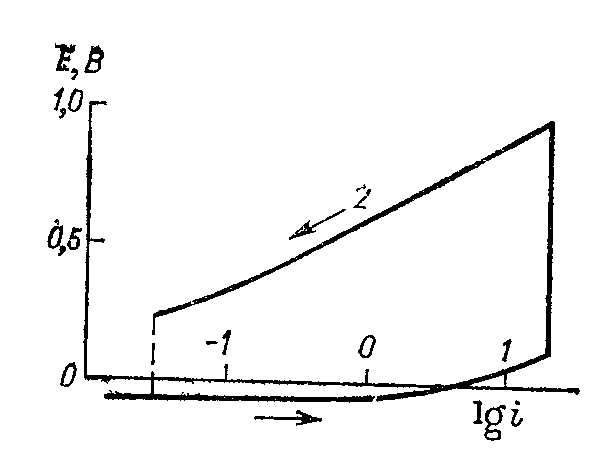
Рис. 13.5. Поляризационная кривая растворения железа в щелочи:1 — активное растворение; 2 — растворение в пассивном состоянии.
железа в растворе NaOH концентрации 10 кмоль/м3 при 80 °С и плотности тока 20 А/м2 наблюдается переход железа в пассивное состояние (рис. 13.5), но при снижении плотности тока до 3∙10–2 А/м2 железо вновь переходит в активное состояние в результате растворения в щелочи пассивирующего слоя. Явление растворения пассивирующего слоя наблюдается и при анодном растворении цинка в растворах NaOH. После перевода металла в пассивное состояние и выключения тока на нем устанавливается положительный потенциал, который с течением времени смещается в отрицательную сторону до стационарного. Время установления потенциала соответствует времени растворения пассивирующего слоя.
Пористые пассивирующие слои могут состоять и из соли металла (солевое пассивирование). В этих случаях переход электрода в активное состояние связан с концентрацией соли. Так как скорость растворения соли зависит от ее концентрации в растворе, то при высоких концентрациях соли в электролите скорость растворения пассивирующего слоя мала и пассивирование наступает при более низких плотностях тока.
Количество электричества, необходимое для образования пассивирующего слоя, который имеет способность растворяться в электролите, можно определить следующим образом. Если через электрод пропускать постоянный анодный ток, то при плотностях тока, превышающих некоторое значение, электрод переходит в пассивное состояние. Наступление пассивного состояния выражается в том, что потенциал электрода резко сдвигается в положительную сторону. Время, необходимое для наступления пассивного состояния, называется временем пассивирования τп и зависит от плотности анодного тока. Если скорость растворения пассивирующего слоя, выраженная в единицах плотности тока, равна ia’. то за время τп на растворение пассивирующего слоя расходуется ia’τп = Q1 количества электричества. Если считать, что весь ток iа идет на образование пассивирующего слоя, то за время τп должно образоваться количество, соответствующее количеству прошедшего электричества Q2 (т. е. iаτп). Очевидно, что к моменту τп на электроде осталось пассивирующего вещества, отвечающего Q2 – Q1 или
Q = Q2 – Q1 = (ia – ia’)τп
Так как ia’ соответствует скорости растворения пассивирующего слоя, которая в большинстве случаев определяется закономерностями диффузионной кинетики, то iа’ должна быть равна предельной плотности тока диффузии. Поэтому скорость реакции растворения обычно зависит от концентрации соли в растворе и перемешивания электролита. Так как для пассивирования металла обычно необходима определенная толщина пассивирующего слоя, то при различных плотностях тока должно соблюдаться равенство:
(ia – ia’)τп = const
При ia ≤ ia’ значение τп в этом равенстве должно быть либо отрицательным, либо равняться бесконечности, т. е. оно для этих условий неприменимо. Следовательно, плотность тока растворения ia’ есть одновременно и та минимальная плотность тока, при которой может произойти пассивирование. Это равенство подтверждено на примере растворения цинка в щелочи.
В случае солевого пассивирования после достижения условий его образования прохождение анодного тока и ионизация металла, сопровождаются образованием пористого пассивирующего слоя. При покрытии всей поверхности пассивирующим слоем процесс растворения перемещается в поры, в которых повышенная плотность тока вызывает пассивацию. В это время происходит растворение пассивирующего слоя в других точках. Таким образом, растворение металла осуществляется через активные мигрирующие поры. В определенных условиях растворяющиеся в электролите тонкие пассивирующие слои являются беспористыми, тогда при постоянной плотности тока наблюдаются периодические колебания потенциала.
После снятия поляризации большинство металлов через более или менее длительное время переходит в активное состояние. В ряде случаев это, как указано, связано с растворением пассивирующих слоев. Время активации зависит от толщины пассивирующего слоя и состава раствора. Активация металла катодным током, вероятно, связана с процессом восстановления оксидов либо до металла, либо до оксида низшей валентности, который растворяется в электролите. При восстановлении поверхностных оксидов катодным током рассчитывают количество электричества, пошедшее на восстановление, а если известен состав оксида, то и толщину пассивирующего слоя.
Активирующее действие на металл оказывает и анионный состав электролита. По своей активирующей способности, анионы можно расположить в ряд:
Cl– > Br– > I– > F– > ClO4– > OH–, SO42–
Активирующее действие анионов связано с адсорбционным вытеснением с поверхности электрода пассивирующего агента. Так, ионы хлора вызывают активацию железа, в щелочном растворе при положительных потенциалах, при этом происходит вытеснение адсорбированного кислорода с поверхности металла. Возможность вытеснения кислорода связана с тем, что при достаточно положительных потенциалах силы электростатического взаимодействия галогена с поверхностью настолько велики, что хлор-ионы, деформируются значительно сильнее, чем кислород.
