
- •Оглавление
- •2 Электрохимические системы
- •2.1. Определение электрохимической системы
- •2.2. Прохождение электрического тока в электрохимической системе. Законы фарадея
- •2.3. Термодинамически обратимые и необратимые электрохимические системы
- •2.4. Классификация термодинамически обратимых электрохимических систем
- •2.5. Составляющие электрохимической системы
- •2.6. Идеальные и реальные электрохимические системы
- •3 Метод активности
- •3.1. Формальный метод активности льюиса
- •3.2. Расчет коэффициента активности по дебдш и хюккелю
- •3.3. Расчет коэффициента активности по робинсону и стоксу
- •3.4. Эмпирические способы расчета коэффициентов активности
- •4 Ионные равновесии
- •4.1. Ионные равновесия в растворах электролитов
- •4.2. Сольволиз и буферные свойства
- •4.3. Константы образования комплексных ионов
- •4.4. Ступенчатая диссоциация электролитов
- •4.5. Ионные равновесия в растворах электролитов в присутствии твердой фазы
- •5 Процессы переноса в электрохимических системах
- •5.1. Электрическая проводимость
- •5.1.1. Электронная проводимость
- •Ионная проводимость
- •Электрическая проводимость газов
- •5.1.2.2. Электрическая проводимость твердых тел
- •5.1.2.3. Электрическая проводимость расплавленных соединений
- •5.1.2.4. Электрическая проводимость растворов
- •5.1.3. Теории электрической проводимости растворов
- •5.1.3.1. Простая гидродинамическая теория
- •5.1.3.2. Теория дебая – хюккеля – онзагера
- •5.1.3.3. Теория эйринга
- •5.1.3.4. Протолитическая теория электролитической проводимости
- •5.1.3.5. Применение средней ионной активности для расчета проводимости
- •5.2. Диффузия в растворах электролитов
- •5.3. Диффузионный, или жидкостный, потенциал
- •5.4. Конвективный перенос в растворах
- •5.5. Термодиффузия
- •6. Напряжение электрохимических систем
- •6.1. Возникновение напряжения в электрохимической системе
- •6.2. Равновесные потенциалы на границах раздела фаз
- •6.3. Уравнения равновесного электродного потенциала
- •6.4. Влияние температуры на электродный потенциал
- •6.5. Выбор относительной шкалы потенциалов
- •6.6. Электроды сравнения
- •6.7. Правило лютера
- •6.8. Термодинамическое равновесие с растворителем
- •6.9. Расчет напряжения электрохимических систем с помощью потенциалов в относительной шкале
- •6.9.1. Напряжение электрохимических систем с химической реакцией
- •Напряжение электрохимических систем без химической реакции
- •Напряжение электрохимических систем без химической реакции
- •6.10. Методы устранения диффузионного потенциала
- •4,2 Кмоль/м3 20,4 кмоль/м3
- •6.11. Термодинамика электрохимических систем
- •6.12. Ионоселективные электроду
- •6.12.1. Уравнение мембранного потенциала
- •6.12.2. Электроды с твердыми ионитовыми мембранами
- •6.12.3. Электроды с жидкими ионитовыми memбpahaми
- •6.12.4. Измерение напряжения электрохимических систем с ионоселективными электродами
- •7 Двой ной электрический слой
- •Явления адсорбции при образовании двойного электрического слоя
- •Злектрокапиллярные явления на ртути и твердых металлах
- •7.3. Емкость двойного электрического слоя
- •7.3.1. Влияние специфической адсорбции ионов на поверхностное натяжение и емкость двойного электрического слоя
- •7.3.2. Заряжение емкости двойного электрического слоя
- •7.4. Теории строения двойного электрического слоя
- •7.5. Двойной слой на твердых электродах
- •7.6. Двойной слой на электродах в расплавленных и твердых электролитах
- •%(%8 Кинетика электродных процессов
- •8.1. Поляризационные кривые
- •8.2. Перенапряжение электрохимической стадии
- •8.2.1. Уравнение поляризационной кривой без учета специфической адсорбции и ψ’-потенциала
- •Влияние ψ’-потенциала на скорость реакции разряда — ионизации
- •8.2.3. Стандартная константа скорости реакции переноса электрона и стандартная плотность тока обмена
- •8.2.4. Способы определения коэффициентов переноса из поляризационных кривых
- •8.3. Стадийные электродные реакции
- •8.4. Электрохимические реакции, включающие быстрые химические стадии
- •8.5. Определение порядков электрохимических реакций
- •8.6. Безбарьерные и безактивациониые электрохимические реакции
- •8.7. Кинетика реакций при конечных степенях заполнения поверхности
- •9 Диффузионная кинетика
- •9.1. Перенапряжение диффузии
- •9.2. Перенапряжение диффузии с учетом миграции
- •9.3. Поляризационные кривые при замедленной стадии диффузии
- •9.4. Окислительно-восстановительные реакции
- •9.5. Сложные окислительно-восстановительные реакции
- •9.6. Наложение перенапряжения диффузии и замедленного переноса электронов (смешанная кинетика)
- •10 Перенапряжение химической реакции
- •10.1. Перенапряжение, обусловленное предшествующей гомогенной химической реакцией в катодном процессе и последующей химической реакцией в анодном процессе
- •10.2. Общий случай электрохимической реакции с замедленной гомогенной химической стадией
- •10.3. Перенапряжение, обусловленное гетерогенными химическими стадиями
- •10.4. Зависимость плотности тока от концентрации и порядок химической реакции
- •11 Примеры различных механизмов электрохимических реакций
- •11.1. Реакция выделения водорода
- •11.2. Кинетика реакций в расплавах и твердых электролитах
- •12 Кинетика реакций электрохимического выделения металлов
- •12.1. Кинетика реакций выделения металлов на жидких катодах
- •12.2. Кинетика реакций при электроосаждении металлов на твердых электродах
- •12.3. Влияние поверхностно-активных веществ на рост кристаллов
- •12.4. Влияние природы металла и состава раствора на кинетические параметры
- •12.5. Электроосаждение металлов из расплавов
- •12.6. Электрохимическое восстановление оксидов
- •13 Анодное растворение и пассивность металлов
- •13.1. Анодное растворение металлов
- •13.2. Пассивность металлов
- •13.2.1. Теория пассивности
- •13.2.2. Кинетика процесса пассивирования
- •14 Короткозамкнутые электрохимические системы
- •14.1. Общие положения
- •14.2. Электрохимическая коррозия
- •14.2.1. Скорость коррозии металла и коррозионный потенциал
- •14.2.2. Растворение металлов под током в коррозйонноактивных средах
- •14.2.3. Коррозия технических металлов
- •14.2.4. Способы снижения скорости коррозионного процесса
- •14.3. Контактное вытеснение металлов (цементация)
- •14.3.1. Общие положения
- •14.3.2. Кинетика процесса цементации
- •14.3.3. Конечный период цементации
- •15 Параллельные электрохимические реакции
- •15.1. Условия протеканий параллельных реакций
- •15.2. Распределение плотности тока между параллельными реакциями
- •16 Основы методов исследования электрохимических реакций
- •16.1. Общие требования к методам исследования
- •16.2. Электроды, применяемые в кинетических исследованиях
- •16.3. Измерение потенциалов под током
- •16.4. Методы исследования
- •Литература
8.2.3. Стандартная константа скорости реакции переноса электрона и стандартная плотность тока обмена
При сравнении различных электрохимических реакций возникает необходимость установления величин, однозначно определяю-щих скорость реакции. Одной из них является плотность тока обмена. Однако плотность тока обмена определяет скорость реакции при равновесном потенциале и, следовательно, зависит от активности окисленной и восстановленной форм. Подставляя в уравнения для плотности тока обмена значение равновесного потенциала, получим:
![]()
Здесь i00 — стандартная плотность тока обмена, которая уже не зависит от активности и характеризует скорость обмена при aOx = 1 и aRed = 1.
Так как в выражения для констант скоростей входит множитель zF, то уравнение для плотности тока обмена может быть записано
в виде:
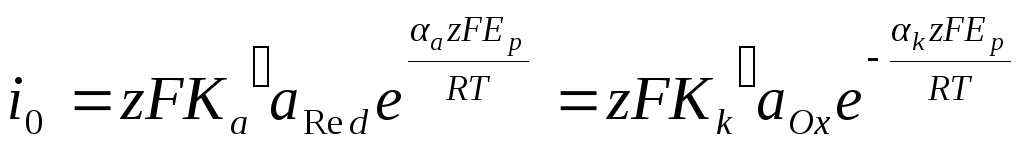
Подставляя в последнее уравнение выражение для равновесного потенциала, получим:


Величины
![]() =
=
![]() называются
константами
скоростей
анодного и катодного процессов при
стандартном потенциале
и
не зависят от активностей окисленной
и восстановленной форм.
Окончательно эти уравнения могут быть
представлены в общем
виде:
называются
константами
скоростей
анодного и катодного процессов при
стандартном потенциале
и
не зависят от активностей окисленной
и восстановленной форм.
Окончательно эти уравнения могут быть
представлены в общем
виде:
![]()
Уравнение дает связь между плотностью тока обмена при равновесном потенциале и стандартной константой скорости реакции. Сравнивая последнее уравнение с выражением для стандартной плотности тока обмена, получим:
![]()
Как видно из двух последних уравнений, существует простая зависимость между стандартной плотностью тока обмена и стандартной константой скорости реакции, поэтому, в принципе, скорость процесса может быть охарактеризована любой из этих величин. Однако, судя по единицам, в которых выражены i00 (А∙м/моль) и Ks (м/с), плотность тока обмена имеет более ясный физический смысл, чем константа скорости.
Часто возникает необходимость сравнения значений плотности токов обмена, полученных в эксперименте, с литературными данными. Для этого, воспользовавшись уравнением
![]()
приводят значение плотности тока обмена к стандартной величине i00. Однако этот способ возможен, если известны активности (или концентрации) окисленной и восстановленной форм, т. е. для систем, когда обе формы присутствуют в растворе, или для амальгамных электродов, когда восстановленная форма находится в амальгаме, а окисленная — в растворе.
Сравнение плотностей тока обмена, полученных на твердых электродах (восстановленная форма — металл) проводят при единичной активности окисленной формы, поскольку активность твердой фазы равна единице.
8.2.4. Способы определения коэффициентов переноса из поляризационных кривых
Для простых электродных реакций типа
Ох + ze = Red
коэффициенты переноса могут быть определены различными способами. Наибольшее распространение получил способ их определения по наклону тафелевских участков (линейных в полулогарифмических координатах) поляризационных кривых *.
Однако в тех случаях, когда полные поляризационные кривые не могут быть получены, коэффициенты переноса определяют из зависимости плотности тока обмена от активности или от равновесного потенциала. Логарифмируя уравнение
![]()
получим
![]()
отсюда
![]()
и
![]()
* Способ рассмотрен в разд. 8.2.1.
Из выражения для
равновесного потенциала
![]() следует:
следует:
![]() и
и
![]()
Подставляя последнее уравнение в предыдущее, получим:
![]() и
и
![]()
Аналогично рассчитывают коэффициенты переноса из выражения, связывающего плотность тока обмена со стандартной константой скорости. После логарифмирования этого выражения получим:
![]()
и
![]()
![]()
Таким образом,
зависимость логарифма плотности тока
обмена от активности окисленной или
восстановленной формы соответственно
при
![]() и
и
![]() представляя прямую линию с наклоном .
представляя прямую линию с наклоном .
Для определения к
следует получить серию
![]() из пересечения поляризационных кривых
при
из пересечения поляризационных кривых
при
![]() и переменной
и переменной
![]() ,
а для определения а
– из пересечения поляризационных кривых
при
,
а для определения а
– из пересечения поляризационных кривых
при
![]() и переменной
и переменной
![]() .
.
Изменение активности окисленной или восстановленной формы изменяет и значение равновесного потенциала, поэтому на основе зависимости плотности тока обмена от равновесного потенциала, также можно определить коэффициенты переноса. Из уравнения, связывающего плотность тока обмена с равновесным потенциалом, следует, что
![]()
или
![]()
Этот способ определения коэффициентов переноса удобен тем, что позволяет обходиться без измерения концентрации электролита.
