
- •Оглавление
- •2 Электрохимические системы
- •2.1. Определение электрохимической системы
- •2.2. Прохождение электрического тока в электрохимической системе. Законы фарадея
- •2.3. Термодинамически обратимые и необратимые электрохимические системы
- •2.4. Классификация термодинамически обратимых электрохимических систем
- •2.5. Составляющие электрохимической системы
- •2.6. Идеальные и реальные электрохимические системы
- •3 Метод активности
- •3.1. Формальный метод активности льюиса
- •3.2. Расчет коэффициента активности по дебдш и хюккелю
- •3.3. Расчет коэффициента активности по робинсону и стоксу
- •3.4. Эмпирические способы расчета коэффициентов активности
- •4 Ионные равновесии
- •4.1. Ионные равновесия в растворах электролитов
- •4.2. Сольволиз и буферные свойства
- •4.3. Константы образования комплексных ионов
- •4.4. Ступенчатая диссоциация электролитов
- •4.5. Ионные равновесия в растворах электролитов в присутствии твердой фазы
- •5 Процессы переноса в электрохимических системах
- •5.1. Электрическая проводимость
- •5.1.1. Электронная проводимость
- •Ионная проводимость
- •Электрическая проводимость газов
- •5.1.2.2. Электрическая проводимость твердых тел
- •5.1.2.3. Электрическая проводимость расплавленных соединений
- •5.1.2.4. Электрическая проводимость растворов
- •5.1.3. Теории электрической проводимости растворов
- •5.1.3.1. Простая гидродинамическая теория
- •5.1.3.2. Теория дебая – хюккеля – онзагера
- •5.1.3.3. Теория эйринга
- •5.1.3.4. Протолитическая теория электролитической проводимости
- •5.1.3.5. Применение средней ионной активности для расчета проводимости
- •5.2. Диффузия в растворах электролитов
- •5.3. Диффузионный, или жидкостный, потенциал
- •5.4. Конвективный перенос в растворах
- •5.5. Термодиффузия
- •6. Напряжение электрохимических систем
- •6.1. Возникновение напряжения в электрохимической системе
- •6.2. Равновесные потенциалы на границах раздела фаз
- •6.3. Уравнения равновесного электродного потенциала
- •6.4. Влияние температуры на электродный потенциал
- •6.5. Выбор относительной шкалы потенциалов
- •6.6. Электроды сравнения
- •6.7. Правило лютера
- •6.8. Термодинамическое равновесие с растворителем
- •6.9. Расчет напряжения электрохимических систем с помощью потенциалов в относительной шкале
- •6.9.1. Напряжение электрохимических систем с химической реакцией
- •Напряжение электрохимических систем без химической реакции
- •Напряжение электрохимических систем без химической реакции
- •6.10. Методы устранения диффузионного потенциала
- •4,2 Кмоль/м3 20,4 кмоль/м3
- •6.11. Термодинамика электрохимических систем
- •6.12. Ионоселективные электроду
- •6.12.1. Уравнение мембранного потенциала
- •6.12.2. Электроды с твердыми ионитовыми мембранами
- •6.12.3. Электроды с жидкими ионитовыми memбpahaми
- •6.12.4. Измерение напряжения электрохимических систем с ионоселективными электродами
- •7 Двой ной электрический слой
- •Явления адсорбции при образовании двойного электрического слоя
- •Злектрокапиллярные явления на ртути и твердых металлах
- •7.3. Емкость двойного электрического слоя
- •7.3.1. Влияние специфической адсорбции ионов на поверхностное натяжение и емкость двойного электрического слоя
- •7.3.2. Заряжение емкости двойного электрического слоя
- •7.4. Теории строения двойного электрического слоя
- •7.5. Двойной слой на твердых электродах
- •7.6. Двойной слой на электродах в расплавленных и твердых электролитах
- •%(%8 Кинетика электродных процессов
- •8.1. Поляризационные кривые
- •8.2. Перенапряжение электрохимической стадии
- •8.2.1. Уравнение поляризационной кривой без учета специфической адсорбции и ψ’-потенциала
- •Влияние ψ’-потенциала на скорость реакции разряда — ионизации
- •8.2.3. Стандартная константа скорости реакции переноса электрона и стандартная плотность тока обмена
- •8.2.4. Способы определения коэффициентов переноса из поляризационных кривых
- •8.3. Стадийные электродные реакции
- •8.4. Электрохимические реакции, включающие быстрые химические стадии
- •8.5. Определение порядков электрохимических реакций
- •8.6. Безбарьерные и безактивациониые электрохимические реакции
- •8.7. Кинетика реакций при конечных степенях заполнения поверхности
- •9 Диффузионная кинетика
- •9.1. Перенапряжение диффузии
- •9.2. Перенапряжение диффузии с учетом миграции
- •9.3. Поляризационные кривые при замедленной стадии диффузии
- •9.4. Окислительно-восстановительные реакции
- •9.5. Сложные окислительно-восстановительные реакции
- •9.6. Наложение перенапряжения диффузии и замедленного переноса электронов (смешанная кинетика)
- •10 Перенапряжение химической реакции
- •10.1. Перенапряжение, обусловленное предшествующей гомогенной химической реакцией в катодном процессе и последующей химической реакцией в анодном процессе
- •10.2. Общий случай электрохимической реакции с замедленной гомогенной химической стадией
- •10.3. Перенапряжение, обусловленное гетерогенными химическими стадиями
- •10.4. Зависимость плотности тока от концентрации и порядок химической реакции
- •11 Примеры различных механизмов электрохимических реакций
- •11.1. Реакция выделения водорода
- •11.2. Кинетика реакций в расплавах и твердых электролитах
- •12 Кинетика реакций электрохимического выделения металлов
- •12.1. Кинетика реакций выделения металлов на жидких катодах
- •12.2. Кинетика реакций при электроосаждении металлов на твердых электродах
- •12.3. Влияние поверхностно-активных веществ на рост кристаллов
- •12.4. Влияние природы металла и состава раствора на кинетические параметры
- •12.5. Электроосаждение металлов из расплавов
- •12.6. Электрохимическое восстановление оксидов
- •13 Анодное растворение и пассивность металлов
- •13.1. Анодное растворение металлов
- •13.2. Пассивность металлов
- •13.2.1. Теория пассивности
- •13.2.2. Кинетика процесса пассивирования
- •14 Короткозамкнутые электрохимические системы
- •14.1. Общие положения
- •14.2. Электрохимическая коррозия
- •14.2.1. Скорость коррозии металла и коррозионный потенциал
- •14.2.2. Растворение металлов под током в коррозйонноактивных средах
- •14.2.3. Коррозия технических металлов
- •14.2.4. Способы снижения скорости коррозионного процесса
- •14.3. Контактное вытеснение металлов (цементация)
- •14.3.1. Общие положения
- •14.3.2. Кинетика процесса цементации
- •14.3.3. Конечный период цементации
- •15 Параллельные электрохимические реакции
- •15.1. Условия протеканий параллельных реакций
- •15.2. Распределение плотности тока между параллельными реакциями
- •16 Основы методов исследования электрохимических реакций
- •16.1. Общие требования к методам исследования
- •16.2. Электроды, применяемые в кинетических исследованиях
- •16.3. Измерение потенциалов под током
- •16.4. Методы исследования
- •Литература
7.3.2. Заряжение емкости двойного электрического слоя
Изменение размера поверхности электрода при постоянном потенциале связано с перетеканием зарядов через границу раздела фаз, что вызывает появление емкостных токов. Емкостные токи
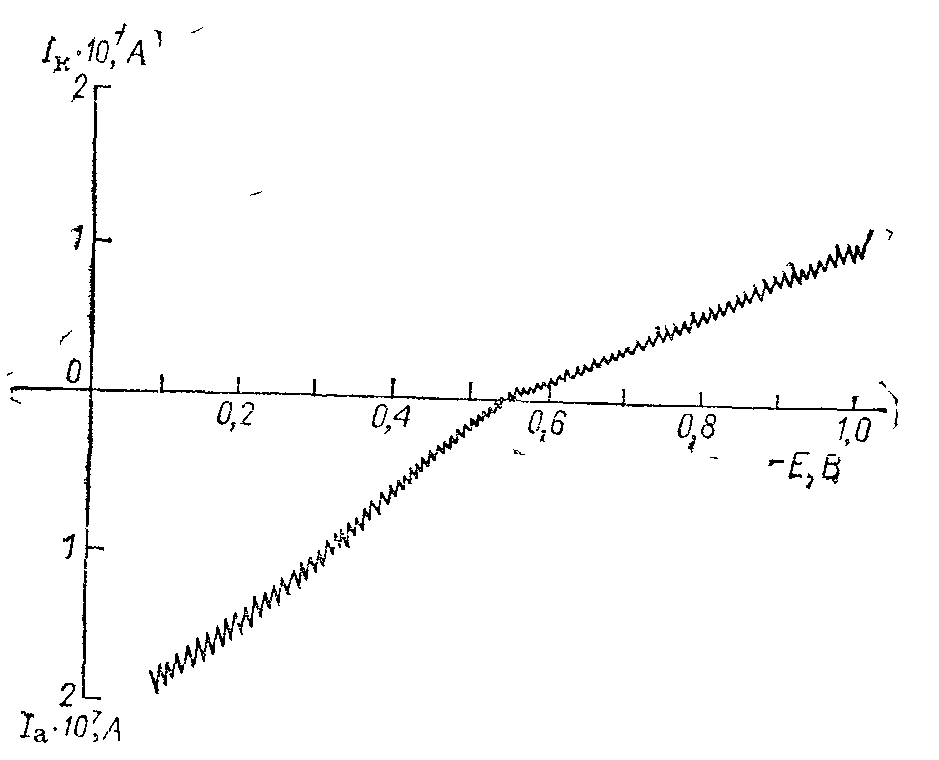
Рис. 7.12. Зависимость тока заряжения (емкостного тока) от потенциала ртутного капельного электрода.
Ia, Ik – анодный и катодный ток.
возникают в результате заряжения двойного слоя; наиболее хорошо они обнаруживаются на ртутном капельном электроде. Например, если поддерживать постоянным потенциал ртутного капельного электрода в области идеальной поляризуемости, то через электрод протекает ток, связанный с заряжением емкости.
Значение емкостного тока зависит от скорости образования поверхности и величины емкости двойного слоя. Таким образом, его можно определить при любом значении потенциала с помощью ртутного капельного электрода. На рис. 7.12 изображена поляро-грамма, полученная в области идеальной поляризуемости ртутного электрода вблизи потенциала нулевого заряда, из которой следует, что значение тока при Е = Ен. з и q = 0 равно нулю. Более сильное возрастание тока при положительных зарядах поверхности (q > 0) связано с большей емкостью двойного слоя в области адсорбции анионов (примерно 0,36 – 0,4 Ф/м2), чем в области адсорбции катионов (0,18 – 0,2 Ф/м2), когда поверхность заряжена отрицательно.
Изменение потенциала электрода, даже если его поверхность постоянна, также вызывает протекание емкостных токов, поскольку для достижения определенного значения потенциала необходимо зарядить емкость двойного слоя.
Задавая на электрод (обычно металлы платиновой группы и их сплавы) линейно изменяющееся или пилообразное напряжение со скоростью развертки в пределах 1 – 50 В/с и регистрируя зависимость тока от потенциала электрода, получают потенциодина-мические кривые, из которых определяют характеристики двойного слоя. В общем случае протекающий через электрод ток затрачивается на заряжение емкости двойного электрического слоя (ток заряжения или емкостной ток) и на протекание электрохимической реакции (фарадеевский ток). В случае последовательно соединенных сопротивления и емкости закон Ома записываем в виде
![]()
откуда
![]()
Здесь R — омическое сопротивление раствора. Если сопротивление раствора незначительно, то
![]()
Так как скорость развертки потенциала задана условиями опыта, а значение тока измеряется, то емкость легко рассчитать из выражения:
![]()
Когда значение фарадеевского тока ниже тока заряжения, определенная по этой формуле емкость является емкостью двойного электрического слоя. В условиях протекания существенного фарадеевского тока определяется общая поляризационная емкость Сп, представляющая сумму емкостей двойного электрического слоя и емкости электрохимической реакции. Для металлов платиновой группы:
![]()
Интегрированием этого уравнения при dE/dt = const получают зависимость между потенциалом и количеством прошедшего электричества Q, т. е. кривую заряжения (см. ниже):
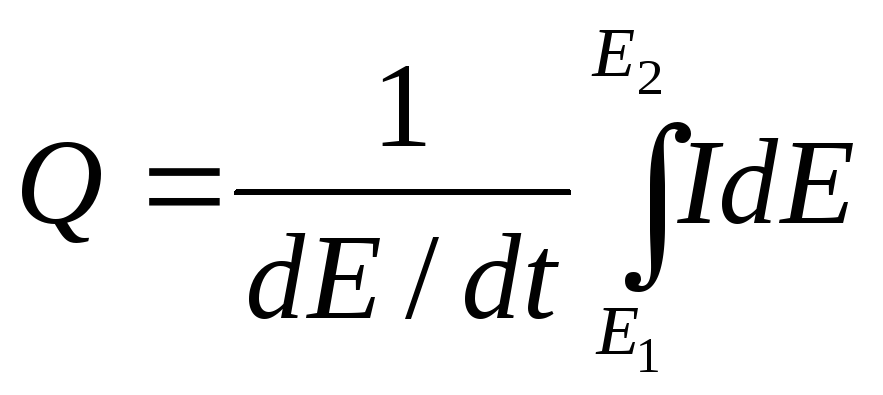
На рис. 7.13 изображена потенциодинамическая кривая на платиновом электроде в растворе серной кислоты. Два максимума 1 и 2 соответствуют двум формам адсорбированного водорода — так называемого прочно- и слабосвязанного водорода. Точное совпаде-ние максимумов при прямой и обратной развертке напряжения свидетельствует об обратимости процесса адсорбции водорода. В средней части кривой значения тока низки и характеризуют двойнослойную область. Слабовыраженный пик 3 при положительных потенциалах связан с адсорбцией кислорода, ему соответствует катодный максимум восстановления 4, сильно смещенный в отрицательную сторону из-за необратимости процесса посадки — снятия кислорода.
Заряжение емкости двойного электрического слоя можно наблюдать и на некоторых металлах (например, подгруппы платины и железа), если на электрод задать постоянный ток и
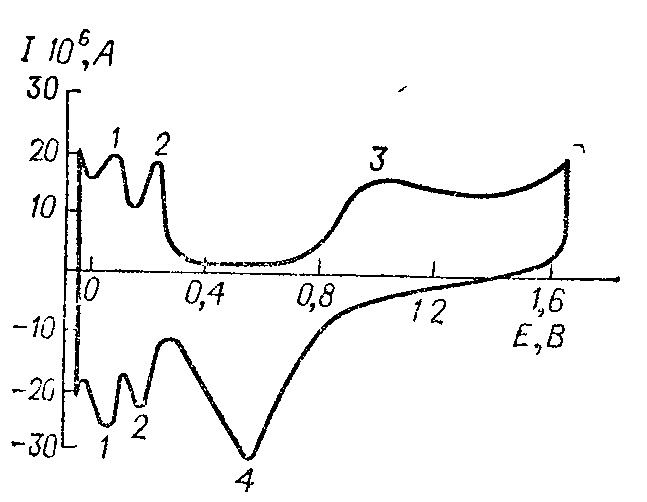
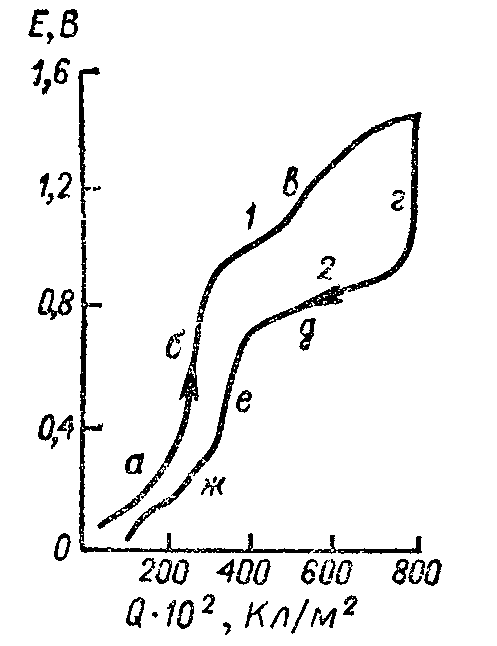
Рис. 7.13. Зависимость тока от потенциала на платиновом электроде в растворе H2SO4 концентрации 0,5 кмоль/м3.
Поверхность электрода 1,25∙10–3 см2. Скорость развертки w = 30 В/с. E — потенциал электрода относительно потенциала равновесного водородного электрода в том же растворе при Р = 1 атм (0,1 МПа).
Рис. 7. 14. Анодная (1) и катодная (2) кривые заряжения на платиновом электроде в растворе Н2SO4 концентрации 0,5 кмоль/м3.
Области: a — ионизации водорода; б, е — двойнослойная; в — адсорбции кислорода; г — резкого спада кривой; д — удаления адсорбированного кислорода; ж — осаждения водорода.
Е
—
потенциал электрода относительно
потенциала равновесного водородного
электрода в
том же растворе при
![]() =1
атм (0,1 МПа).
=1
атм (0,1 МПа).
регистрировать зависимость потенциала от времени или количества электричества. Такие зависимости называются кривыми заряжения.
Предположим, что в кислый раствор опущен платиновый электрод с достаточно развитой поверхностью. Если через раствор пропускать водород при определенном давлении, то на электроде сравнительно быстро установится равновесие
H2 + 2H2O = 2Hадс + 2Н2О = 2Н3О+ + 2е
при котором концентрация адсорбированного водорода Н (адс.) будет постоянной, а потенциал электрода будет соответствовать уравнению Нернста. Если теперь удалить из раствора молекулярный водород, например продувкой инертным газом, то адсорбированный водород останется на поверхности из-за высокой энергии адсорбции на платине, а равновесный потенциал электрода сдвинется в положительную сторону вследствие снижения парциального давления водорода. При подаче на электрод постоянного анодного тока адсорбированный водород будет ионизироваться и переходить в раствор в виде ионов Н3О+. После ионизации всего водорода произойдет заряжение емкости двойного слоя, а затем адсорбция на поверхности платины кислорода.
Зависимость потенциала электрода от количества электричества получается в виде кривой, которая называется анодной кривой заряжения (рис. 7.14, кривая 1). Из рисунка видно, что на зависимости Е — Q можно выделить три области, соответствующие ионизации водорода (а), заряжению емкости двойного слоя (б) и адсорбции кислорода (в). Строго говоря, процесс заряжения емкости двойного слоя протекает на всех участках кривой заряжения, однако доля электричества, расходуемого на него при ионизации Надс и адсорбции кислорода, мала. С другой стороны, в области заряжения двойного слоя могут частично протекать и процесс ионизации водорода, и адсорбция кислорода. Из кривой-заряжения может быть рассчитана емкость:
С = ΔQ/ΔE
Экспериментально получено, что в области ионизации водорода С ≈ 7 Ф/м2, а в двойнослойной области С ≈0,4 ÷ 0,7 Ф/м2. Последнее значение достаточно хорошо соответствует емкости двойного электрического слоя в присутствии адсорбированных анионов. Кислород на платине адсорбируется после электрохимического окисления молекул воды по схеме:
3Н2O – 2е = Оадс + 2Н3О+
Эта реакция является необратимой, и восстановление адсорбированного кислорода происходит при более отрицательных потенциалах. Поэтому, если на поверхности адсорбировать кислород, а затем электрод поляризовать катодным током (катодная кривая заряжения, кривая 2 на рис. 7.14), то сначала потенциал резко сдвинется в отрицательную сторону (г), а затем электричество начнет расходоваться на реакцию удаления адсорбированного кислорода (д). Далее следует двойнослойная область (е) и область осаждения водорода (ж).
Реакция ионизации и образования адсорбированного водорода является обратимой, и гистерезис кривой заряжения не наблюдается, если не заходить в область адсорбции, кислорода. В области адсорбции водорода (а и ж) на кривых, заряжения имеется перегиб, который указывает на существование двух форм адсорбированного водорода.
Кривые заряжения могут быть получены также методом быстрого заряжения, когда на электрод подается большая плотность тока, а зависимость потенциал — время регистрируется осциллографом. За малое время снятия кривой растворенный молекулярный водород не успевает продиффундировать к поверхности электрода и, таким образом, не вызывает роста тока ионизации. Предотвращения влияния молекулярного водорода можно добиться; используя электроды со сравнительно малой истинной поверхностью в контакте с очень малым объемом раствора, в котором общее количество растворенного водорода столь незначительно, что существенно не сказывается на результатах измерений.
Сопоставление
количества электричества, затраченного
на ионизацию
водорода, с размером истинной поверхности
платины показало,
что на одном поверхностном атоме платины
при
![]()
= 1,013∙105 Па адсорбирован один атом водорода. Так как количество электричества, затрачиваемое на адсорбцию кислорода, в два раза больше, а по уравнению реакции на образование атома кислорода используется два электрона, то можно прийти к выводу, что на каждом поверхностном атоме платины в конце кривой заряжения адсорбирован один атом кислорода.
При адсорбции поверхностно-активных ионов работа иониза- ции водорода снижается, так как уменьшается прочность связи водорода с платиной. Снижение наклона кривых заряжения при переходе от SO42– к Сl– и Вr– вызвано увеличением адсорбции галогенидов и соответствующим повышением емкости. В растворах, содержащих галоген-ионы, полные кривые заряжения получены быть не могут вследствие окисления анионов или их кислородсодержащих соединений.
Метод кривых заряжения применяют также при исследовании адсорбции органических соединений на электродах. В этом случае наиболее целесообразно использовать метод быстрого заряжения и по количеству электричества, пошедшего на восстановление или окисление вещества, определять его адсорбцию.
