
- •Оглавление
- •2 Электрохимические системы
- •2.1. Определение электрохимической системы
- •2.2. Прохождение электрического тока в электрохимической системе. Законы фарадея
- •2.3. Термодинамически обратимые и необратимые электрохимические системы
- •2.4. Классификация термодинамически обратимых электрохимических систем
- •2.5. Составляющие электрохимической системы
- •2.6. Идеальные и реальные электрохимические системы
- •3 Метод активности
- •3.1. Формальный метод активности льюиса
- •3.2. Расчет коэффициента активности по дебдш и хюккелю
- •3.3. Расчет коэффициента активности по робинсону и стоксу
- •3.4. Эмпирические способы расчета коэффициентов активности
- •4 Ионные равновесии
- •4.1. Ионные равновесия в растворах электролитов
- •4.2. Сольволиз и буферные свойства
- •4.3. Константы образования комплексных ионов
- •4.4. Ступенчатая диссоциация электролитов
- •4.5. Ионные равновесия в растворах электролитов в присутствии твердой фазы
- •5 Процессы переноса в электрохимических системах
- •5.1. Электрическая проводимость
- •5.1.1. Электронная проводимость
- •Ионная проводимость
- •Электрическая проводимость газов
- •5.1.2.2. Электрическая проводимость твердых тел
- •5.1.2.3. Электрическая проводимость расплавленных соединений
- •5.1.2.4. Электрическая проводимость растворов
- •5.1.3. Теории электрической проводимости растворов
- •5.1.3.1. Простая гидродинамическая теория
- •5.1.3.2. Теория дебая – хюккеля – онзагера
- •5.1.3.3. Теория эйринга
- •5.1.3.4. Протолитическая теория электролитической проводимости
- •5.1.3.5. Применение средней ионной активности для расчета проводимости
- •5.2. Диффузия в растворах электролитов
- •5.3. Диффузионный, или жидкостный, потенциал
- •5.4. Конвективный перенос в растворах
- •5.5. Термодиффузия
- •6. Напряжение электрохимических систем
- •6.1. Возникновение напряжения в электрохимической системе
- •6.2. Равновесные потенциалы на границах раздела фаз
- •6.3. Уравнения равновесного электродного потенциала
- •6.4. Влияние температуры на электродный потенциал
- •6.5. Выбор относительной шкалы потенциалов
- •6.6. Электроды сравнения
- •6.7. Правило лютера
- •6.8. Термодинамическое равновесие с растворителем
- •6.9. Расчет напряжения электрохимических систем с помощью потенциалов в относительной шкале
- •6.9.1. Напряжение электрохимических систем с химической реакцией
- •Напряжение электрохимических систем без химической реакции
- •Напряжение электрохимических систем без химической реакции
- •6.10. Методы устранения диффузионного потенциала
- •4,2 Кмоль/м3 20,4 кмоль/м3
- •6.11. Термодинамика электрохимических систем
- •6.12. Ионоселективные электроду
- •6.12.1. Уравнение мембранного потенциала
- •6.12.2. Электроды с твердыми ионитовыми мембранами
- •6.12.3. Электроды с жидкими ионитовыми memбpahaми
- •6.12.4. Измерение напряжения электрохимических систем с ионоселективными электродами
- •7 Двой ной электрический слой
- •Явления адсорбции при образовании двойного электрического слоя
- •Злектрокапиллярные явления на ртути и твердых металлах
- •7.3. Емкость двойного электрического слоя
- •7.3.1. Влияние специфической адсорбции ионов на поверхностное натяжение и емкость двойного электрического слоя
- •7.3.2. Заряжение емкости двойного электрического слоя
- •7.4. Теории строения двойного электрического слоя
- •7.5. Двойной слой на твердых электродах
- •7.6. Двойной слой на электродах в расплавленных и твердых электролитах
- •%(%8 Кинетика электродных процессов
- •8.1. Поляризационные кривые
- •8.2. Перенапряжение электрохимической стадии
- •8.2.1. Уравнение поляризационной кривой без учета специфической адсорбции и ψ’-потенциала
- •Влияние ψ’-потенциала на скорость реакции разряда — ионизации
- •8.2.3. Стандартная константа скорости реакции переноса электрона и стандартная плотность тока обмена
- •8.2.4. Способы определения коэффициентов переноса из поляризационных кривых
- •8.3. Стадийные электродные реакции
- •8.4. Электрохимические реакции, включающие быстрые химические стадии
- •8.5. Определение порядков электрохимических реакций
- •8.6. Безбарьерные и безактивациониые электрохимические реакции
- •8.7. Кинетика реакций при конечных степенях заполнения поверхности
- •9 Диффузионная кинетика
- •9.1. Перенапряжение диффузии
- •9.2. Перенапряжение диффузии с учетом миграции
- •9.3. Поляризационные кривые при замедленной стадии диффузии
- •9.4. Окислительно-восстановительные реакции
- •9.5. Сложные окислительно-восстановительные реакции
- •9.6. Наложение перенапряжения диффузии и замедленного переноса электронов (смешанная кинетика)
- •10 Перенапряжение химической реакции
- •10.1. Перенапряжение, обусловленное предшествующей гомогенной химической реакцией в катодном процессе и последующей химической реакцией в анодном процессе
- •10.2. Общий случай электрохимической реакции с замедленной гомогенной химической стадией
- •10.3. Перенапряжение, обусловленное гетерогенными химическими стадиями
- •10.4. Зависимость плотности тока от концентрации и порядок химической реакции
- •11 Примеры различных механизмов электрохимических реакций
- •11.1. Реакция выделения водорода
- •11.2. Кинетика реакций в расплавах и твердых электролитах
- •12 Кинетика реакций электрохимического выделения металлов
- •12.1. Кинетика реакций выделения металлов на жидких катодах
- •12.2. Кинетика реакций при электроосаждении металлов на твердых электродах
- •12.3. Влияние поверхностно-активных веществ на рост кристаллов
- •12.4. Влияние природы металла и состава раствора на кинетические параметры
- •12.5. Электроосаждение металлов из расплавов
- •12.6. Электрохимическое восстановление оксидов
- •13 Анодное растворение и пассивность металлов
- •13.1. Анодное растворение металлов
- •13.2. Пассивность металлов
- •13.2.1. Теория пассивности
- •13.2.2. Кинетика процесса пассивирования
- •14 Короткозамкнутые электрохимические системы
- •14.1. Общие положения
- •14.2. Электрохимическая коррозия
- •14.2.1. Скорость коррозии металла и коррозионный потенциал
- •14.2.2. Растворение металлов под током в коррозйонноактивных средах
- •14.2.3. Коррозия технических металлов
- •14.2.4. Способы снижения скорости коррозионного процесса
- •14.3. Контактное вытеснение металлов (цементация)
- •14.3.1. Общие положения
- •14.3.2. Кинетика процесса цементации
- •14.3.3. Конечный период цементации
- •15 Параллельные электрохимические реакции
- •15.1. Условия протеканий параллельных реакций
- •15.2. Распределение плотности тока между параллельными реакциями
- •16 Основы методов исследования электрохимических реакций
- •16.1. Общие требования к методам исследования
- •16.2. Электроды, применяемые в кинетических исследованиях
- •16.3. Измерение потенциалов под током
- •16.4. Методы исследования
- •Литература
6.12.2. Электроды с твердыми ионитовыми мембранами
Наиболее распространенным ионоселективным электродом с твердой мембраной является стеклянный электрод. В зависимости от состава стеклянной мембраны стеклянные электроды избирательно реагируют на ионы водорода или ионы щелочных металлов.
Стеклянный электрод, селективно реагирующий на ионы водорода, впервые предложили Ф. Габер и 3. Клеменсиевич.
Для изготовления стеклянного электрода в качестве мембраны, селективной к ионам водорода или, как говорят, обладающей во- дородной функцией, используют тонкую (толщиной 10–5 – 10–6 м) пленку определенного сорта стекла. Одним из лучших стекол для приготовления стеклянных электродов с водородной функцией является стекло «Корнинг 015» [состав, % (мол.): SiO2 – 72,2; СаО – 6,4; Na2O – 21,4]. Оно имеет низкую температуру плавления, высокую гигроскопичность и довольно высокую электрическую проводимость. Разработаны также другие сорта стекол с водородной функцией, содержащие оксиды лития, бария, цезия или лантана.
Конструкции стеклянных электродов могут быть различны. Основой электрода является стеклянная трубка, на конец которой напаяна тонкая пленка (рис. 6.15, а, б) или тонкостенный шарик (рис. 6.15, в) из стекла с водородной функцией. Трубка заполнена стандартным раствором с определенным значением рН (ацетатный буферный раствор или соляная кислота); в этот раствор помещен электрод, обладающий равновесным потенциалом. В большинстве случаев в качестве такого внутреннего электрода используют хлорсеребряный или каломельный электроды.
С
 хематично
стеклянный электрод можно записать
следующим образом:
хематично
стеклянный электрод можно записать
следующим образом:
Внутренний Внутренний Стекло Внешний
электрод раствор раствор
-
2

φ1 φ2 φ3

Стеклянный электрод
Если стеклянный электрод опущен в кислый, нейтральный или слабощелочной раствор, то на границах раздела стекло — раствор происходит реакция обмена ионами водорода между двумя фазами — раствором и стеклом, т. е. протекает реакция
Н3O+ (р1) = Н3O+ (ст.) Н3O+ (p2) = Н3O+ (ст.)
и тогда потенциал стеклянного электрода, согласно уравнению для мембранного потенциала, будет равен:

Так
как активность ионов гидроксония во
внутреннем растворе (![]() )
постоянна, то значение потенциала будет
зависеть только от
активности ионов водорода во внешнем
растворе (
)
постоянна, то значение потенциала будет
зависеть только от
активности ионов водорода во внешнем
растворе (![]() ).
).
Однако в сильнокислых исильнощелочных средах наблюдаются отклонения от водороднойфункции (значение, при котором наступает отклонение, зависит отсостава стекла). В сильнокислыхсредах их можно объяснить проявлением анионной функции(Н. А. Измайлов и А. М. Александрова), в сильнощелочных—Iпроявлением металлической функции (Na+, K+, Ag+ и т. д.). В связи с этим полная теория стеклянного электрода должна объяснять не только появление водородной функции, но и отклонение от нее при низких и высоких Изначениях рН раствором. Теорию, количественно учитывающую отклоненио от водородном функции при высоких pН, разработал Б. П. Никольский. I
Согласно этой теории решающим фактором и установлении скачка потенциала является не диффузия ионов через пленку стекла, а ионообменный процесс между ионами гидроксония раствора и ионами металла в поверхностном слое стекла:
Н30+ (р.) + М+ (ст.) = Н30+ (ст.) + М+ (р.)
Условие равновесия этой реакции выражается законом действующих масс

где
Kобм
— константа обмена;
![]() —
активности
ионов водорода и металла в растворе и
стекле.
—
активности
ионов водорода и металла в растворе и
стекле.
Это равновесие устанавливается на обеих сторонах стеклянной мембраны, причем в обмене участвуют сравнительно небольшие по толщине поверхностные слои стекла. Так как с внутренней стороны активность раствора в процессе измерения остается постоянной, то, следовательно, и скачок потенциала на границе стекло — внутренний раствор есть величина постоянная. Поэтому для вывода уравнения стеклянного электрода достаточно рассмотреть процессы, происходящие на границе раздела стекло — внешний раствор. Для этой границы скачок потенциала 3 будет равен:

Далее в теории Б.П. Никольского принято, что:
1. Активности ионов Н3O+ и М+ в стеклянной фазе прямо пропорциональны их мольным долям, т. е.
![]() ;
;
![]()
Возможность замены активностей мольными долями при малых концентрациях непосредственно следует из теории Льюиса (см. разд. 3.1). Для константы обмена можно, следовательно, записать:

-
Суммарная концентрация ионов Н3O+ и М+ в стекле постоянна и равна концентрации фиксированных в нем ионов (N0):
![]()
Это
допущение непосредственно следует из
основной предпосылки теории о решающей
роли ионообменной реакции. Тогда
концентрацию
![]() можно выразить через активности ионов
в растворе и постоянные: константу
обмена и концентрацию фиксированных в
стекле ионов
можно выразить через активности ионов
в растворе и постоянные: константу
обмена и концентрацию фиксированных в
стекле ионов

Подставим
значение
![]() в уравнение для скачка потенциала
в уравнение для скачка потенциала
![]()
где
![]()
Это
уравнение показывает, что если в растворе
![]() ,
то
,
то
![]()
т.
е. электрод обладает водородной функцией.
Если же электрод находится в растворе,
в котором
![]() ,
то
,
то
![]()
т.
е. электрод обладает металлической
функцией. В области рН, в которой
![]() соизмерима с
соизмерима с
![]() ,
при
увеличении рН происходит изменение
производной ∂φ3/∂рН
от 0,059 (для комнатной температуры) до
нуля. Константа обмена для разных сортов
стекол колеблется от 10–10
до 10–15.
,
при
увеличении рН происходит изменение
производной ∂φ3/∂рН
от 0,059 (для комнатной температуры) до
нуля. Константа обмена для разных сортов
стекол колеблется от 10–10
до 10–15.
В стеклянных мембранах практически не возникает градиента потенциала в толще мембраны и значение диффузионного потенциала не входит в уравнение стеклянного электрода.

Рис. 6.16. Конструкция электрода с твердой мембраной:
1 — стенки сосуда; 2 — токоотвод; 3 — мембрана; 4 — прокладка.
К электродам с твердыми мембранами относятся также ионоселективные электроды, в которых в качестве мембран используют монокристаллы, а также тонкодиспергированные вещества с заданными свойствами. Рассмотрим сначала электроды, в которых мембраны представляют тонкие пластины кристаллических соединений. Для приготовления мембран чаще используют галогениды и сульфиды ряда металлов (AgCl, AgBr, AgI, PbS, CuS, Ag2S и т. д.), которые уже при комнатной температуре обладают ионной проводимостью и в которых, как правило, в процессе переноса заряда участвует только один из ионов кристаллической решетки (униполярная проводимость). Мембраны из кристаллического соединения должны быть механически прочными, химически устойчивыми в измеряемом растворе и малорастворимыми. Основные виды электродов с гомогенными твердыми мембранами для определения как анионов, так и катионов приведены в табл. 6.5. Одна из конструкций электрода с твердой мембраной приведена на рис. 6.16.
На границе раздела мембрана из сульфида серебра — раствор, содержащий ионы серебра, перенос заряда осуществляется в основном ионами серебра, поэтому при погружении мембраны из сульфида серебра в раствор с некоторой концентрацией ионов серебра начнется переход номов серебра из мембраны в раствор и на поверхности мембраны появится избыток отрицательных зарядов. Это приведет к образованию двойного электрического слоя и возникновению скачка потенциала. В момент равновесия скорость перехода ионов серебра из мембраны в раствор будет равна скорости перехода ионов серебра из раствора в мембрану, т. е. на границе раздела установится подвижное равновесие. Следовательно, учитывая, что переносится единичный положительный заряд, можно
Таблица 6.5. Электроды с твердыми мембранами
|
Опре-деляе-мый ион |
Состав мембраны |
Основ-ные мешаю-щие ионы |
Опре-деляе-мый ион |
Состав мембраны |
Основ-ные мешаю-щие ионы |
|
F–; La3+ Cl–
Br–
I– SCN– |
LaF3 AgCl –Ag2S
AgBr –Ag2S
AgI –Ag2S AgSCN –Ag2S |
OH– Br–; I–; S2–; NH3; CN– I–; S2– NH3; CN– S2–; CN– Br–; I–; S2–; NH3; CN– |
S2–; Ag+ CN– Cu2+ Pb2+
Cd2+ |
Ag2S AgI –Ag2S CuS –Ag2S PbS –Ag2S
CdS –Ag2S
|
Hg2+ I–; S2– Hg2+; Ag+ Hg2+; Ag+ Cu2+ Hg2+; Ag+ Cu2+ |
записать уравнение для потенциала, возникающего па границе раздела
![]()
Электрод с мембраной из сульфида серебра можно использовать и для измерения активности ионов серы, если в растворе отсутствуют ионы серебра. Действительно, если измеряемый раствор содержит ионы серы и находится в равновесии с осадком Ag2S, т. е, мембраной, то концентрация ионов серебра вблизи поверхности мембраны со стороны раствора определится произведением растворимости Ag2S
![]()
Определив активность ионов серебра из данного соотношения и подставив ее в предыдущее уравнение для потенциала сульфидного электрода, получим
![]()
где
![]()
Следовательно, сульфидный электрод является обратимым как относительно ионов серебра, так и относительно ионов серы.
Приведенное уравнение справедливо в интервале концентраций от насыщенных растворов до растворов с концентрацией ионов серебра и серы порядка 10–8 кмоль/м3. Если сульфид серебра использовать в качестве матричного вещества в смеси с сульфидами некоторых других металлов и из них изготовить мембраны, то такие электроды оказываются селективными к иону металла, введенному со вторым сульфидом. Предположим, что такая мембрана, состоящая из Ag2S и MS, опущена в раствор, в котором не содержится ионов серебра, а имеется некоторая концентрация ионов металла второго сульфида. Так как данная мембрана содержит достаточное количество ионов серебра, то при соприкосновении ее с раствором начнется переход ионов серебра в раствор, причем активность ионов серебра на границе мембрана — раствор будет определяться равновесиями, приводящими к уравнениям:
![]() и
и
![]()
Определяем из этих уравнений активность ионов серебра:
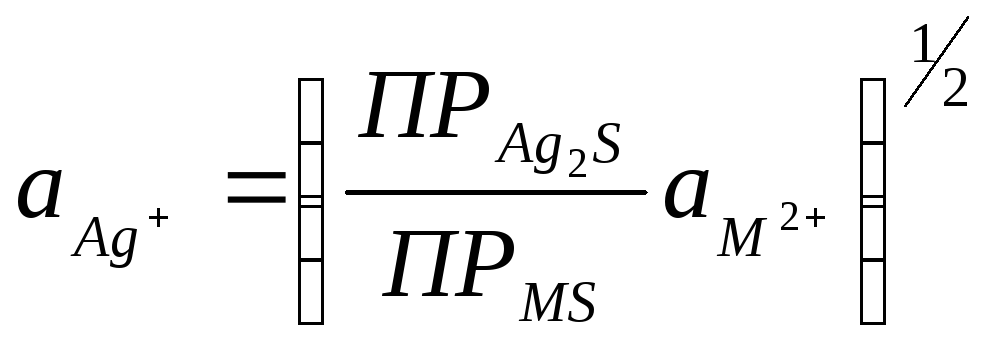
Подставляя
![]() в уравнение для потенциала электрода
с сульфидной мембраной, обладающей
серебряной функцией, получаем:
в уравнение для потенциала электрода
с сульфидной мембраной, обладающей
серебряной функцией, получаем:
![]()
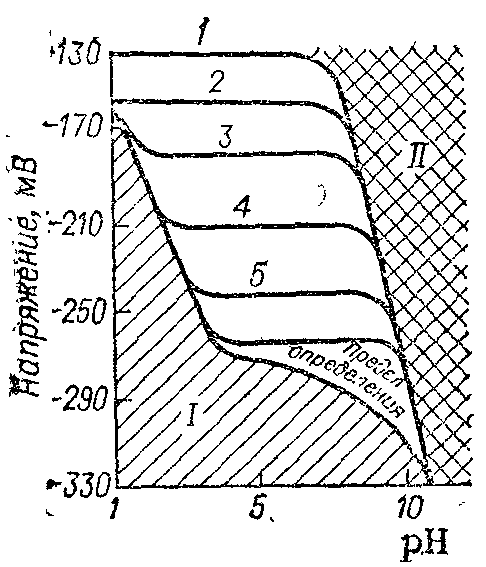
Рис. 6.17. Влияние рН на потенциалы свинцового ионоселективного электрода.
Концентрация Рb2+, кмоль/м3: 1 — 10–1; 2 — 10–2; 3 — 10–3; 4 — 10–4; 5 — 10–5. I и II — области рН, в которых электрод не имеет металлической функции.
или
![]()
Таким образом, в растворах, содержащих ион М2+ и не содержащих ионов серебра, электрод обратим относительно ионов М2+.
Рабочий интервал концентраций, т. е. интервал, в котором применяемый электрод сохраняет теоретическую функцию, зависит от природы сульфидов металлов и среды, в которой проводят измерение. Верхний предел этих концентраций находится в области насыщенных растворов, а нижний предел существенно зависит от рН. В кислых растворах отклонение от теоретической зависимости связано с повышением растворимости сульфидов металлов в результате образования HS– и H2S, а в щелочной среде — в результате возможного образования гидратов или основных солей данных металлов. На рис. 6.17 показаны серии кривых, характеризующие влияние рН на рабочий диапазон мембранного электрода, обратимого относительно ионов свинца.
Мембрану можно изготавливать также в виде тонкодиспергированного вещества со связующим материалом, представляющим инертную матрицу, в которой закреплено активное вещество. Связующий материал должен быть химически инертным и обладать
Таблица 6.6. Электроды с мембраной из тонкодиспергирован-ного вещества
|
Активное вещество |
Состав матрицы мембраны |
Ионы, по отноше-нию к которым обратимы электроды |
Состав измеряемой среды и градиент ионной функции |
|
Оксалат кальция и другие соли кальция Иодид серебра Сульфат бария Фторид кальция Фторид лантана Сульфид серебра |
Парафин + неионные наполнители, ткань
Силиконовый каучук То же » » » |
Ca2+
I– SO42– F– F– Ag+, S2– |
Нитрат кальция
Иодид калия; 56 – 60 мВ/рI Сульфат калия 24 – 30 мВ/рSO4 35 – 50 мВ/рF Раствор KCl + KF в пределах 2 – 4 рF; 53 мВ/рF Раствор Na2S в 0,1 М NaOH; ~ 30 мВ/рS |
хорошей адгезией к частицам. В качестве такого материала используют парафин, поливинилхлорид, полистирол, полиэтилен и силиконовый каучук. Некоторые из электродов, в которых применяют такие мембраны, приведены в табл. 6.6.
