
- •Оглавление
- •2 Электрохимические системы
- •2.1. Определение электрохимической системы
- •2.2. Прохождение электрического тока в электрохимической системе. Законы фарадея
- •2.3. Термодинамически обратимые и необратимые электрохимические системы
- •2.4. Классификация термодинамически обратимых электрохимических систем
- •2.5. Составляющие электрохимической системы
- •2.6. Идеальные и реальные электрохимические системы
- •3 Метод активности
- •3.1. Формальный метод активности льюиса
- •3.2. Расчет коэффициента активности по дебдш и хюккелю
- •3.3. Расчет коэффициента активности по робинсону и стоксу
- •3.4. Эмпирические способы расчета коэффициентов активности
- •4 Ионные равновесии
- •4.1. Ионные равновесия в растворах электролитов
- •4.2. Сольволиз и буферные свойства
- •4.3. Константы образования комплексных ионов
- •4.4. Ступенчатая диссоциация электролитов
- •4.5. Ионные равновесия в растворах электролитов в присутствии твердой фазы
- •5 Процессы переноса в электрохимических системах
- •5.1. Электрическая проводимость
- •5.1.1. Электронная проводимость
- •Ионная проводимость
- •Электрическая проводимость газов
- •5.1.2.2. Электрическая проводимость твердых тел
- •5.1.2.3. Электрическая проводимость расплавленных соединений
- •5.1.2.4. Электрическая проводимость растворов
- •5.1.3. Теории электрической проводимости растворов
- •5.1.3.1. Простая гидродинамическая теория
- •5.1.3.2. Теория дебая – хюккеля – онзагера
- •5.1.3.3. Теория эйринга
- •5.1.3.4. Протолитическая теория электролитической проводимости
- •5.1.3.5. Применение средней ионной активности для расчета проводимости
- •5.2. Диффузия в растворах электролитов
- •5.3. Диффузионный, или жидкостный, потенциал
- •5.4. Конвективный перенос в растворах
- •5.5. Термодиффузия
- •6. Напряжение электрохимических систем
- •6.1. Возникновение напряжения в электрохимической системе
- •6.2. Равновесные потенциалы на границах раздела фаз
- •6.3. Уравнения равновесного электродного потенциала
- •6.4. Влияние температуры на электродный потенциал
- •6.5. Выбор относительной шкалы потенциалов
- •6.6. Электроды сравнения
- •6.7. Правило лютера
- •6.8. Термодинамическое равновесие с растворителем
- •6.9. Расчет напряжения электрохимических систем с помощью потенциалов в относительной шкале
- •6.9.1. Напряжение электрохимических систем с химической реакцией
- •Напряжение электрохимических систем без химической реакции
- •Напряжение электрохимических систем без химической реакции
- •6.10. Методы устранения диффузионного потенциала
- •4,2 Кмоль/м3 20,4 кмоль/м3
- •6.11. Термодинамика электрохимических систем
- •6.12. Ионоселективные электроду
- •6.12.1. Уравнение мембранного потенциала
- •6.12.2. Электроды с твердыми ионитовыми мембранами
- •6.12.3. Электроды с жидкими ионитовыми memбpahaми
- •6.12.4. Измерение напряжения электрохимических систем с ионоселективными электродами
- •7 Двой ной электрический слой
- •Явления адсорбции при образовании двойного электрического слоя
- •Злектрокапиллярные явления на ртути и твердых металлах
- •7.3. Емкость двойного электрического слоя
- •7.3.1. Влияние специфической адсорбции ионов на поверхностное натяжение и емкость двойного электрического слоя
- •7.3.2. Заряжение емкости двойного электрического слоя
- •7.4. Теории строения двойного электрического слоя
- •7.5. Двойной слой на твердых электродах
- •7.6. Двойной слой на электродах в расплавленных и твердых электролитах
- •%(%8 Кинетика электродных процессов
- •8.1. Поляризационные кривые
- •8.2. Перенапряжение электрохимической стадии
- •8.2.1. Уравнение поляризационной кривой без учета специфической адсорбции и ψ’-потенциала
- •Влияние ψ’-потенциала на скорость реакции разряда — ионизации
- •8.2.3. Стандартная константа скорости реакции переноса электрона и стандартная плотность тока обмена
- •8.2.4. Способы определения коэффициентов переноса из поляризационных кривых
- •8.3. Стадийные электродные реакции
- •8.4. Электрохимические реакции, включающие быстрые химические стадии
- •8.5. Определение порядков электрохимических реакций
- •8.6. Безбарьерные и безактивациониые электрохимические реакции
- •8.7. Кинетика реакций при конечных степенях заполнения поверхности
- •9 Диффузионная кинетика
- •9.1. Перенапряжение диффузии
- •9.2. Перенапряжение диффузии с учетом миграции
- •9.3. Поляризационные кривые при замедленной стадии диффузии
- •9.4. Окислительно-восстановительные реакции
- •9.5. Сложные окислительно-восстановительные реакции
- •9.6. Наложение перенапряжения диффузии и замедленного переноса электронов (смешанная кинетика)
- •10 Перенапряжение химической реакции
- •10.1. Перенапряжение, обусловленное предшествующей гомогенной химической реакцией в катодном процессе и последующей химической реакцией в анодном процессе
- •10.2. Общий случай электрохимической реакции с замедленной гомогенной химической стадией
- •10.3. Перенапряжение, обусловленное гетерогенными химическими стадиями
- •10.4. Зависимость плотности тока от концентрации и порядок химической реакции
- •11 Примеры различных механизмов электрохимических реакций
- •11.1. Реакция выделения водорода
- •11.2. Кинетика реакций в расплавах и твердых электролитах
- •12 Кинетика реакций электрохимического выделения металлов
- •12.1. Кинетика реакций выделения металлов на жидких катодах
- •12.2. Кинетика реакций при электроосаждении металлов на твердых электродах
- •12.3. Влияние поверхностно-активных веществ на рост кристаллов
- •12.4. Влияние природы металла и состава раствора на кинетические параметры
- •12.5. Электроосаждение металлов из расплавов
- •12.6. Электрохимическое восстановление оксидов
- •13 Анодное растворение и пассивность металлов
- •13.1. Анодное растворение металлов
- •13.2. Пассивность металлов
- •13.2.1. Теория пассивности
- •13.2.2. Кинетика процесса пассивирования
- •14 Короткозамкнутые электрохимические системы
- •14.1. Общие положения
- •14.2. Электрохимическая коррозия
- •14.2.1. Скорость коррозии металла и коррозионный потенциал
- •14.2.2. Растворение металлов под током в коррозйонноактивных средах
- •14.2.3. Коррозия технических металлов
- •14.2.4. Способы снижения скорости коррозионного процесса
- •14.3. Контактное вытеснение металлов (цементация)
- •14.3.1. Общие положения
- •14.3.2. Кинетика процесса цементации
- •14.3.3. Конечный период цементации
- •15 Параллельные электрохимические реакции
- •15.1. Условия протеканий параллельных реакций
- •15.2. Распределение плотности тока между параллельными реакциями
- •16 Основы методов исследования электрохимических реакций
- •16.1. Общие требования к методам исследования
- •16.2. Электроды, применяемые в кинетических исследованиях
- •16.3. Измерение потенциалов под током
- •16.4. Методы исследования
- •Литература
5.4. Конвективный перенос в растворах
Процесс доставки вещества из неподвижного раствора к поверхности твердого тела, где происходит его потребление, сопровождается непрерывным увеличением толщины диффузионного слоя, в котором происходит падение концентрации. В реальных же условиях жидкий электролит никогда не находится в неподвижном состоянии, а всегда перемешивается. Перемешивание может быть специальным (мешалками, подачей потока раствора на электрод, движением электрода или пропусканием струй газа через электролизер), либо может возникать из-за разности в плотности электролита у поверхности электрода и в объеме раствора или в результате выделения газов на поверхности электрода. Любое движение электролита вызывает конвективный перенос вещества.
Перемешивание электролита приводит к тому, что концентрация вещества в толще объема везде одинакова, а градиент концентрации ограничен только тонким слоем раствора, непосредственно прилегающим к поверхности электрода. Толщина этого слоя тем меньше, чем интенсивнее перемешивание. Таким образом, на чисто диффузионный перенос вещества к поверхности электрода в реальных условиях накладывается конвективный перенос, определяемый характером движения раствора.
Задача определения конвективного, переноса не может быть решена в общем виде, а решается лишь для определенных случаев движения жидкости относительно поверхности электрода.
Точное
решение задачи получено для переноса
вещества к поверхности вращающегося
дискового электрода и к растущей ртутной
капле. Поток вещества, обусловленный
конвекцией, равен произведению
скорости движения жидкости
![]() на
концентрацию
на
концентрацию
![]()
и характеризует, как и любой поток, количество молей вещества, переносимых за 1 с через поверхность площадью 1 м2 (как поток, так и скорость — величины векторные). Для определения конвективного переноса нужно, следовательно, знать закон изменения скорости движения жидкости при приближении к поверхности твердого тела.
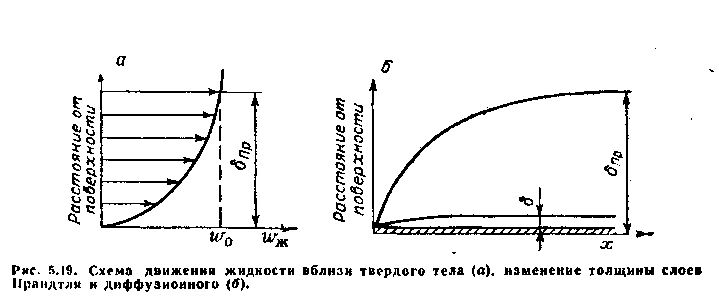
На границе раздела жидкость — твердое тело существует чрезвычайно тонкий неподвижный слой жидкости. По мере удаления от поверхности скорость движения жидкости увеличивается и на достаточно большом расстоянии становится равной скорости в объеме раствора. Распределение скорости движения жидкости в зависимости от расстояния до поверхности электрода показано на рис. 5.19, а.
Слой
жидкости у поверхности твердого тела
с переменной скоростью
движения называется слоем
Прандтля, и
его толщина обозначена
на рис. 5.19,6 через
![]() .
Так как жидкость обладает определенной
вязкостью, то толщина слоя Прандтля не
везде одинакова. Например, при набегании
жидкости на горизонтальную пластину
в точке набегания толщина слоя Прандтля
равна нулю и подрастает
вдоль пластины (координата х)
по
закону
.
Так как жидкость обладает определенной
вязкостью, то толщина слоя Прандтля не
везде одинакова. Например, при набегании
жидкости на горизонтальную пластину
в точке набегания толщина слоя Прандтля
равна нулю и подрастает
вдоль пластины (координата х)
по
закону
![]()
где —кинематическая вязкость; 0 — скорость движения жидкости вне пределов слоя Прандтля.
Слой Прандтля нельзя, однако, отождествлять со слоем, в котором перенос вещества к поверхности осуществляется молекулярной диффузией. В наружной части слоя Прандтля движение жидкости еще настолько велико, что конвективный перенос превалирует над диффузионным. В близлежащих к поверхности слоях жидкости, обладающих очень малой скоростью, преобладающим становится диффузионный перенос вещества.
Движение жидкости у поверхности твердого тела будет влиять на толщину диффузионного слоя, которая зависит от вязкости электролита, расположения электрода и т. д.
Рассмотрим сначала образование диффузионного слоя в случае набегания ламинарного потока вязкой несжимаемой жидкости на горизонтальную, достаточно большую пластину, причем направление движения жидкости параллельно пластине. В месте набегания толщина диффузионного слоя, как и слоя Прандтля, равна, нулю, ибо здесь силы трения еще не успели затормозить слои жидкости, непосредственно прилегающие к твердому телу. Затем, по мере продвижения вдоль твердой поверхности, толщина диффузионного слоя будет расти сначала быстро, затем все медленнее и медленнее, пока не достигнет практически постоянного значения.
В. Г. Левич показал, что
![]()
откуда с учетом предыдущего уравнения:
![]()
Здесь k — коэффициент пропорциональности, равный 3.
Поскольку по порядку величин для водных растворов D ≈ ≈10–9 м2/с, a ν = 10–6 м2/с, то
![]()
т. е. толщина диффузионного слоя составляет примерно 10% от толщины слоя Прандтля.
Для турбулентного режима набегания жидкости приближенный расчет толщины диффузионного слоя с точностью до постоянного значения приводит к выражению:
![]()
Сопоставление двух выражений для δ показывает, что в случае турбулентного режима движения жидкости толщина диффузионного слоя много меньше зависит от координаты х и резче уменьшается с увеличением w0, чем в случае ламинарного потока.
Для вертикального пластинчатого электрода толщину диффузионного слоя при естественной конвекции можно рассчитать по уравнению
![]()
где k — коэффициент, равный 0,51 — 0,73; х — координата на поверхности электрода, отсчитанная от верхнего или нижнего края электрода, в зависимости от того, идет ли повышение или понижение плотности раствора в диффузионном слое; g — ускорение свободного падения; ΔС — разность концентраций у поверхности электрода и в объеме раствора; α = дρ/дС — коэффициент изменения плотности раствора (ρ—плотность, а С — концентрация раствора).
При наличии фонового электролита изменение плотности раствора вблизи электрода значительно меньше, чем в его отсутствие, поэтому и естественная конвекция невелика.
Для ориентировочного расчета изменения толщины диффузионного слоя с интенсивностью перемешивания с успехом применяют простую эмпирическую зависимость
![]()
где k — коэффициент пропорциональности, определяемый из опыта; wп – скорость перемешивания, которая пропорциональна частоте вращения мешалки или количеству пропускаемого через раствор газа, или какому-нибудь другому фактору, обусловливающему перемешивание; β — постоянная, равная примерно 0,5 для ламинарного режима и около 0,9 для турбулентного.
Знание зависимости толщины диффузионного слоя от скорости потока жидкости позволяет определить поток вещества к поверхности электрода, например, по первому закону Фика в случае стационарного режима.
