
- •Оглавление
- •2 Электрохимические системы
- •2.1. Определение электрохимической системы
- •2.2. Прохождение электрического тока в электрохимической системе. Законы фарадея
- •2.3. Термодинамически обратимые и необратимые электрохимические системы
- •2.4. Классификация термодинамически обратимых электрохимических систем
- •2.5. Составляющие электрохимической системы
- •2.6. Идеальные и реальные электрохимические системы
- •3 Метод активности
- •3.1. Формальный метод активности льюиса
- •3.2. Расчет коэффициента активности по дебдш и хюккелю
- •3.3. Расчет коэффициента активности по робинсону и стоксу
- •3.4. Эмпирические способы расчета коэффициентов активности
- •4 Ионные равновесии
- •4.1. Ионные равновесия в растворах электролитов
- •4.2. Сольволиз и буферные свойства
- •4.3. Константы образования комплексных ионов
- •4.4. Ступенчатая диссоциация электролитов
- •4.5. Ионные равновесия в растворах электролитов в присутствии твердой фазы
- •5 Процессы переноса в электрохимических системах
- •5.1. Электрическая проводимость
- •5.1.1. Электронная проводимость
- •Ионная проводимость
- •Электрическая проводимость газов
- •5.1.2.2. Электрическая проводимость твердых тел
- •5.1.2.3. Электрическая проводимость расплавленных соединений
- •5.1.2.4. Электрическая проводимость растворов
- •5.1.3. Теории электрической проводимости растворов
- •5.1.3.1. Простая гидродинамическая теория
- •5.1.3.2. Теория дебая – хюккеля – онзагера
- •5.1.3.3. Теория эйринга
- •5.1.3.4. Протолитическая теория электролитической проводимости
- •5.1.3.5. Применение средней ионной активности для расчета проводимости
- •5.2. Диффузия в растворах электролитов
- •5.3. Диффузионный, или жидкостный, потенциал
- •5.4. Конвективный перенос в растворах
- •5.5. Термодиффузия
- •6. Напряжение электрохимических систем
- •6.1. Возникновение напряжения в электрохимической системе
- •6.2. Равновесные потенциалы на границах раздела фаз
- •6.3. Уравнения равновесного электродного потенциала
- •6.4. Влияние температуры на электродный потенциал
- •6.5. Выбор относительной шкалы потенциалов
- •6.6. Электроды сравнения
- •6.7. Правило лютера
- •6.8. Термодинамическое равновесие с растворителем
- •6.9. Расчет напряжения электрохимических систем с помощью потенциалов в относительной шкале
- •6.9.1. Напряжение электрохимических систем с химической реакцией
- •Напряжение электрохимических систем без химической реакции
- •Напряжение электрохимических систем без химической реакции
- •6.10. Методы устранения диффузионного потенциала
- •4,2 Кмоль/м3 20,4 кмоль/м3
- •6.11. Термодинамика электрохимических систем
- •6.12. Ионоселективные электроду
- •6.12.1. Уравнение мембранного потенциала
- •6.12.2. Электроды с твердыми ионитовыми мембранами
- •6.12.3. Электроды с жидкими ионитовыми memбpahaми
- •6.12.4. Измерение напряжения электрохимических систем с ионоселективными электродами
- •7 Двой ной электрический слой
- •Явления адсорбции при образовании двойного электрического слоя
- •Злектрокапиллярные явления на ртути и твердых металлах
- •7.3. Емкость двойного электрического слоя
- •7.3.1. Влияние специфической адсорбции ионов на поверхностное натяжение и емкость двойного электрического слоя
- •7.3.2. Заряжение емкости двойного электрического слоя
- •7.4. Теории строения двойного электрического слоя
- •7.5. Двойной слой на твердых электродах
- •7.6. Двойной слой на электродах в расплавленных и твердых электролитах
- •%(%8 Кинетика электродных процессов
- •8.1. Поляризационные кривые
- •8.2. Перенапряжение электрохимической стадии
- •8.2.1. Уравнение поляризационной кривой без учета специфической адсорбции и ψ’-потенциала
- •Влияние ψ’-потенциала на скорость реакции разряда — ионизации
- •8.2.3. Стандартная константа скорости реакции переноса электрона и стандартная плотность тока обмена
- •8.2.4. Способы определения коэффициентов переноса из поляризационных кривых
- •8.3. Стадийные электродные реакции
- •8.4. Электрохимические реакции, включающие быстрые химические стадии
- •8.5. Определение порядков электрохимических реакций
- •8.6. Безбарьерные и безактивациониые электрохимические реакции
- •8.7. Кинетика реакций при конечных степенях заполнения поверхности
- •9 Диффузионная кинетика
- •9.1. Перенапряжение диффузии
- •9.2. Перенапряжение диффузии с учетом миграции
- •9.3. Поляризационные кривые при замедленной стадии диффузии
- •9.4. Окислительно-восстановительные реакции
- •9.5. Сложные окислительно-восстановительные реакции
- •9.6. Наложение перенапряжения диффузии и замедленного переноса электронов (смешанная кинетика)
- •10 Перенапряжение химической реакции
- •10.1. Перенапряжение, обусловленное предшествующей гомогенной химической реакцией в катодном процессе и последующей химической реакцией в анодном процессе
- •10.2. Общий случай электрохимической реакции с замедленной гомогенной химической стадией
- •10.3. Перенапряжение, обусловленное гетерогенными химическими стадиями
- •10.4. Зависимость плотности тока от концентрации и порядок химической реакции
- •11 Примеры различных механизмов электрохимических реакций
- •11.1. Реакция выделения водорода
- •11.2. Кинетика реакций в расплавах и твердых электролитах
- •12 Кинетика реакций электрохимического выделения металлов
- •12.1. Кинетика реакций выделения металлов на жидких катодах
- •12.2. Кинетика реакций при электроосаждении металлов на твердых электродах
- •12.3. Влияние поверхностно-активных веществ на рост кристаллов
- •12.4. Влияние природы металла и состава раствора на кинетические параметры
- •12.5. Электроосаждение металлов из расплавов
- •12.6. Электрохимическое восстановление оксидов
- •13 Анодное растворение и пассивность металлов
- •13.1. Анодное растворение металлов
- •13.2. Пассивность металлов
- •13.2.1. Теория пассивности
- •13.2.2. Кинетика процесса пассивирования
- •14 Короткозамкнутые электрохимические системы
- •14.1. Общие положения
- •14.2. Электрохимическая коррозия
- •14.2.1. Скорость коррозии металла и коррозионный потенциал
- •14.2.2. Растворение металлов под током в коррозйонноактивных средах
- •14.2.3. Коррозия технических металлов
- •14.2.4. Способы снижения скорости коррозионного процесса
- •14.3. Контактное вытеснение металлов (цементация)
- •14.3.1. Общие положения
- •14.3.2. Кинетика процесса цементации
- •14.3.3. Конечный период цементации
- •15 Параллельные электрохимические реакции
- •15.1. Условия протеканий параллельных реакций
- •15.2. Распределение плотности тока между параллельными реакциями
- •16 Основы методов исследования электрохимических реакций
- •16.1. Общие требования к методам исследования
- •16.2. Электроды, применяемые в кинетических исследованиях
- •16.3. Измерение потенциалов под током
- •16.4. Методы исследования
- •Литература
5.1.1. Электронная проводимость
Металлы, характеризующиеся небольшой энергией перехода электрона из валентной зоны в зону проводимости, уже при нормальной температуре имеют в зоне проводимости достаточное число электронов для обеспечения высокой электрической проводимости. Проводимость металлов уменьшается с повышением температуры. Это происходит из-за того, что с ростом температуры в металлах преобладает эффект увеличения колебательной энергии ионов кристаллической решетки, оказывающий сопротивление направленному движению электронов, над эффектом увеличения числа носителей заряда в зоне проводимости. Сопротивление химически чистых металлов с повышением температуры возрастает, увеличиваясь примерно на 4∙10–3 R0 при повышении температуры на градус (R0 — сопротивление при 0°С). Для большинства химически чистых металлов при нагревании наблюдается прямолинейная зависимость между сопротивлением и температурой
R = R0 (1 + αt)
где α — температурный коэффициент сопротивления.
Температурные коэффициенты сплавов могут изменяться в широких пределах, например, у латуни α = 1,5∙10–3, а у константана α = 4∙10–6.
Удельная проводимость металлов и сплавов лежит в пределах 106 — 7∙107 См/м. Электрическая проводимость металла зависит от числа и заряда электронов, участвующих в переносе тока, и среднего времени пробега между столкновениями. Эти же параметры при данной напряженности электрического поля определяют и скорость движения электрона. Поэтому плотность тока в металле может быть выражена уравнением
![]()
где
![]() — средняя скорость упорядоченного
движения зарядов; п
–
число
электронов зоны проводимости в единице
объема.
— средняя скорость упорядоченного
движения зарядов; п
–
число
электронов зоны проводимости в единице
объема.
Полупроводники по своей проводимости занимают промежуточное положение между металлами и изоляторами. Чистые полупроводниковые материалы, например германий и кремний, обладают собственной проводимостью.
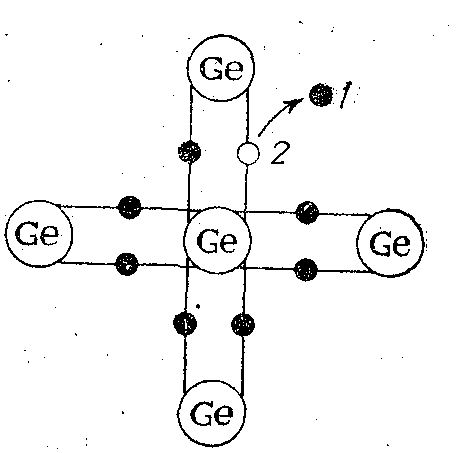
Рис. 5.1. Схема возникновения пары электрон проводимости (1) – дырка (2).
Собственная проводимость обусловлена тем, что при тепловом возбуждении электронов происходит их переход из валентной зоны в зону проводимости. Эти электроны под действием разности потенциалов движутся в определенном направлении и обеспечивают электронную проводимость полупроводников. При переходе электрона в зону проводимости в валентной зоне остается вакантное место — «дырка», эквивалентное присутствию единичного положительного заряда. Дырка также может перемещаться под действием электрического поля в результате перескока на ее место электрона валентной зоны, но в сторону, противоположную движению электронов зоны проводимости, обеспечивая дырочную проводимость полупроводника. Процесс образования дырки показан на рис. 5.1.
Таким образом, в полупроводнике с собственной проводимостью имеется два типа носителей заряда— электроны и дырки, которые обеспечивают электронную и дырочную проводимость полупроводника.
В полупроводнике с собственной проводимостью число электронов в зоне проводимости равно числу дырок в валентной зоне. При данной температуре в полупроводнике существует динамическое равновесие между электронами и дырками, т. е. скорость их образования равна скорости рекомбинации. Рекомбинация электрона зоны проводимости с дыркой валентной зоны приводит к «образованию» электрона в валентной зоне.
Удельная проводимость полупроводника зависит от концентрации носителей заряда, т. е. от их числа в единице объема. Обозна-чим концентрацию электронов ni, а концентрацию дырок рi. В полупроводнике с собственной проводимостью ni = pi (такие полупроводники кратко называются полупроводниками i-типа). Концентрация носителей заряда, например в чистом германии, равна ni = pi ≈1019 м–3, в кремнии — примерно 1016 м–3 и составляет 10–7 — 10–10 % по отношению к числу атомов N.
Под
действием электрического поля в
полупроводнике происходит направленное
движение электронов и дырок. Плотность
тока проводимости
складывается из электронной ie
и
дырочной ip
плотностей
токов: i
= ie
+ ip,
которые,
несмотря на равенство концентраций
носителей, не равны по величине, так как
скорости движения
(подвижности) электронов
![]() и дырок
и дырок
![]() различны.
Плотность
электронного тока равна:
различны.
Плотность
электронного тока равна:
![]()
Средняя скорость движения электронов пропорциональна напряженности Е' электрического поля:
![]()
91
Коэффициент пропорциональности we0 характеризует скорость движения электрона при единичной напряженности электрического поля и называется абсолютной скоростью движения. При комнатной температуре в чистом германии we0 = 0,36 м2/(В∙с).
Из двух последних уравнений получаем:
![]()
Повторив аналогичные рассуждения для дырочной проводимости, можем записать:
![]()
Тогда для полной плотности тока:
![]()
Сравнивая выражение для i с законом Ома i = κЕ', при S = 1 м2 получим:
![]()
Как указано выше, у полупроводника с собственной проводимостью ni = pi, следовательно
![]()
wp0 всегда ниже we0, например в германии wp0 = 0, 18 м2/(В∙с), а we0 = 0,36 м2/(В∙с).
Таким образом, удельная электрическая проводимость полупроводника зависит от концентрации носителей и их абсолютных скоростей и аддитивно складывается из двух членов:
κi = κe + κp
Закон Ома для полупроводников выполняется лишь в том случае, если концентрация носителей ni не зависит от напряженности поля. При высоких напряженностях поля, которые называются критическими (для германия Eкр’ = 9∙104 В/м, для кремния Eкр’ = 2,5∙104 В/м), закон Ома нарушается, что связано с изменением энергии электрона в атоме и снижением энергии перевода в зону проводимости, а также с возможностью ионизации атомов решетки. Оба эффекта вызывают увеличение концентрации носителей заряда.
Электрическая проводимость при высоких напряженностях поля выражается эмпирическим законом Пуля:
ln κ = ln κ0 + α (E’ – Eкр’)
где κ0 — удельная проводимость при Е’ = Екр’.
При повышении температуры в полупроводнике происходит интенсивная генерация носителей заряда, причем их концентрация увеличивается быстрее, чем уменьшается абсолютная скорость движения электронов из-за теплового движения. Поэтому, в отличие
от металлов, электрическая проводимость полупроводников с по- вышением температуры возрастает. В первом приближении для небольшого интервала температур зависимость удельной проводимости полупроводника от температуры может быть выражена уравнением
![]()
где k — постоянная Больцмана; А — энергия активации (энергия, необходимая для перевода электрона в зону проводимости).
Вблизи абсолютного нуля все полупроводники являются хорошими изоляторами. С повышением температуры на градус их проводимость увеличивается в среднем на 3 — 7%.
При введении в чистый полупроводник примесей к собственной электрической проводимости добавляется примесная электрическая проводимость. Если, например, в германий вводить элементы V группы периодической системы (Р, As, Sb), то последние образуют решетку с германием с участием четырех электронов, а пятый электрон, в связи с малой энергией ионизации атомов примеси (около 1,6∙10–21), переходит от атома примеси в зону проводимости. В таком полупроводнике будет преобладать электронная проводимость (полупроводник называется электронным полупроводником п-типа]. Если атомы примеси обладают большим сродством к электрону, чем германий, например элементы III группы (In, Ga, В, А1), то они отнимают электроны от атомов германия и в валентной зоне образуются дырки. В таких полупроводниках преобладает дырочная проводимость (полупроводник р-типа]. Атомы примесей, обеспечивающие электронную проводимость, являются донорами электронов, а дырочную — акцепторами) .
Примесные полупроводники обладают более высокой электрической проводимостью, чем полупроводники с собственной проводимостью, если концентрация атомов донорной NД или акцепторной NА примеси превышает концентрацию собственных носителей заряда. При больших значениях NД и NA можно пренебречь концентрацией собственных носителей. Носители заряда, концентрация которых преобладает в полупроводнике, называются основными. Например, в германии n-типа nn ≈ 1022 м–3, в то время как ni ≈ 1019 м~3, т. е. концентрация основных носителей в 103 раз превышает концентрацию собственных носителей.
Для примесных полупроводников справедливы соотношения:
nnpn = nipi = ni2 = pi2
nppp = nipi = ni2 = pi2
Первое из этих уравнений записано для полупроводника n-типа, а второе — для полупроводника р-типа. Из данных соотношений следует, что очень небольшое количество примеси (около 10–4 0/о) значительно увеличивает концентрацию носителей заряда, в результате чего электрическая проводимость возрастает.
Если пренебречь концентрацией собственных носителей и считать NД ≈nn для полупроводника n-типа и NA ≈ рр для полупроводника р-типа, то удельная электрическая проводимость примесного полупроводника может быть выражена уравнениями:
![]()
![]()
При наложении электрического поля в полупроводниках n-типа перенос заряда осуществляется электронами, а в полупроводниках р-типа — дырками.
При внешних воздействиях, например при облучении, концентрация носителей заряда изменяется и может быть разной в различных частях полупроводника. В этом случае, как и в растворах, в полупроводнике протекают процессы диффузии. Закономерности Процессов диффузии подчиняются уравнениям Фика. Коэффициенты диффузии носителей заряда значительно выше, чем ионов в растворе. Например, у германия коэффициент диффузии электронов равен 98∙10–4 м2/с, дырок — 47∙10–4 м2/с. Типичными полупроводниками, помимо германия и кремния, при комнатной температуре являются ряд оксидов, сульфидов, селенидов, телуридов и т. д. (например, CdSe, GaP, ZnO, CdS, SnO2, In2O3, InSb).
