
- •Оглавление
- •2 Электрохимические системы
- •2.1. Определение электрохимической системы
- •2.2. Прохождение электрического тока в электрохимической системе. Законы фарадея
- •2.3. Термодинамически обратимые и необратимые электрохимические системы
- •2.4. Классификация термодинамически обратимых электрохимических систем
- •2.5. Составляющие электрохимической системы
- •2.6. Идеальные и реальные электрохимические системы
- •3 Метод активности
- •3.1. Формальный метод активности льюиса
- •3.2. Расчет коэффициента активности по дебдш и хюккелю
- •3.3. Расчет коэффициента активности по робинсону и стоксу
- •3.4. Эмпирические способы расчета коэффициентов активности
- •4 Ионные равновесии
- •4.1. Ионные равновесия в растворах электролитов
- •4.2. Сольволиз и буферные свойства
- •4.3. Константы образования комплексных ионов
- •4.4. Ступенчатая диссоциация электролитов
- •4.5. Ионные равновесия в растворах электролитов в присутствии твердой фазы
- •5 Процессы переноса в электрохимических системах
- •5.1. Электрическая проводимость
- •5.1.1. Электронная проводимость
- •Ионная проводимость
- •Электрическая проводимость газов
- •5.1.2.2. Электрическая проводимость твердых тел
- •5.1.2.3. Электрическая проводимость расплавленных соединений
- •5.1.2.4. Электрическая проводимость растворов
- •5.1.3. Теории электрической проводимости растворов
- •5.1.3.1. Простая гидродинамическая теория
- •5.1.3.2. Теория дебая – хюккеля – онзагера
- •5.1.3.3. Теория эйринга
- •5.1.3.4. Протолитическая теория электролитической проводимости
- •5.1.3.5. Применение средней ионной активности для расчета проводимости
- •5.2. Диффузия в растворах электролитов
- •5.3. Диффузионный, или жидкостный, потенциал
- •5.4. Конвективный перенос в растворах
- •5.5. Термодиффузия
- •6. Напряжение электрохимических систем
- •6.1. Возникновение напряжения в электрохимической системе
- •6.2. Равновесные потенциалы на границах раздела фаз
- •6.3. Уравнения равновесного электродного потенциала
- •6.4. Влияние температуры на электродный потенциал
- •6.5. Выбор относительной шкалы потенциалов
- •6.6. Электроды сравнения
- •6.7. Правило лютера
- •6.8. Термодинамическое равновесие с растворителем
- •6.9. Расчет напряжения электрохимических систем с помощью потенциалов в относительной шкале
- •6.9.1. Напряжение электрохимических систем с химической реакцией
- •Напряжение электрохимических систем без химической реакции
- •Напряжение электрохимических систем без химической реакции
- •6.10. Методы устранения диффузионного потенциала
- •4,2 Кмоль/м3 20,4 кмоль/м3
- •6.11. Термодинамика электрохимических систем
- •6.12. Ионоселективные электроду
- •6.12.1. Уравнение мембранного потенциала
- •6.12.2. Электроды с твердыми ионитовыми мембранами
- •6.12.3. Электроды с жидкими ионитовыми memбpahaми
- •6.12.4. Измерение напряжения электрохимических систем с ионоселективными электродами
- •7 Двой ной электрический слой
- •Явления адсорбции при образовании двойного электрического слоя
- •Злектрокапиллярные явления на ртути и твердых металлах
- •7.3. Емкость двойного электрического слоя
- •7.3.1. Влияние специфической адсорбции ионов на поверхностное натяжение и емкость двойного электрического слоя
- •7.3.2. Заряжение емкости двойного электрического слоя
- •7.4. Теории строения двойного электрического слоя
- •7.5. Двойной слой на твердых электродах
- •7.6. Двойной слой на электродах в расплавленных и твердых электролитах
- •%(%8 Кинетика электродных процессов
- •8.1. Поляризационные кривые
- •8.2. Перенапряжение электрохимической стадии
- •8.2.1. Уравнение поляризационной кривой без учета специфической адсорбции и ψ’-потенциала
- •Влияние ψ’-потенциала на скорость реакции разряда — ионизации
- •8.2.3. Стандартная константа скорости реакции переноса электрона и стандартная плотность тока обмена
- •8.2.4. Способы определения коэффициентов переноса из поляризационных кривых
- •8.3. Стадийные электродные реакции
- •8.4. Электрохимические реакции, включающие быстрые химические стадии
- •8.5. Определение порядков электрохимических реакций
- •8.6. Безбарьерные и безактивациониые электрохимические реакции
- •8.7. Кинетика реакций при конечных степенях заполнения поверхности
- •9 Диффузионная кинетика
- •9.1. Перенапряжение диффузии
- •9.2. Перенапряжение диффузии с учетом миграции
- •9.3. Поляризационные кривые при замедленной стадии диффузии
- •9.4. Окислительно-восстановительные реакции
- •9.5. Сложные окислительно-восстановительные реакции
- •9.6. Наложение перенапряжения диффузии и замедленного переноса электронов (смешанная кинетика)
- •10 Перенапряжение химической реакции
- •10.1. Перенапряжение, обусловленное предшествующей гомогенной химической реакцией в катодном процессе и последующей химической реакцией в анодном процессе
- •10.2. Общий случай электрохимической реакции с замедленной гомогенной химической стадией
- •10.3. Перенапряжение, обусловленное гетерогенными химическими стадиями
- •10.4. Зависимость плотности тока от концентрации и порядок химической реакции
- •11 Примеры различных механизмов электрохимических реакций
- •11.1. Реакция выделения водорода
- •11.2. Кинетика реакций в расплавах и твердых электролитах
- •12 Кинетика реакций электрохимического выделения металлов
- •12.1. Кинетика реакций выделения металлов на жидких катодах
- •12.2. Кинетика реакций при электроосаждении металлов на твердых электродах
- •12.3. Влияние поверхностно-активных веществ на рост кристаллов
- •12.4. Влияние природы металла и состава раствора на кинетические параметры
- •12.5. Электроосаждение металлов из расплавов
- •12.6. Электрохимическое восстановление оксидов
- •13 Анодное растворение и пассивность металлов
- •13.1. Анодное растворение металлов
- •13.2. Пассивность металлов
- •13.2.1. Теория пассивности
- •13.2.2. Кинетика процесса пассивирования
- •14 Короткозамкнутые электрохимические системы
- •14.1. Общие положения
- •14.2. Электрохимическая коррозия
- •14.2.1. Скорость коррозии металла и коррозионный потенциал
- •14.2.2. Растворение металлов под током в коррозйонноактивных средах
- •14.2.3. Коррозия технических металлов
- •14.2.4. Способы снижения скорости коррозионного процесса
- •14.3. Контактное вытеснение металлов (цементация)
- •14.3.1. Общие положения
- •14.3.2. Кинетика процесса цементации
- •14.3.3. Конечный период цементации
- •15 Параллельные электрохимические реакции
- •15.1. Условия протеканий параллельных реакций
- •15.2. Распределение плотности тока между параллельными реакциями
- •16 Основы методов исследования электрохимических реакций
- •16.1. Общие требования к методам исследования
- •16.2. Электроды, применяемые в кинетических исследованиях
- •16.3. Измерение потенциалов под током
- •16.4. Методы исследования
- •Литература
4.3. Константы образования комплексных ионов
При образовании комплексных ионов присоединение лиганда L* к центральному иону Мz+ происходит ступенчато:
Mz+ + L = Mz+L
Mz+L + L = Mz+L2
……………………
Mz+Li–1 + L = Mz+Li
……………………
Mz+Ln–1 + L = Mz+Ln
Концентрационные константы равновесия для этих реакций могут быть записаны следующим образом:
![]()

……………………….
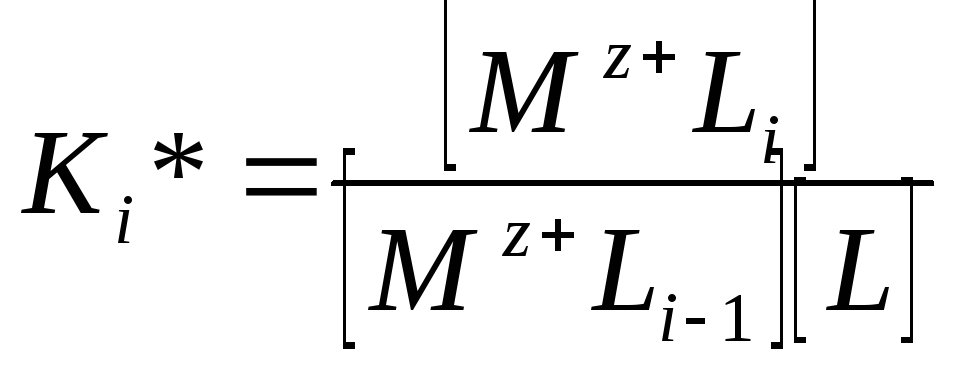
……………………….

Константы K1* — Кn* называются концентрационными ступенчатыми константами образования комплексных ионов. Однако для расчетов удобнее использовать общие константы образования.
* Лиганд может быть как нейтральной частицей, так и ионом. Для упрощения записи заряд лиганда опущен.
В этом случае реакции образования комплексных ионов записываются следующим образом
Mz+ + L = Mz+L
Mz+ + 2L = Mz+L2
……………………
Mz+ + iL = Mz+Li
……………………
Mz+ + nL = Mz+Ln
и выражения для концентрационных общих констант образования
будут
![]()

……………………….

……………………….

Из сравнения выражений для общих и ступенчатых констант образования (устойчивости) видно, что:
β1 = K1
β2 = K1K2
………………..
βi = K1K2 … Ki
……………………….
Βn = K1K2 … Ki … Kn
Величины, обратные общим константам устойчивости, называются константами нестойкости:

Уравнения материального баланса по катионам и анионам для растворов, содержащих комплексные ионы с аналитическими концентрациями катиона C1 и аниона C2, будут иметь вид:
C1 = [Mz+] + [Mz+L] + … + [Mz+Li] + … + [Mz+Ln]
C2 = [L–] +[Mz+L] + … + 2[Mz+L2] + … + i[Mz+Li] + … + n[Mz+Ln]
Выражая равновесные концентрации комплексов через общие константы устойчивости, получим:
C1 = [Mz+] (1 + β1 [L] + β2 [L]2 + … + βi [L]i + … + βn [L]n)
или
![]()

Рис, 4.1. Распределительная диаграмма для иодидных комплексов цинка в растворе диметилформамида.
Зависимость долей сольватированных ионов цинка (1), ZnI+ (2), ZnI2 (3), ZnI3– (4) и ZnI42– (5) от концентрации иодида лития.
При исследовании электрохимического восстановления или окисления комплексных ионов, когда в растворе существует несколько сортов частиц, важное значение имеет знание равновесных концентраций каждой из них. Наиболее наглядное представление о составе раствора дают кривые распределения (или распределительные диаграммы), которые показывают зависимость доли аи каждого сорта комплексов от концентрации лиганда CL (рис 4.1). Долей комплекса называется отношение его равновесной концентрации при данной концентрации лиганда к аналитической концентрации катионов. В соответствии с этим определением доля простых незакомплексованных ионов в растворе равна:
α0 = [Mz+]/C1
Подставляя выражение для С1, получим:

Доли других частиц будут:

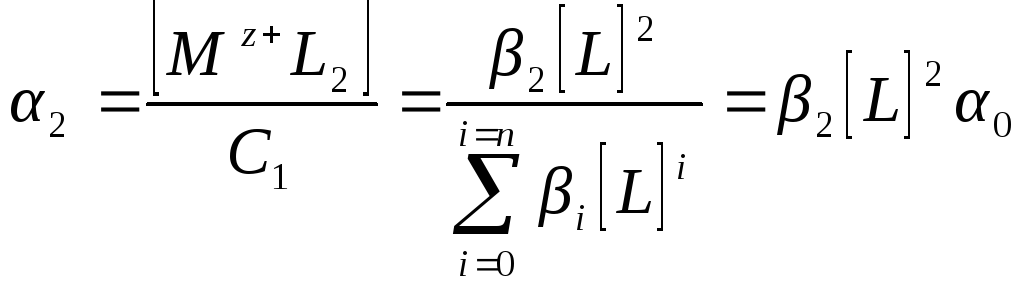
……………………………………….


Так как концентрация всех ионов металла в растворе равна то
α0 + α1 + α2 + … +αi + … +αn = 1
при любой концентрации лиганда.
Равновесные концентрации каждого вида комплексов в растворе могут быть рассчитаны, если известны константы устойчивости и равновесные концентрации ионов металла и лиганда.
4.4. Ступенчатая диссоциация электролитов
Диссоциация многоосновной кислоты, имеющей, например, п атомов водорода, способных ионизироваться, протекает в п последовательных стадий:
HnA + H2O = H3O+ + Hn–1A–
H2O + Hn–1A– = H3O+ + Hn–2A2–
H2O + Hn–2A2– = H3O+ + Hn–3A3–
……………………………………
H2O + HAn–1 = H3O+ + An–
Концентрационная константа диссоциации для каждого из выше написанных уравнений равновесия будет иметь свое значение и определяться соответствующим выражением:



………………………………

Концентрация Н2О постоянна и включена в К*.
Константы диссоциации зависят от структуры молекул кислот, причем константа диссоциации каждого последующего атома водорода меньше константы диссоциации предыдущего, т. е. K1* > > K2* > K3* > … > Kn* Значение каждой последующей константы составляет ~ 1/100000 от предыдущей. Эта закономерность является общей для тех кислородсодержащих кислот, у которых все ОН–-группы связаны с одним и тем же атомом. Например, диссоциация фосфорной кислоты протекает по схеме:
H2O + H3PO4 = H3O+ + H2PO4–
H2O + H2PO4– = H3O+ + HPO42–
H2O + HPO42– = H3O+ + PO43–
Константы диссоциации определяются следующими выражениями



и имеют соответственно значения 5,9∙10–3; 6,2∙10–8; 4,8∙10–13.
Равновесные концентрации разных сортов частиц рассчитываютметодом, аналогичным изложенному при рассмотрении комплекс-ных ионов (см. 4.3).
Материальный баланс для фосфат-иона при диссоциации фосфорной кислоты, аналитическая концентрация которой равна С, запишется так:
[H3PO4] + [H2PO4–] + [HPO42–] + [PO43–] = C
Определим равновесные концентрации частиц из констант диссоциации и, подставляя их в уравнение материального баланса, получим:

Доля кислоты, присутствующей в виде определенной формы, является отношением равновесной концентрации этой формы к аналитической концентрации, например
![]()
Следовательно

Доли других частиц будут определяться выражениями:



Уравнение материального баланса может быть записано также следующим образом:
α1 + α2 + α3 α0 = 1
Рис. 4,2. Распределительная диаграмма фосфорной кислоты.
Равновесные концентрации каждого сорта частиц, присутствующих при диссоциации многоосновной кислоты, рассчитываются, если известны константы
диссоциации и равновесные концентрации, кислоты и ионов водорода.
На рис. 4.2 приведена зависимость α — рН, полученная при использовании констант ионизации, приведенных выше.
Интересен тот факт, что в растворе фосфорной кислоты присутствует либо только один сорт частиц фосфорной кислоты, либо два сорта каких-либо частиц в сравнимых концентрациях, в зависимости от интервала изменения рН, но ни в одном интервале рН не находится сразу три сорта частиц.
