- •Раздел 1. Классификация и номенклатура биоорганических соединений.
- •Раздел 2. Сопряженные системы.
- •Раздел 3 Передача электронных влияний в биоорганических соединениях. Кислотно-основные свойства биоорганических соединений.
- •Раздел 4. Изомерия биоорганических соединений
- •Раздел 5. Механизмы биоорганических реакций.
- •Раздел 6 . Классификация, номенклатура, физические и химические свойства карбоновых кислот.
- •Раздел 7. Природные биологические активные вещества липиды и высшие карбоновые кислоты
- •Раздел 8. Природные биологические активные вещества аминокислоты
- •Раздел 9. Полипептиды. Белки
- •Раздел10. Углеводы. Классификация. Моносахариды.
- •Раздел 11. Углеводы. Олигосахариды. Полисахариды.
- •(Основная связь α-1, 4, ветвление α-1, 6 через 20-25 остатков глюкозы)
- •(Основная связь α-1, 4, ветвление α-1, 6 через 8-12 остатков глюкозы)
- •Раздел 12. Нуклеиновые кислоты, нуклеотиды, нуклеозиды, азотистые основания
- •Раздел 13. Синтетические биологически активные вещества - лекарственные препараты
- •Раздел 14. Алкалоиды. Витамины.
- •Раздел 15.Реакции полимеризации и поликонденсации. Полимеры в стоматологии.
Раздел 2. Сопряженные системы.
Исходный уровень знаний для усвоения темы основан на школьной программе органической химии и разделе 1 данного пособия:
Электронные конфигурации элементов в невозбужденном состоянии (углерод, кислород, азот, водород, сера, галогены), понятие «орбиталь», гибридизация орбиталей атома углерода, азота, пространственная ориентация орбиталей (sp3 , sp2) , ковалентные σ - и π – связи, изменение электроотрицательности элементов в периоде и группе, классификация, номенклатура органических соединений.
Для усвоения темы и приобретения компетенции по данному разделу надо знать:
- определение и виды сопряжения и сопряженных систем (ациклические, ароматические),
- условия делокализации, ароматичности,
- формулы соединений – антрацен, бензол, бутадиен, изопрен, имидазол, индол, нафталин, пиридин, пиримидин, пиррол, пурин, тиофен, фенантрен, фуран,
- формулу Хюккеля, правило подсчета числа π - электронов в ароматическом соединении,
- особенности образования ароматических систем в шестичленных и пятичленных гетероциклических соединениях.
Ключевые слова.
Ароматическое соединение. Ароматичность. Ароматический секстет. Гетероциклическое соединение. Гибридная( гибридизованная) орбиталь Делокализация. Карбоциклическое соединение . Ковалентная связь. Кратная связь. Неподеленная пара электронов. Пиримидиновый атом азота. Пиррольный атом азота. Правило Хюккеля. Полярная связь. Сопряжение( конъюгация). Сопряженная система. Цепь сопряжения. Циклическая сопряженная система. Циклы π –избыточные, π – недостаточные (дефицитные). Энергия сопряжения. Энергия делокализации( энергия резонанса).
Содержание раздела 2 (Дидактические единицы)
2.1.Классификация сопряженных соединений (ациклические, циклические). Определение- сопряжение. Виды сопряжения( π, π- π,р- сопряжение). Делокализация. Энергия делокализации (сопряжения).
2.2. Ациклические сопряженные системы: бутадиен-1,3, метилбутадиен-1,3 ( изопрен), пропеновая, кротоновая, фумаровая кислоты.
2.3. Циклические сопряженные системы- ароматические( карбоциклические и гетероциклические). Критерии (условия ароматичности). Правило Хюккеля.
2.3.1. Карбоциклические: бензол, нафталин, антрацен, фенантрен.
2.3.2. Гетероциклические: пятичленные — фуран, тиофен, пиррол, имидазол, шестичленные – пиридин, пиримидин, многочленные – индол,
пурин.
Нумерация атомов в пиридине, пиримидине, пурине.
Механизм образования ароматической системы в пятичленных и шестичленных гетероциклах. Отличие основных свойств «пиррольного и пиридинового» атомов азота. Понятия : π- избыточные (пятичленные), π-недостаточные (шестичленные) гетероароматические соединения.
Сохранение ароматического секстета в пиридиниевом катионе.
Приложение. Основы теории.
Органические молекулы образованы посредством ковалентных связей. Ковалентные связи возникают по обменному механизму между двумя атомами за счет общей (обобществленной) пары электронов. Образуются неполярные и полярные связи. Полярные связи характеризуются несимметричным (неравномерным) распределением электронной плотности, происходит ее смещение в сторону более электроотрицательного атома. Ковалентные связи могут быть двух типов: сигма (σ) и пи (π). σ - Связи участвуют в образовании скелета молекулы, они являются главными , а π -связи можно рассматривать как дополнительные, но придающие молекулам особые химические свойства. (рис. 1)
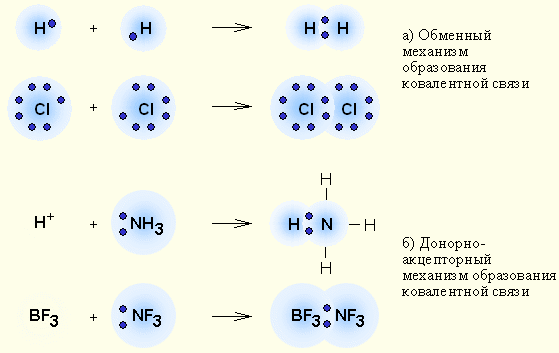
Рис.1 Виды химических связей и механизм их образования
Среди природных биоорганических веществ большое место занимают соединения, которые относят к сопряженным системам.
Сопряженными (конъюгированными) называют кратные связи( двойные или тройные), разделенные одинарной связью.
..-С=С-С=С-С=С-С=С-…
|_______________|
цепь сопряжения
Чередующиеся кратные и простые связи образуют цепь сопряжения.
Чередование кратной связи с атомами, имеющими неподеленные пары электронов (кислород, азот, сера, галогены) также создает сопряженную систему.
… С= С – NH – C= C – С – С =С-
|_______________|
цепь сопряжения
Различают два вида сопряженных систем: ациклические (цепь сопряжения разомкнута) , циклические (цепь сопряжения замкнута).
Сопряженные соединения (π – π, π – р )


ациклические циклические

карбоциклические гетероциклические
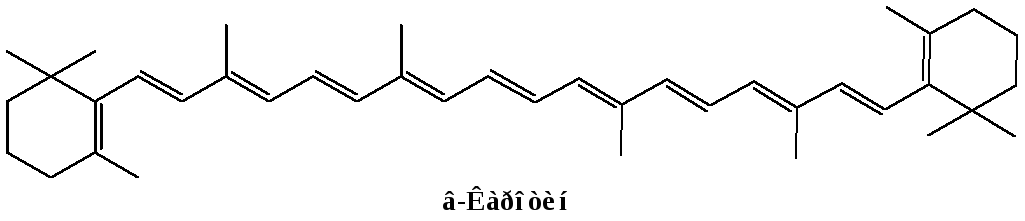
К ациклическим молекулам с сопряженными связями относятся бутадиен-1,3, метилбутадиен-1,3 (изопрен), каротин (пигмент моркови и красного перца), витамин А формах ретинола и ретиналя, ликопин (пигмент помидора), биологически активные карбоновые кислоты, занимающие видное место в процессе обмена веществ: пировиноградная, фумаровая, кротоновая. На участке сопряжения возможно взаимодействие негибридных р-электронов, возникает делокализованная связь.
|
Делокализованная связь-это ковалентная связь, в которой π – электронная плотность не локализована между двумя соседними р - орбиталями, а распределяется по всей π - орбитальной системе. Только сопряжение создает возможность делокализации |
Циклические сопряженные системы бывают двух видов: карбоциклические и гетероциклические
Карбоциклические – скелет молекулы образован только атомами углерода, возникает π - π - сопряжение. Гетероциклические - скелет молекулы образован атомами углерода и гетероатомами (азот, кислород, сера), в этих соединениях возникают два вида взаимодействия:: π , π и π , р - сопряжение.
Особое место среди циклических сопряженных соединений занимают так называемые ароматические. Их особые химические свойства:
1. устойчивость к действию окислителя перманганата калия в растворе,
2. устойчивость, несмотря на высокую степень ненасыщенности, к действию раствора брома, что означает неспособность к реакциям присоединения в условиях, типичных для алкенов и полиенов,
3. способность к реакциям замещения в растворе по ионному
(катионному, электрофильному) механизму. Перечисленный комплекс химических свойств стали называть ароматическими свойствами, а вещества, обладающими этими свойствами - ароматическими. Классическим примером является бензол.
Рентгеноструктурный анализ кристаллов бензола обнаружил, что молекула бензола
• имеет плоское ( планарное) строение
• правильный шестичленный цикл
|• углы между всеми связями равны 120
• длина всех связей С-С одинаковая , равна 1,39А и имеет среднее значение между длиной одинарной связи 1,54А и длиной двойной связи 1,34 .
Эти научные данные следует объяснить образованием общей электронной системы, состоящей из 6 электронов (ароматический секстет). Электронная плотность равномерно распределена между атомами углерода, которые находятся в sp2-гибридном состоянии. Максимум электронной плотности негибридизованных р-орбиталей находится над и под плоскостью бензольного кольца. (рис 2 )
 -скелет
лежит в плоскости
-скелет
лежит в плоскости
Рис. 2 Схема расположения негибридизованных р-орбиталей в бензоле и расположения атомов углерода в скелете
Образование общей π-электронной системы в бензоле относится к явлению делокализации. Устойчивость бензола за счет делокализации электронов повышается на 36,6 ккал\моль (150 кдж\моль). Эта величина носит название - энергия делокализации (энергия резонанса). Возникает повышенная термодинамическая устойчивость. Повышенной термодинамической устойчивостью, а следовательно, и ароматическими свойствами обладают только те циклические соединения, которые имеют
• плоское строение
• сопряженную систему связей
•число π -электронов в сопряженной системе N(π ) = 4n+2 , где n - целое число 1,2,3.4 и т. д., получаются значения N= 6, 10, 14, 18 и т. д.
Формула N(π ) = 4n+2 носит название « правило Хюккеля».
Природные шестичленные гетероциклические ароматические соединения содержат один или несколько атомов азота. В пиридине присутствует один атом азота, а в пиримидине два атома в положении 1,3 относительно друг друга. Атомы азота в шестичленных азотсодержащих гетероциклических соединениях сохраняют основные свойства (более слабые по сравнению с аммиаком). В молекуле пиридина один основный атом азота, а в пиримидине - два основных атома азота. Образование соли не нарушает ароматическую систему, но усиливает неравномерное распределение электронной плотности. Шестичленные гетероциклы относятся к «π - недостаточным циклам».
Пятичленные ароматические гетероциклические соединения образованы с участием атомов азота, кислорода, серы. Имеется доказательство включения пары электронов гетероатома в ароматический секстет: пиррол не проявляет основных свойств, в обычных условиях не взаимодействует с кислотами и не образует с ними солей. Пиррол, фуран, тиофен относятся к «π -избыточным циклам», т.к. 6 электронов в ароматической системе распределены между 5 атомами, составляющими эту систему.
Производными пиридина являются никотиновая кислота, никотинамид
(витамин РР), который входит в состав переносчика электронов кофермента NAD+ , витамин В6, регулирующий обмен аминокислот и синтез гема. На основе пиридина получены противотуберкулезные препараты (изониазид)
В организме человека пиримидин представлен тремя главными представителями - урацилом, тимином и цитозином, которые входят в состав нуклеиновых кислот и носят название «пиримидиновые азотистые основания» нуклеиновых кислот.
Пиррол содержится в составе гема - сложной четырехпиррольной ароматической порфириновой системы, включающей в себя ионы металлов. Сопряженная система гема гемоглобина содержит 30 π -электронов (соответствует правилу Хюккеля)
Производные пурина - аденин и гуанин входят в состав нуклеиновых кислот (пуриновые азотистые основания), самое распространенное в организме человека макроэргическое соединение АТФ также содержит аденин.
(PS . Структурные химические формулы названных химических соединений можно найти в разделе «Формулы химических соединений»).
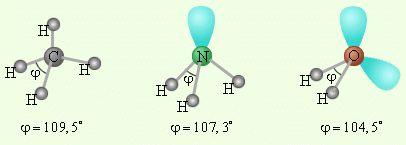
СН4 NН3 Н2О
Рис. 3. Пространственное расположение валентных орбиталей атомов углерода (СН4) , азота(NН3), кислорода (Н2О) в гибридизованном состоянии sp3.
Обучающая задача 1.
Соединение нафталин обладает неприятным характерным запахом, нерастворимо в воде и растворимо в органических растворителях (бензоле). Многие его соединения токсичны для организма, обладают канцерогенной активностью, но его природное витамин К необходим для нормального функционирования свертывающей системы крови и синтеза костной ткани (остеогенеза). Можно ли считать нафталин ароматическим соединением?
Какие нужны сведения для доказательства?
Решение.
-
Необходимо знать химический состав нафталина. Брутто-формула нафталина С10Н8.
-
Следует обсудить его состав и некоторые известные химические свойства. Нафталин, судя по брутто-формуле, ненасыщенное соединение. О химических свойствах можно прочитать, что он не обесцвечивает раствор бромной воды и перманганата калия. Эти качества характерны для ненасыщенных соединениях, которые относятся к ароматическим.
-
Если составлять структурную химическую формулу, то состав С10Н8 позволяет предложить бициклическое конденсированное соединение с сопряженной системой связей.
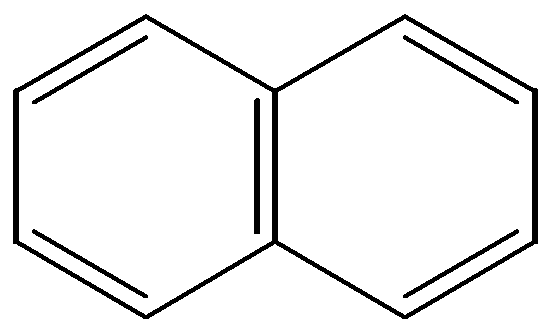
4. Для подтверждения ароматических свойств следует определить общее число π - электронов в сопряженной системе.
Все 10 атомов углерода в соответствии со структурной формулой находятся в sp2 гибридизованной состоянии, и каждый атом отдает в общую систему по одному электрону с негибридизованной орбитали (всего 10 электронов).
-
Применим формулу Хюккеля, чтобы удостовериться, что система ароматическая.
N=4n+2 4 · 2 + 2=10
5. Нафталин - карбоциклическое ароматическое соединение, содержащее два щестичленных конденсированных цикла.
Обучающая задача 2.
Органическая молекула порфирин, связывающая ионы металлов железа, магния, образует гем в составе гемоглобина, хлорофилла и митохондриальных цитохромов, содержит систему сопряженных связей, имеет плоскостное строение, в ней насчитывают 30 π-электронов. Можно ли порфирин отнести к ароматическим соединениям?
Решение.
1. Вспомним условие ароматичности (см. текст) и определим, есть ли необходимые условия: плоскостное строение и сопряженная система связей.
2. Запишем формулу Хюккеля подсчета π- электронов, которая при наличии необходимых условий является решающим фактором для создания ароматичности.
N π = 4 n + 2 ( n - любое целое число)
3 Рассчитаем, может ли количество 30 электронов создать ароматическую. систему.
30= 4 n + 2 n=7
Органическая молекула порфирина в системе гема относится к ароматическим соединениям.
Обучающая задача 3.
Аминокислота триптофан не синтезируется в клетках человека и должна обязательно поступать с продуктами питания. Он относится к незаменимым веществам нашего организма. Из триптофана синтезируется нейромедиатор серотонин, определяющий многие аспекты поведения человека, и амид никотиновой кислоты, который называют витамин РР. Никотинамид входит в состав кофермента НАД+. Определите, относится ли индольный цикл триптофана к ароматическим соединениям? Сохраняет ли циклический атом азота основные свойства?
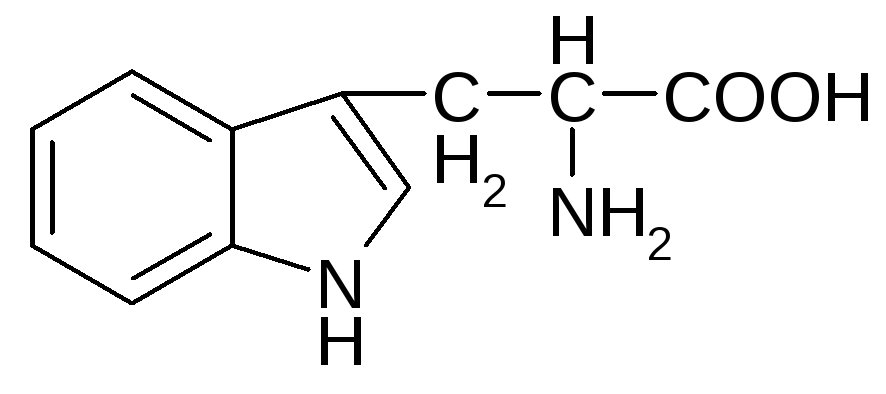
индольный цикл
Решение.
1. Определим вначале химическую природу индола. Индол относится к конденсированным гетероциклическим соединениям. В его составе шестичленный цикл бензола и цикл пиррола, имеющие общие два атома углерода. Всего 8 атомов углерода и один атом азота.
2. Рассмотрим тип гибридизации атомов углерода. Все 8 атомов содержат двойные связи - тип гибридизации sp2. Двойные связи чередуются с одинарными - между ними возникает π -π сопряжение. Общее число нагибридизованных р- электронов равно 8.
3. Оценим вклад электронов атома в общую электронную систему. Атом азота тоже может образовать гибридизованные орбитали sp2, и этом состоянии пара электронов располагается на негибридной р- орбитали, включаясь в общую электронную систему молекулы. Возникает π - р сопряжение (как в молекуле пиррола). Образуется 10 π –электронная система (8+2), отвечающая правилу Хюккеля.
4. Молекула индола - ароматическое соединение. Атом азота в индольном цикле отдает неподеленнуюю пару электронов в общую 10 π-электронную систему, которая формируется с участием π- π и π-р сопряжения.
5. Атом азота в индольном цикле не проявляет основных свойств.
Формулы химических соединений, изучаемых в теме 2
Сопряженные ациклические соединения
![]()
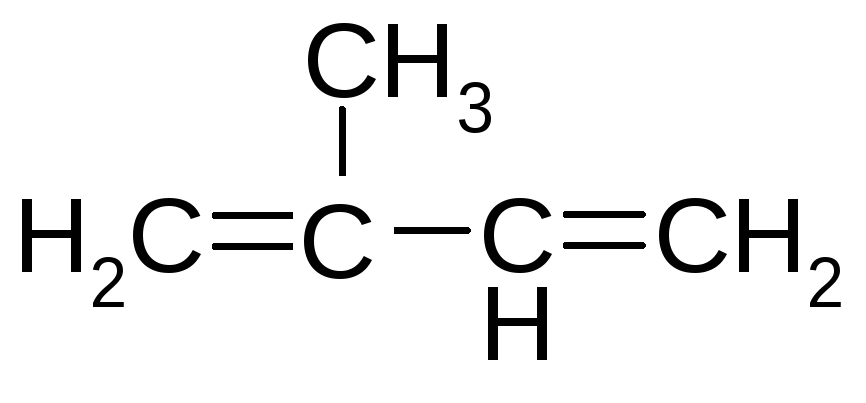
![]() СН3–СН=СН – СООН
СН3–СН=СН – СООН
бутадиен-1,3 метилбутадиен-1,3 хлорэтен 2-бутеновая кислота
(изопрен) (хлорвинил) (кротоновая)
Карбоароматические соединения
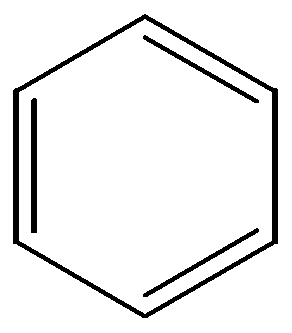
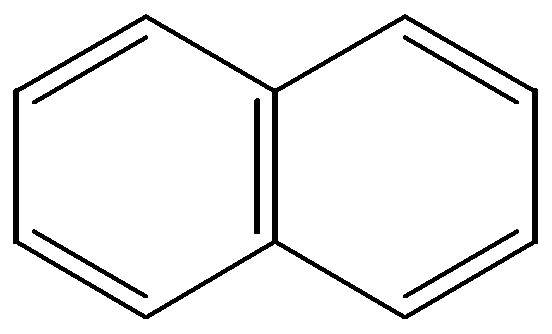
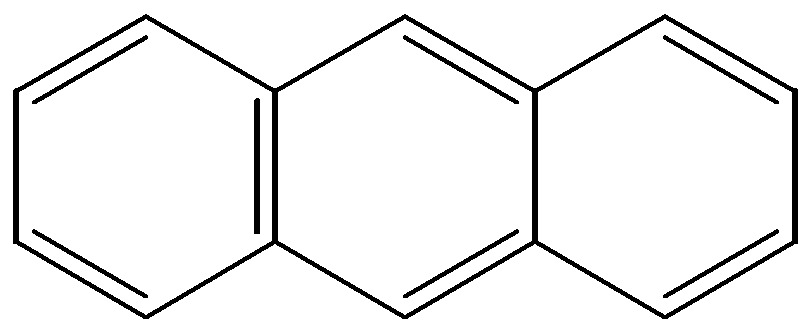
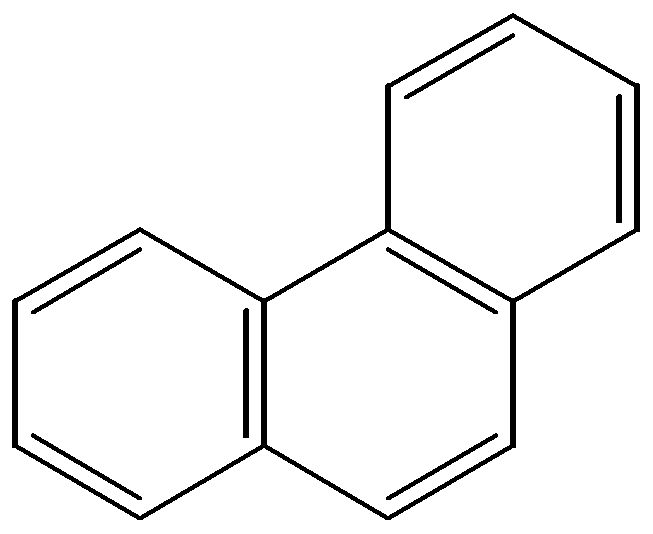
бензол нафталин антрацен фенантрен
Гетероароматические соединения
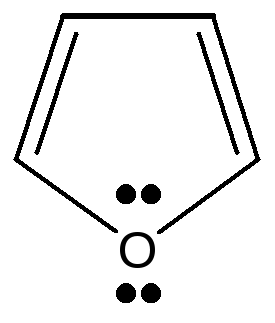
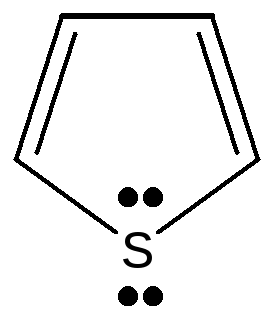
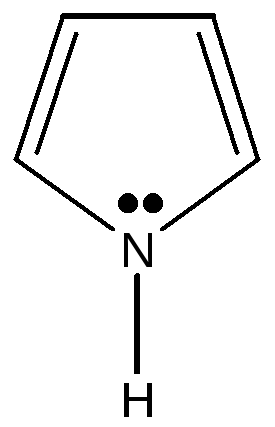
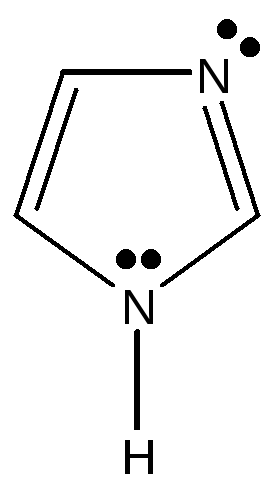
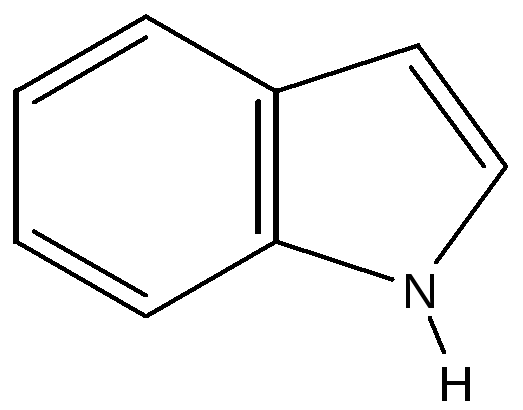
фуран тиофен пиррол имидазол индол
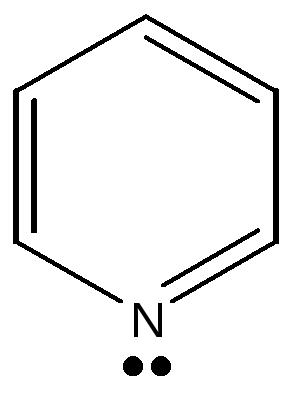
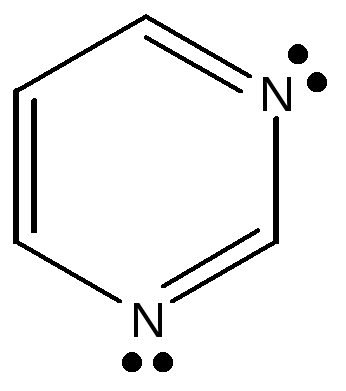
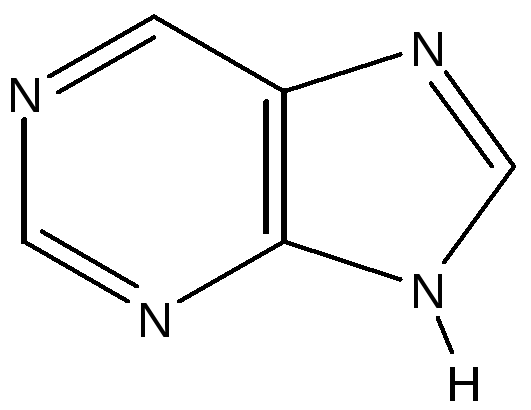
пиридин пиримидин пурин
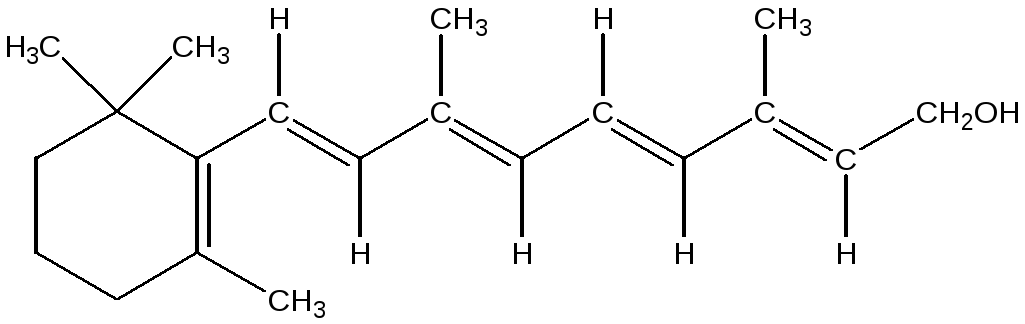 витамин А (ретинол)
витамин А (ретинол)
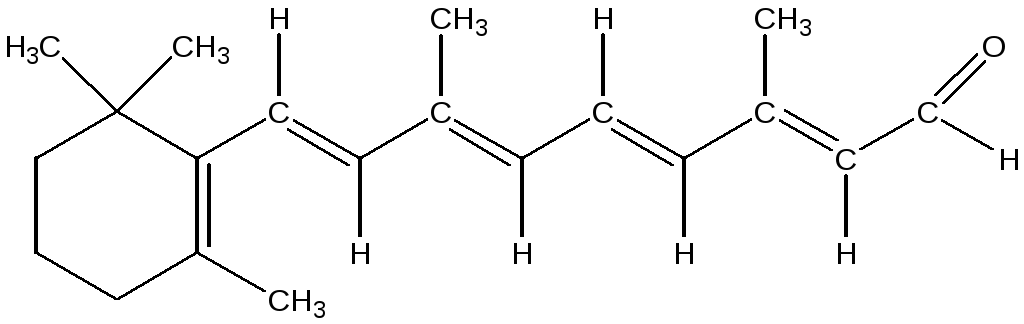 витамин
А (ретиналь)
витамин
А (ретиналь)