
- •Содержание
- •Методика обработки результатов измерений
- •Оценка случайной погрешности прямых измерений
- •Обработка результатов прямых измерений
- •Погрешность при однократных измерениях
- •Погрешности косвенных измерений
- •Литература
- •Лабораторная работа № 1 Измерение линейных величин
- •Теория линейного нониуса. Штангенциркуль
- •Микроскопический винт. Микрометр
- •Выполнение работы
- •Контрольные вопросы
- •Литература
- •1. Иверонова в. А. Физический практикум. - м., 1962. С. 35 - 40.
- •Лабораторная работа № 2 Изучение законов вращательного движения на крестообразном маятнике Обербека
- •Выполнение работы
- •Описание установки
- •Выполнение работы
- •Контрольные вопросы
- •Теория метода и описание установки
- •Выполнение работы
- •Контрольные вопросы
- •Теория метода и описание установки
- •Выполнение работы
- •Вычислить
- •Контрольные вопросы
- •Описание установки
- •Порядок выполнения работы
- •Контрольные вопросы
- •I. Метод Ребиндера
- •Выполнение работы
- •Вычисления
- •II. Метод отрыва кольца от поверхности жидкости
- •Выполнение работы
- •Вычисления
- •Контрольные вопросы
- •Выполнение работы
- •Вычисления
- •Контрольные вопросы
- •Теория метода и описание установки
- •Выполнение работы
- •Контрольные вопросы
- •Теория метода и описание установки
- •Контрольные вопросы
- •Классификация электроизмерительных приборов по принципу действия
- •Приборы магнитоэлектрической системы
- •Приборы электромагнитной системы
- •Приборы электродинамической системы
- •Приборы других систем Тепловая система
- •Термоэлектрическая система
- •Электронная система
- •Индукционная система
- •Основные приборы, применяемые в физической лаборатории
- •Выбор электроизмерительного прибора
- •Задание к лабораторной работе и порядок ее выполнения
- •Общие указания
- •Контрольные вопросы
- •Литература
- •Лабораторная работа № 12 Изучение прозрачной дифракционной решетки
- •Описание прибора
- •Выполнение работы
- •Контрольные вопросы
- •Литература
- •Лабораторная работа № 13
- •Введение
- •Задания к выполнению работы
- •Литература
- •1. Сила света электрических ламп накаливания
- •2. Нормы освещенности в помещениях
- •3. Примерные значения освещенности в различных случаях, лк:
- •Лабораторная работа № 14 Изучение атомных спектров
- •Выполнение работы
- •Контрольные вопросы
- •Литература
- •Справочные материалы
- •644099, Омск, ул. Красногвардейская, 9
Теория метода и описание установки
Универсальную газовую постоянную можно определить из уравнения Менделеева-Клапейрона:
PV
= ![]()
Все параметры газа, входящие в уравнение, можно измерить непосредственно за исключением массы газа, так как взвешивание возможно только вместе с сосудом, в который заключен газ.
Поэтому для определения R из уравнения необходимо исключить массу сосуда. Это можно сделать, рассмотрев уравнения состояния двух масс Ml и М2 одного и того же газа при неизменных температурах и объеме V. Рассмотрение уравнения состояния Мендпеева-Клапейрона для двух значений массы газа дает следующее выражение для универсальной газовой постоянной:
R
= ![]() (*)
(*)
Следовательно, если определить давление P1 и температуру Т для некоторой массы M1, заключенной в сосуде объемом V, а затем изменить массу M1 газа в том же сосуде до величины М2 (например, путем откачки или нагнетания газа), и вновь определить давление Р2 при той же температуре Т, то по формуле (*) легко рассчитать универсальную газовую постоянную.
Общий вид представлен на рис. 8.
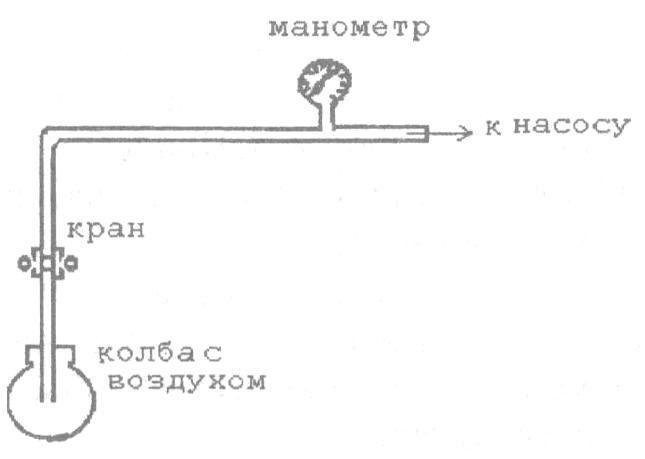
Рис. 8
Выполнение работы
1. Взвесить колбу на аналитических весах и определить суммарную массу (Мо + M1) колбы (Мо) и содержащегося в ней воздуха (Ml).
-
Соединить колбу с манометром и насосом и откачать (или накачать) воздух до некоторого давления Р2. При этом манометр показывает разность между атмосферным давлением P1 и давлением в колбе Р2.
-
Закрыть краны и на аналитических весах вновь определить суммарную массу (Мо + M1) колбы (Мо) и содержащегося в ней воздуха (М2).
-
Определить массу откаченного воздуха как разность:
(Мо + М1) - (Мо + М2) = М1 – М2.
-
Измерить температуру воздуха в лаборатории.
6.Подсчитать по формуле (*) универсальную газовую постоянную.
-
Опыт произвести не менее трех раз.
-
Все данные внести в таблицу.
-
Рассчитать среднее значение R и сравнить его с теоретическим значением.
10. Определить основные источники погрешности при измерениях и оценить точность определения R.
Контрольные вопросы
-
Изопроцессы. Законы, которым они подчиняются. Графики процессов.
-
Уравнение Менделеева-Клапейрона. Каков физический смысл величин, входящих в это уравнение? Как из этого уравнения получить законы Бойля-Мариотта, Гей-Люссака, Шарля?
-
Физический смысл, единицы измерения, численное значение универсальной газовой постоянной.
-
Чем отличается идеальный газ от реального?
-
Что такое моль? Киломоль? Какое количество молекул находится в 1 киломоле и 1 моле вещества? Объем моля и киломоля газа при нормальных условиях.
-
Что такое 1 атм; 1 ат? Соотношения этих единиц измерения давления с другими.
-
Цель данной лабораторной работы. Какие физические величины непосредственно измеряются на опыте?
-
Как в данной работе определяется масса выкаченного газа? Какое давление показывает манометр?
Литература
1. Савельев И. В. Курс общей физики: Учебное пособие.T l. - М.: Наука, 1986. - 432 с.
Лабораторная работа № 5
Определение отношения Cp/Cv методом
адиабатического расширения
Введение
С
(1)
dQ = dU + dA.
Количество теплоты, необходимое для нафевания одного киломоля газа на один градус, определяется молярной теплоемкостью -С.
Величина теплоемкости зависит от условий нагревания. Различают два вида теплоемкостей: Ср - молярная теплоемкость при постоянном давлении и Cv - молярная теплоемкость при постоянном объеме, связанных между собой уравнением:
Cp = Cv + R, (2)
где R - универсальная газовая постоянная, численно равная работе, совершаемой при нагревании одного моля идеального газа на один Кельвин при постоянном давлении.
Процесс, протекающий без теплообмена с окружающей средой (dQ = 0), называется адиабатическим. Он описывается уравнением Пуассона:
р![]() = const,
(3)
= const,
(3)
где
![]()
Работа адиабатического процесса, как следует из I начала термодинамики (3), совершается только за cчет изменения внутренней энергии:
dA = dU. (4)
Полная работа адиабатического процесса может быть вычислена
по формуле:
A
= ![]() .
(5)
.
(5)
Приборы и принадлежности: жидкостный манометр, закрытый стеклянный баллон с трехходовым краном, насос.
