
- •І. Програма курсу
- •Тема 1. Основні поняття хімії
- •Тема 2. Будова атомів. Періодичний закон і періодична система д.І. Менделєєва
- •Тема 3. Хімічний зв’язок і будова молекул. Твердий стан речовин
- •Тема 4. Елементи хімічної термодинаміки
- •Тема 5. Хімічна кінетика та хімічна рівновага
- •Тема 6. Загальні властивості розчинів. Розчини електролітів
- •Тема 7. Окисно-відновні реакції
- •Тема 8. Електрохімічні процеси
- •Тема 9. Хімічні властивості металів
- •Іі. Контрольні задачі Загальні вказівки
- •1. Основні поняття хімії Короткі теоретичні відомості
- •2. Будова атомів. Періодичний закон та періодична система хімічних елементів д.І. Менделєєва Короткі теоретичні відомості
- •3. Хімічний зв’язок і будова молекул Короткі теоретичні відомості
- •4. Елементи хімічної термодинаміки Короткі теоретичні відомості
- •5. Хімічна кінетика та хімічна рівновага Короткі теоретичні відомості
- •6. Розчини. Способи вираження концентрацій. Фізичні властивості розведених розчинів неелектролітів Короткі теоретичні відомості
- •7. Розчини електролітів. Електролітична дисоціація сильних і слабких електролітів. Закон роЗбавляння. Водневий показник Короткі теоретичні відомості
- •8. Реакції обміну в розчинах електролітів. Іонно-молекулярні рівняння хімічних реакцій Короткі теоретичні відомості
- •9. Окисно-відновні реакції. Хімічні властивості металів Короткі теоретичні відомості
- •10. Електрохімічні процеси. Гальванічні елементи Короткі теоретичні відомості
- •11. Електрохімічна корозія металів і сплавів Короткі теоретичні відомості
- •12. Електроліз Короткі теоретичні відомості
- •Кількісні розрахунки електролізу треба виконувати згідно з законом Фарадея:
- •Ііі. Лабораторні роботи Лабораторна робота №1 Класи неорганічних сполук
- •Ознакою перебігу хімічної реакції є утворення або розчинення осаду.
- •Лабораторна робота №2 Теплові ефекти процесів
- •Порядок виконання роботи
- •Обробка результатів
- •Лабораторна робота №3 Хімічна кінетика
- •Лабораторна робота №4 Розчини електролітів
- •1. Одержання та дослідження особливостей слабких електролітів
- •2. Визначення рН контрольного розчину електроліту
- •Лабораторна робота №5 Електрохімічні процеси
- •1. Мідно-цинковий гальванічний елемент
- •2. Контактна корозія
- •3. Електроліз
- •Лабораторна робота №6 Окисно-відновні реакції
- •1. Окисні властивості сульфатної кислоти.
- •2. Окисні властивості іонів металу.
- •3. Окисно-відновна двоїстість пероксиду гідрогену
- •IV. Додатки
- •Список рекомендованої літератури
1. Основні поняття хімії Короткі теоретичні відомості
Атоми та молекули мають дуже малі абсолютні маси, які неможливо вимірити ніякими технічними пристроями. Тому в хімії та фізиці використовують так звані відносні атомні та молекулярні маси Аr(Х) і Мr(Х) відповідно (Х – хімічна формула речовини). За одиницю вимірювання при цьому береться маса 1/12 атома Карбону (ізотопу С12). Отже, відносна атомна або молекулярна маса показує, у скільки разів абсолютна маса даної частинки m0 більша за масу 1/12 атома Карбону:
Ar(X)
або Mr(X)
=![]() .
.
Наприклад, Ar(С) = 12, Ar(О) = 16, Ar(Н) = 1 тощо.
Відносні атомні та молекулярні маси розмірності не мають. Відносна молекулярна маса дорівнює сумі відносних атомних мас елементів з урахуванням кількості атомів цих елементів у молекулі, наприклад:
Mr(О2) = 2 16 = 32;
Mr(СО) = 12 + 16 = 28;
Mr(СО2) = 12 + 2 16 = 44;
Mr(CH4) = 12 + 4 1 = 16.
Речовина вимірюється її кількістю. Під кількістю речовини розуміють певне число окремих частинок цієї речовини (атомів, молекул, іонів тощо) N, або N(X). Але так робити кількісні розрахунки незручно, тому введено спеціальну одиницю кількості 1 моль, який містить так зване число Авогадро частинок NА 6,02 1023 моль1. Абсолютна маса числа Авогадро (тобто одного моля) атомів Карбону дорівнює 12 грамам. Тоді маси одного моля атомів Оксигену, молекул O2, СО, СО2 і CH4 дорівнюють 16, 32, 28, 44 і 16 грамам відповідно.
Маса одного моля речовини називається молярною масою. Вона позначається літерою М, або М(Х), і має розмірність г/моль. Чисельно молярна маса дорівнює відносній молекулярній масі. Кількість молів (або просто кількість) речовини позначають n, або n(X). Для певної маси будь-якої речовини m(X) кількість речовини дорівнює:
n(x)
=
![]() =
=
![]() ,
,
а абсолютна маса однієї молекули цієї речовини
m0(Х)
=
![]() .
.
Наприклад, для Карбону m0(С) = 12/(6,02 1023) 1,99 1023 г.
При розв’язанні типових задач за цією темою потрібно знати універсальний закон, що діє для газів – закон Авогадро: у рівних об’ємах різних газів, взятих за однакових умов (тиск р і температура Т), міститься однакова кількість молекул.
Наслідки з цього закону:
1. 1 моль будь-якого газу за нормальних умов (р = 1,013 105 Па; Т = 273 К) займає об’єм 22,4 літри. Цей об’єм називають молярним об’ємом газу. Він позначається VМ, або VМ(Х), і має розмірність л/моль. Кількість газоподібної речовини через молярний об’єм дорівнює:
n(x)
=
![]() .
.
2. Відносна густина одного газу (Х) за іншим (Y), DY(X), це відношення мас рівних об’ємів цих газів, взятих за однакових умов, або відношення їх молярних мас:
DY(X)
=
![]() .
.
Приклад 1. Маса 5,6 л (н. у.) деякого газу дорівнює 10 г. Обчисліть для цього газу молярну та відносну молекулярну маси, масу однієї молекули у грамах, кількість речовини та кількість молекул у цьому об’ємі.
Розв’язання. Складаємо пропорцію та знаходимо кількість молів газу:
VМ 1 моль
V х,
звідки
х = n =
![]() =
=
![]() = 0,25 (моль).
= 0,25 (моль).
Знаючи кількість речовини, розраховуємо молярну масу:
М
=
![]()
![]() = 40 (г/моль).
= 40 (г/моль).
Відносна молекулярна маса газу чисельно дорівнює молярній масі:
Мr = 40.
Абсолютна маса однієї молекули:
m0
=
![]() =
=
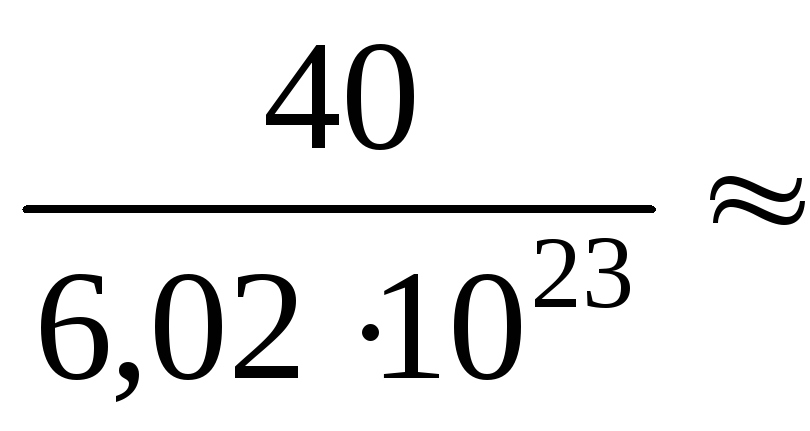 6,66
1023
(г).
6,66
1023
(г).
Кількість молекул:
N = nNA = 0,25 6,02 1023 = 1,505 1023.
При розв’язанні багатьох задач треба вміти робити розрахунки згідно з рівняннями хімічних реакцій. При цьому необхідно знати, що коефіцієнти перед формулами речовин у рівнянні (т. з. стехіометричні коефіцієнти) дають кількісні (мольні) співвідношення реагентів і продуктів реакції. Наприклад, у реакції 2Al + 6HCl = 2AlCl3 + 3H2 на кожні 2 моль Al витрачається 6 моль HCl. При цьому утворюється 2 моль AlCl3 і 3 моль H2.
Приклад 2. Для наведеної вище реакції розрахувати масу хлориду алюмінію AlCl3 і об’єм водню Н2 (н. у.), якщо у реакції беруть участь 5,4 г алюмінію.
Розв’язання. Ar(Al) = 27, Mr(AlCl3) = 106,5. Згідно з рівнянням реакції 1 моль (тобто 27 г) Al відповідає 1 моль (або 133,5 г) AlCl3. Тому складаємо пропорцію:
27 г Al 133,5 г AlCl3
5,4 г х,
звідки
х
= m(AlCl3)
=
![]() = 26,7 (г).
= 26,7 (г).
Також діємо при розрахунку об’єму водню:
2 27 г Al 3 22,4 л H2
5,4 г у,
звідки
у = V(H2) =
![]() = 6,72 (л).
= 6,72 (л).
Задачі
-
Маса молекули деякої речовини становить 1,21025 кг. Чому дорівнюють відносна молекулярна та молярна маси цієї речовини? Яку кількість містить 1 кг цієї речовини?
-
Маса 1103 м3 газу (н.у.) дорівнює 1,175103 кг. Розрахуйте молекулярну масу газу і масу однієї його молекули. Яке число молекул газу знаходиться у даному об’ємі?
-
Чому дорівнюють молекулярна, молярна маси та маса однієї молекули СО2? Який об’єм СО2 (н.у.) утвориться при згорянні 1,2102 кг вуглецю? Яке число молекул цього газу буде знаходитись у цьому об’ємі?
-
Порівняйте число молекул, які містяться у 4 кг кожного з газів: СО2 і NO2. Визначте кількості цих речовин і об’єми, що займають гази за н.у.
-
Маса 8,7105 м3 газу при 62 С і тиску 1,01105 Па дорівнює 2,4104 кг. Розрахуйте молекулярну масу речовини і масу однієї його молекули.
-
Які об’єм і маса оксиду нітрогену (II) утворюються при взаємодії 51020 молекул азоту з киснем? Чому дорівнюють молекулярна і молярна маси, маса однієї молекули NO?
-
Яка кількість речовини і скільки молекул містяться: а) 0,1 м3 водню (н.у.); б) 0,1 кг водню? Чому дорівнює маса однієї молекули Н2?
-
В якій масі СО2 міститься стільки ж молекул, скільки їх у 2,8103 кг СО? Які кількості речовин містяться у цих масах?
-
При розпіканні СаСО3 масою 1 кг одержані СаО масою 0,56 кг і СО2 об’ємом 0,224 м3 (н.у.). Чи підтверджують ці дані закон збереження маси речовин? Визначте число молекул і кількість речовини СО2 у наведеному об’ємі?
-
Чому дорівнюють молярна маса та маса однієї молекули метану (СН4)? Складіть рівняння реакції горіння метану на повітрі і розрахуйте об’єм і масу цього газу, якщо на його згоряння витрачено 112 л кисню.
-
Визначте масову частку домішок (%) у технічному цинку, якщо його наважка масою 20,4 г витісняє з соляної кислоти, взятої у надлишку, водень об’ємом 6,272 л (н.у.)? Яку кількість речовини становить указаний об’єм водню? Скільки молекул газу містяться у ньому?
-
Змішано рівні за масою (10 г) кількості газів: водню Н2, метану СН4 і азоту N2. Розрахуйте об’єм (н.у.) газової суміші, масу одного її літру (н.у.), загальне число молекул усіх газів у 1 л суміші.
-
Для газоподібних азоту N2 і оксиду карбону (II) CО визначити: а) співвідношення об’ємів рівних мас цих газів; б) маси 1 л газів; в) молярні маси і маси однієї молекули кожного з цих газів.
-
Маси 1 л наведених газів дорівнюють: а) ацетиленy 1,17 г; б) гелію 0,17 г; в) етану 1,36 г. Визначте молекулярні, молярні маси і маси однієї молекули кожного газу. Використовуючи величину відносної густини одного газу за іншим, визначте, який газ важчий, а який легший за повітря?
-
У три склянки з водою опущено по 1 граму металів: у першу натрію, у другу калію, у третю кальцію. В якому випадку виділиться найбільша кількість водню? Розрахуйте кількість, масу та об’єм водню у цій реакції. Чому дорівнює маса однієї молекули Н2?
-
Розрахуйте об’ємну частку оксиду карбону (II) СО у газовій суміші складу 3СО + 5N2 + 2СО2? Яка густина цієї суміші за повітрям?
-
Визначте масу 1 л газової суміші складу (н.у.): СО + 2N2 (генераторний газ). Яка кількість молів і яке число молекул кожного газу знаходяться у цьому об’ємі?
-
Дана газова суміш складу 3СО + 7СО2. Розрахуйте: а) середню молекулярну масу суміші; б) масу 1 л суміші (за н.у.); в) густину суміші за воднем; г) масу 10 л суміші (н.у.); д) об’єм 1 кг суміші (н.у.).
-
Газоподібна речовина масою 0,08 г займає об’єм 11,2 мл за н.у. Розрахуйте молярну, молекулярну маси та масу однієї молекули цього газу. Яка кількість молів речовини і яке число молекул знаходяться у цій масі газу?
-
Яка і в якому об’ємі (н.у.) знаходиться кількість молекулярного азоту (моль), якщо вона містить 1,2 1022 молекул? Розрахуйте масу цієї кількості газу.
-
В ємності змішано гази: СО2, О2 і N2, маси яких відповідно становлять 11, 16 і 21 г. В яких об’ємних співвідношеннях змішано ці гази? Розрахуйте середню молекулярну масу цієї газової суміші та її густину за киснем.
-
При згорянні аміаку в кисні у присутності платинового каталізатора утворюються газоподібний оксид нітрогену (II) NO і водяний пар. У яких об’ємних і масових співвідношеннях реагують аміак і кисень? Розрахуйте кількість, масу та об’єм (н.у.) NO, який утворився, якщо прореагувало 10 л (н.у.) NH3.
-
Відносна густина газу за воднем становить 8,5. Чому дорівнює молекулярна, молярна маси цього газу, маса однієї його молекули? Визначте кількість речовини (моль) і об’єм (н.у.), який займає 1,7 кг газу.
-
Двохвалентний метал масою 2 г витісняє з розчину хлоридної кислоти 1,12 л (н.у.) водню. Визначте, який це метал. Чому дорівнює маса водню, який утворився, скільки його молекул містяться у цьому об’ємі?
-
Маса молекули деякої речовини дорівнює 21022 г. Чому дорівнюють молекулярна та молярна маси цієї речовини? Скільки молекул містяться у 10 г речовини? Яку кількість молів це складає?
