
- •Введение. История развития генетики
- •Предмет генетики
- •2. Краткая история развития представлений о наследственности
- •3. Вклад ученых в развитие генетики
- •4. Вклад белорусских ученых в развитие генетики
- •Основными направлениями работы в настоящее время исследований являются:
- •Основные научные и практические достижения: Исследовательские гранты
- •Продукция и услуги:
- •Материальные основы наследственности Лекция 3 Клетка как основа наследственности и воспроизведения
- •Клеточные и неклеточные формы организации живого: эукариоты, прокариоты, вирусы
- •Нуклеиновые кислоты. Структурная модель днк Дж. Уотсона и ф. Крика.
- •Литература
- •2. Наднуклеосомная укладка днк
- •3. Хромомерная организация хромосом
- •4. Митотические хромосомы
- •5. Кариотип и идиограмма
- •Материальные основы наследственности
- •2.Непрямое деление клетки. Амитоз. Эндомитоз
- •3. Мейоз и его значение
- •4. Краткий обзор этапов гаметогенеза
- •Закономерности наследования признаков
- •Лекция 6
- •Наследование при моногибридных и
- •Полигибридных скрещиваниях
- •1. Цели и задачи генетического анализа
- •2.Генетическая символика
- •3. Первый закон г. Менделя – закон единообразия гибридов первого поколения
- •4. Второй закон Менделя
- •5. Неполное доминирование и кодоминирование
- •6. Анализирующее (реципрокное) скрещивание
- •7. Дигибридные скрещивания. Тригибридное скрещивание
- •Закономерности наследования признаков Лекция 7 Взаимодействие генов
- •1. Типы взаимодействия неаллельных генов: комплементарность, эпистаз, полимерия. Гены – модификаторы.
- •Наследование окраски цветков у Lathyrus odoratus при взаимодействии двух пар генов
- •Наследование формы плода у Cucurbita pepo при взаимодействии двух пар генов
- •Наследование окраски глаз у Drosophila при взаимодействии двух пар генов
- •Эпистаз у лошадей
- •Рецессивный эпистаз у мышей
- •Наследование и изменчивость длины початков (в сантиметрах) у Zea mays в f1и f2
- •Наследование формы стручка у Capsella bursa pastoris при взаимодействии двух пар генов
- •2. Пенетрантность и экрессивность. Норма реакции. Плейотропный эффект гена.
- •Закономерности наследования признаков Лекция 8-9 Генетика пола и наследование признаков, сцепленных с полом. Сцепление генов и кроссинговер. Нехромосомное (цитоплазматическое) наследование
- •1.Пол как признак. Половой диморфизм. Первичные и вторичные половые признаки.
- •2. Определение пола.
- •Половые различия между самкой и самцом у морского червя Bonellia viridis
- •3. Гинандроморфы, интерсексы, гермафродиты и другие половые отклонения
- •Билатеральный гинандроморф y Drosophila melanogastei
- •4. Наследование признаков сцепленных с полом.
- •5.Сцепление генов и кроссинговер. Генетические доказательства перекреста хромосом
- •6. Частота кроссинговера и линейное расположение генов в хромосоме. Цитологические доказательства кроссинговера
- •7.Митотический (соматический) кроссинговер. Факторы, влияющие на кроссинговер
- •8. Нехромосомное (цитоплазматическое) наследование
- •Молекулярные основы наследственности (4 часа)
- •2.Способы передачи наследственной информации у бактерий
- •3. Репликация днк
- •Модели репликации днк:
- •Строение репликационной вилки
- •Расположение основных белков в репликационной вилке
- •4. Репарация днк
- •Молекулярные основы наследственности (4 часа)
- •2. Генетический код
- •3. Трансляция
- •4. Передача информации в клетке
- •Изменчивость (6 часов) Лекция 12 Изменчивость, комбинативная и мутационная изменчивость
- •1. Классификация изменчивости. Понятие о наследственной и ненаследственной изменчивости.
- •1.1 Изменчивость наследственного материала
- •1.2 Ненаследственная изменчивость
- •1.3 Наследственная изменчивость
- •2. Мутационная теория и классификация мутаций
- •Мутации у различных организмов
- •3. Генеративные и соматические мутации. Прямые и обратные мутации
- •4. Множественные аллели
- •5. Условные мутации
- •Изменчивость (6 часов) Лекция 13-14 Мутации: генные, хромосомные, геномные. Модификационная изменчивость
- •1. Генные мутации
- •2. Хромосомные перестройки
- •2.1. Делеции
- •2.2. Дупликации
- •2.3. Инверсии
- •2.3. Транслокации
- •3. Геномные мутации. Полиплоидия
- •4. Автополиплоидия
- •Диплоидный (а), триплоидный (б) и тетраплоидный (в) арбузы
- •Образование растения Raphanobrassica в результате скрещивания редьки и капусты. Следует обратить внимание на форму плода у родителей и гибрида
- •5. Аллополиплоидия (амфиполиплоидия)
- •6. Анеуплоидия
- •7. Гаплоидия
- •8. Системные мутации. Спонтанные мутации
- •9.Закон гомологических рядов наследственной изменчивости н.И. Вавилова
- •10. Ненаследственная изменчивость
- •Внизу -стрелолист с надводными, плавающими и подводными листьями
- •Литература
- •Генетические основы онтогенеза (2 часа) Лекция 15 Онтогенез – как реализация генетической информации
- •1. Дифференцировка и детерминация
- •2.Эпигеномная наследственность
- •3. Транскрипция и амплификация генов в оогенезе
- •4. Дифференциальная активность генов в онтогенезе
- •5. Роль генетических факторов в определении продолжительности жизни
- •6. Молекулярные основы процесса старения и генетическая картина онтогенеза
- •Литература
- •1. Генетическая структура популяций. Типы популяций
- •2. Генетическая структура популяции апомиктов
- •3. Генетическая структура популяции самоопылителей
- •4. Генетическая структура популяций перекрестноразмножающихся организмов
- •Основные факторы генетической динамики популяций
- •Литература
- •Генетика человека (4 часа) Лекции 17, 18 Человек как объект генетических исследований
- •1. Человек как объект генетических исследований
- •2. Генеалогический метод
- •Составление родословной
- •Генетический анализ родословной
- •3.Близнецовый метод
- •4. Популяционно-статистический метод
- •5. Цитогенетический метод
- •6. Метод генетики соматических клеток
- •7. Биохимический метод
- •8. Молекулярно-генетический метод
- •9. Видимое строение хромосом человека и их морфология. Классификация и тонкая структура хромосомы
- •Генетические основы селекции (6 часов)
- •2.Исходный материал в селекции
- •3.Системы скрещивания в селекции растений и животных
- •4.Явление гетерозиса. Генетические механизмы гетерозиса.
- •Литература
- •2. Индивидуальный и массовый отборы
- •3. Подбор
- •Литература
- •Основы биометрии (8 часов) Данные в биологии (2 часа)
- •Описательная статистика (2 часа)
- •Основы дисперсионного анализа. Корреляционный анализ (4 часа)
3. Трансляция
Трансляция(перевод) – процесс воплощения генетической информации мРНК в структуру полипептида. Это второй этап белкового синтеза, осуществляемый последовательной поликонденсацией отдельных аминокислотных остатков, начиная с аминоконца полипептидной цепи к карбоксильному концу.
Зрелая матричная РНК выходит в цитоплазму, где осуществляется процесс транскрипции – декадирование мРНК в аминокислотную последовательность белка. Процесс декадирования осуществляется в направлении от 5`→3` и происходит в рибосомах. Комплекс мРНК и рибосом называется полисомой. Подобно транскрипции механизм трансляции состоит из трех этапов: инициации, элонгации и терминации.
Трансляция начинается со стартового кодона АУГ, который при локализации в смысловой части структурного гена кодирует аминокислоту метионин. Каждую аминокислоту доставляет к полисоме транспортная РНК (тРНК), специфичная к данной аминокислоте. тРНК выполняет роль посредника между кодоном мРНК и аминокислотой. Молекулы тРНК узнают в цитоплазме соответствующий триплет (кодон в мРНК) по принципу спаривания комплементарных азотистых оснований. тРНК, которая подходит к малой субчастице, образует связь кодон-антикодон, при этом одновременно передает свою аминокислоту в аминоацильный участок (А-участок) большой субъединице. К кодону АУГ «подходит» антикодон только той тРНК, которая переносит метионин. Поэтому прежде всего к рибосоме доставляется метионин. Затем кодон АУГ переходит на пептидильный участок большой субъединицы (Р-участок). В результате этих процессов образуется транслирующая рибосома – инициирующий комплекс.
Элонгация– это последовательное включение аминокислотных остатков в состав растущей полипептидной цепи. Каждый акт элонгации состоит из трех этапов:
- узнавание кодона, которое заключается в связывании антикодона с очередной молекулой тРНК, несущей аминокислоту, с кодоном свободного А-участка на рибосоме;
- образование пептидной связи, которое происходит лишь тогда, когда оба участка А и Р заняты молекулами тРНК. Часть большой субъединицы рибосомы – фермент пептидилтрансферазу, катализирующий образование пептидной связи;
- транслокация, где тРНК участка Р, не связанная с пептидом, покидает рибосому. Затем молекула тРНК с полипептидом переходят из А на Р-участок и, наконец, рибосома перемещается вдоль РНК на один кодон.
Терминация(окончание синтеза) происходит по команде кодонов УАА, УАГ, УГА. В природе не существует таких молекул тРНК, антикодоны которых соответствовали бы этим кодонам.
Каждая мРНК транслируется, как правило, несколько раз, после чего разрушается. Среднее время жизни молекулы мРНК около 2 мин. Разрушая старые и образуя новые мРНК, клетка может довольно строго регулировать как тип продуцируемых белков, так и их количество. Это регуляция синтеза белка на уровне транскрипции. У эукариот возможна регуляция и на уровне трансляции.
Синтез белка – один из существеннейших показателей жизни.
4. Передача информации в клетке
Современные представления о роли ДНК в передаче наследственной информации лучше всего отражает "Центральная догма молекулярной биологии", сформулированная Ф. Криком в 1970 году.
Автор предложил разделить все виды переноса биологической информации в клетке на три группы:
1. Процессы, существование которых уже показано: ДНК → ДНК, ДНК → РНК, РНК → белок, РНК → РНК.
2. Процессы, которые не были экспериментально выявлены и с теоретической точки зрения не казались строго необходимыми: РНК → ДНК, ДНК → белок.
3. Невозможные переносы: белок → белок, белок → РНК, белок → ДНК. Таким образом, информация во всех случаях в клетке переносится однонаправленно по цепи: ДНК →РНК → белок. Белок не может служит матрицей для синтеза ДНК или РНК, поскольку у молекул белка нет свойства комплементарности отдельных частей молекулы, что бы позволяло использовать её как матрицу.
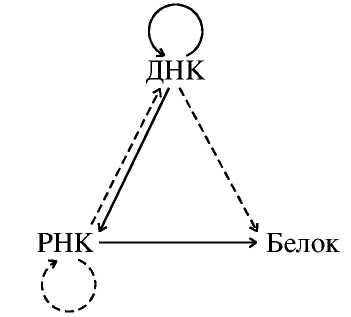
"Центральная догма молекулярной биологии". Сплошные стрелки показывают обычный путь переноса генетической информации, пунктирной - более редкие пути, также существующие в природе
Синтез одной молекулы белка, состоящего из 150 аминокислот, идет примерно за 1,5 минуты, т. е. со скоростью 2 аминокислоты в секунду. Он зависит от многих факторов. Например, состояние рибосомы может оказать влияние на считывание информации. Рибосома «читает с ошибками», если на нее воздействовать какими-либо внешними факторами, к примеру облучением, химическими веществами, способными изменять структуру и функцию рибосомы.
Однако если переносы типа ДНК→ДНК, ДНК→РНК, РНК→РНК и РНК→белок имели экспериментальные прямые или непрямые доказательства, то в пользу других переносов доводов и теоретических обоснований в то время не было.
Изучение механизмов взаимодействия с клеткой опухолеродных вирусов натолкнуло на мысль о возможности существования иных типов связей. В 1969-1971 гг. Р. Дульбекоэкспериментально доказал, что ДНК опухолеродного вируса прочно связывается с ДНК клетки, находя в ее хромосомах тайное убежище. Но опухолеродные вирусы делятся на две большие группы: ДНК-содержащие и РНК-содержащие. Включение вирусной ДНК в ДНК клетки и их интеграцию представить легко. Но как применить эту гипотезу к РНК-содержащим вирусам?
В 60-х годах Г. Теминвысказал предположение, согласно которому «жизненный цикл» РНК-содержащих опухолеродных вирусов должен включать стадию образования ДНК-продукта — провируса. Это явно противоречило центральной догме молекулярной биологии, гласившей, что генетическая информация передается тольков одном направлении: ДНК→РНК→белок. Если допустить, что существует и путь РНК→ДНК, то в клетке должен быть и специальный фермент, участвующий в синтезе такого рода.В 1970 г. Г. Темин и С. Мизутаниобнаружилив составе вируса саркомы Рауса (РНК-содержащий вирус)фермент, способный синтезировать ДНК на матрице РНК.Этот фермент назвали обратной транскриптазой или РНК-зависимой ДНК-полимеразой (ревертазой, по В. А. Энгельгардту). Одновременно Д. Балтимор обнаружил фермент, синтезирующий ДНК, у вируса миелобластоза птиц. Ревертаза в настоящее время найдена во всех без исключения РНК-содержащих опухолеродных вирусах.В 1975 г. Р. Дульбеко, Г. Темину и Д. Балтимору была присуждена Нобелевская премия за открытие процесса передачи наследственной информации, который получил название обратной транскрипции. Формула центральной догмы молекулярной биологии дополнилась:
ДНК ← → РНК → белок
Процесс обратной транскрипции состоит из двух этапов. Сначала на РНК-матрице синтезируется нить ДНК, т. е. образуется промежуточный продукт реакции, состоящий из гибридных молекул, одна нить которых — вирусная РНК, другая — комплементарная ей синтезированная нить ДНК. На ДНК-вой нити гибридной молекулы синтезируется вторая нить ДНК и получается конечный продукт реакции — двухцепочечная спиральная молекула ДНК, содержащая генетическую информацию, полностью переписанную с вирусной РНК.Оба этапа осуществляются, по-видимому, одним и тем же вирусным ферментом, точнее, его активным центром, т. е. ревертаза обладает и РНК-зависимой и ДНК-зависимой ДНК-полимеразной активностью и ведет всю реакцию от начала до конца.
Открытие ревертазы натолкнуло на мысль, что путем выявления ее в клетках можно осуществлять раннюю и быструю диагностику злокачественных опухолей и лейкозов. Однако вскоре обнаружилось, что ревертазы свойственны и тканям здоровых, не зараженных вирусами организмов. Особенно много их оказалось в эмбриональных клетках. Тем не менее существуют количественные различия ревертаз в опухолевых и нормальных клетках, за исключением эмбриональных. Установлены также различия в активности и физико-химических свойствах ревертаз онкогенных вирусов и нормальных клеток. Несомненно, обратная транскрипция нужна для злокачественной трансформации.
Наличие ревертазы во всех нормальных клетках свидетельствует о возможности передачи информации от РНК к ДНК. Но с какой целью? Отмечено, что на определенной стадии эмбриогенеза в клетках амфибий резко возрастает число генов, кодирующих рибосомальную РНК. Вместо двух копий (2 гомологичные хромосомы) в клетках обнаруживается по несколько сотен копий каждого гена, которые определенный период эмбриогенеза функционируют изолированно от хромосомы, а затем разрушаются. В 1971 г. Тартоф открыл такое же явление и у дрозофилы. Оно былоназвано амплификацией генов. Механизм амплификации не известен. Однако установлено, что в условиях повышенного требования синтеза белка в клетке происходит размножение генов рибосомальной РНК методом обратной транскрипции. Это обеспечивает синтез РНК не на хромосомной матрице, а на матрице генов, образующихся в цитоплазме. Очевидно, амплификация генов играет существенную роль в регуляции феногенетических процессов и происходит всегда, когда требуется увеличить количество белка.
Литература
Айала, Ф. Современная генетика / Ф. Айала, Дж. Кайгер. – М.: Мир, 1987. – Т.1. – 295 с; Т.2. – 368 с; Т.3.
Алиханян, С. И. Общая генетика / С. И. Алиханян, А. П. Акифьев, Л. С. Чернин. – М.: Высш. шк., 1985.
Бокуть, С. Б. Молекулярная биология: молекулярные механизмы хранениия, воспроизведения и реализации генетической информации / С. Б. Бокуть, Н. В. Герасимович, А. А. Милютин. – Мн.:Высш. шк., 2005.
Дубинин, Н. П. Общая генетика / Н. П. Дубинин. – М.: Наука, 1986.
Жимулев, И. Ф. Общая и молекулярная генетика / И. Ф. Жимулев. – Новосибирск: Изд-во Новосибирского ун-та, 2002.
Жученко, А. А. Генетика / А. А Жученко, Ю. Л. Гужов, В. А. Пухальский. – М.: Колос, 2004.
