
- •Занятие 4. Основные понятия кислотно-основного состояния.
- •НсОз--.
- •Истинный бикарбонат (hco3--act).
- •Стандартный бикарбонат (hco3_std).
- •Физиология кислотно-основного состояния.
- •Буферные системы крови.
- •Бикарбонатная буферная система (летучий буфер).
- •Нелетучие буферные системы.
- •Клеточная регуляция кос.
- •Органная регуляция кос
- •Дыхательная система
- •Типы нарушений кос
- •Метаболический ацидоз.
- •Рассмотрение примеров метаболического ацидоза
- •Специфические нарушения, сопровождающиеся метаболическим ацидозом Кетоновый ацидоз
- •Лактоацидоз
- •Отравление салицилатами
- •Снижение экскреции ионов водорода
- •Дыхательный ацидоз
- •Нарушения со стороны нервной системы
- •Нарушения системы кровообращения
- •Изменения показателей кос при остром и хроническом дыхательном ацидозе.
- •Метаболический алкалоз
- •Причины метаболического алкалоза
- •Дыхательный алкалоз
- •Причины гипервентиляции и дыхательного алкалоза
- •Изменения показателей кос при остром и хроническом дыхательном алкалозе.
- •Ожидаемая степень компенсации изменений кос (рСо2 в кПа, нсо3_ в ммолях/л)
Занятие 4. Основные понятия кислотно-основного состояния.
РН.
Понятие кислоты и основания введено в практику Bronsted в 1923 году. В соответствии с предложенным им определением кислотой является вещество, способное отдавать ион водорода Н+ (донатор иона водорода) , а основанием - вещество, способное присоединять Н+ (акцептор иона водорода). Кислотность или щелочность раствора зависит от концентрации в нем свободных ионов Н+, причем изменения этой концентрации могут быть на несколько порядков величин. Оперировать такими значениями часто неудобно. Показателем этой концентрации служит рН. рН представляет собой отрицательный десятичный логарифм молярной концентрации Н+.
Десятичный логарифм - выражение числа в виде степени, в которую нужно возвести 10, чтобы получить это число. Можно представить число 100 как 102 (десять во второй степени) или 10 х 10. Подобно этому 10000 выражается как 104 (10 х 10 х 10 х 10). Дробное число также можно записать по-разному: 1/100 эквивалентно 1/102 или 10-2 ; 1/10000 = 10-4 и т.д. Логарифмическую зависимость удобно использовать для выражения концентрации химических элементов в растворах, так как абсолютные их величины часто бывают исчезающе малыми. Так, если концентрация Н+ в растворе составляет 0,0001 моль/л ( 1/10000 ), то эту концентрацию можно выразить 10 моль/л. рН такого раствора составит 4
Взаимодействие кислот и оснований и их влияние на рН крови описывает уравнение Гендерсона-Гассельбаха:
РН=рК+lg основания/кислоты
где К - константа диссоциации, которая определяет способность отдавать ионы Н+.
Так как К и соответственно рК постоянны при определенной температуре, то
РН=основания/кислоты
из чего следует, что при увеличении количества оснований без повышения содержания кислот, значение рН увеличивается, если растет концентрация кислоты, то рН снижается.
рН артериальной крови обозначается символом " рНа", в норме поддерживается в ограниченном диапазоне между 7,35 и 7,45 единиц. Отклонение рНа за эти границы рассматривается как нарушение КОС. Значения рН ниже 7,35 свидетельствуют об "ацидемии" (выражение для крови) или "ацидозе" (выражение для ткани). Значения рН выше 7,45 указывают на развитие "алкалемии" (выражение для крови) или "алкалоза" (выражение для ткани). В рутинной практике традиционно при анализе крови используют термины «ацидоз» и «алкалоз», которыми мы также будем пользоваться в дальнейшем. Диапазон возможных изменений рНа представлен на рисунке 1. Выход за этот диапазон смертелен.
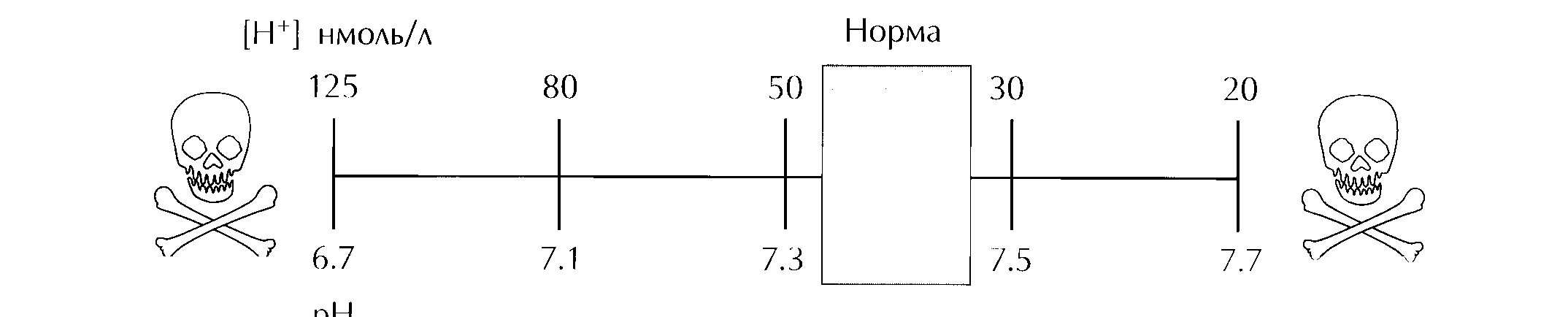
Рис. 1. Диапазон изменения концентрации ионов водорода и рН артериальной крови у человека.
рНа зависит от влияния ряда факторов: величины легочной вентиляции, функции почек, уровня оксигенации, интенсивности метаболических реакций, состояния гемодинамики и др. и отражает взаимодействие этих факторов. Их рассмотрение выявляет два основных звена регуляции КОС - дыхательное и метаболическое. Регистрация только рН не позволяет установить возможные причины нарушения КОС. Чтобы определить дыхательный и метаболический компоненты необходимо исследование других параметров.
рСО2.
рСО2 - парциальное давление углекислого газа. В пробах артериальной крови его принято обозначать как "раСО2 ". Этот показатель отражает количество растворенного СО2 в плазме. Это только одна из нескольких форм, в которых СО2 присутствует в крови. СО2 находится также в составе угольной кислоты ( Н2 СО3 ), иона бикарбоната ( НСО3__ ), в комбинации с разными белками плазмы и в связанном виде с гемоглобином (карбаминогемоглобин).
СО2 образуется в процессе клеточного метаболизма, освобождается в межклеточную жидкость, где в небольшом количестве превращается при взаимодействии с водой в угольную кислоту. Основное количество СО2 по градиенту концентрации попадает в эритроциты. Здесь за счет активности карбонатдегидратазы превращается в угольную кислоту (Н2СО3) и после ее диссоциации ионы Н+ связываются гемоглобиновым буфером (рис. 2). Гемоглобин более мощный буфер, когда он находится в восстановленном состоянии (без кислорода), поэтому процесс связывания ионов Н+ усиливается по мере прохождения крови через капиллярное ложе и отдачи кислорода тканям. СО2 в эритроцитах активно превращается в бикарбонат, который выходит в плазму в обмен на анионы Сl--- (хлорный сдвиг). В легких процесс идет в обратном направлении из-за низкого парциального давления СО2 в альвеолярном воздухе. Изменение рСО2 первично отражает состояние дыхания, так как легкие контролируют уровень рСО2 за счет изменения частоты и глубины дыхания.
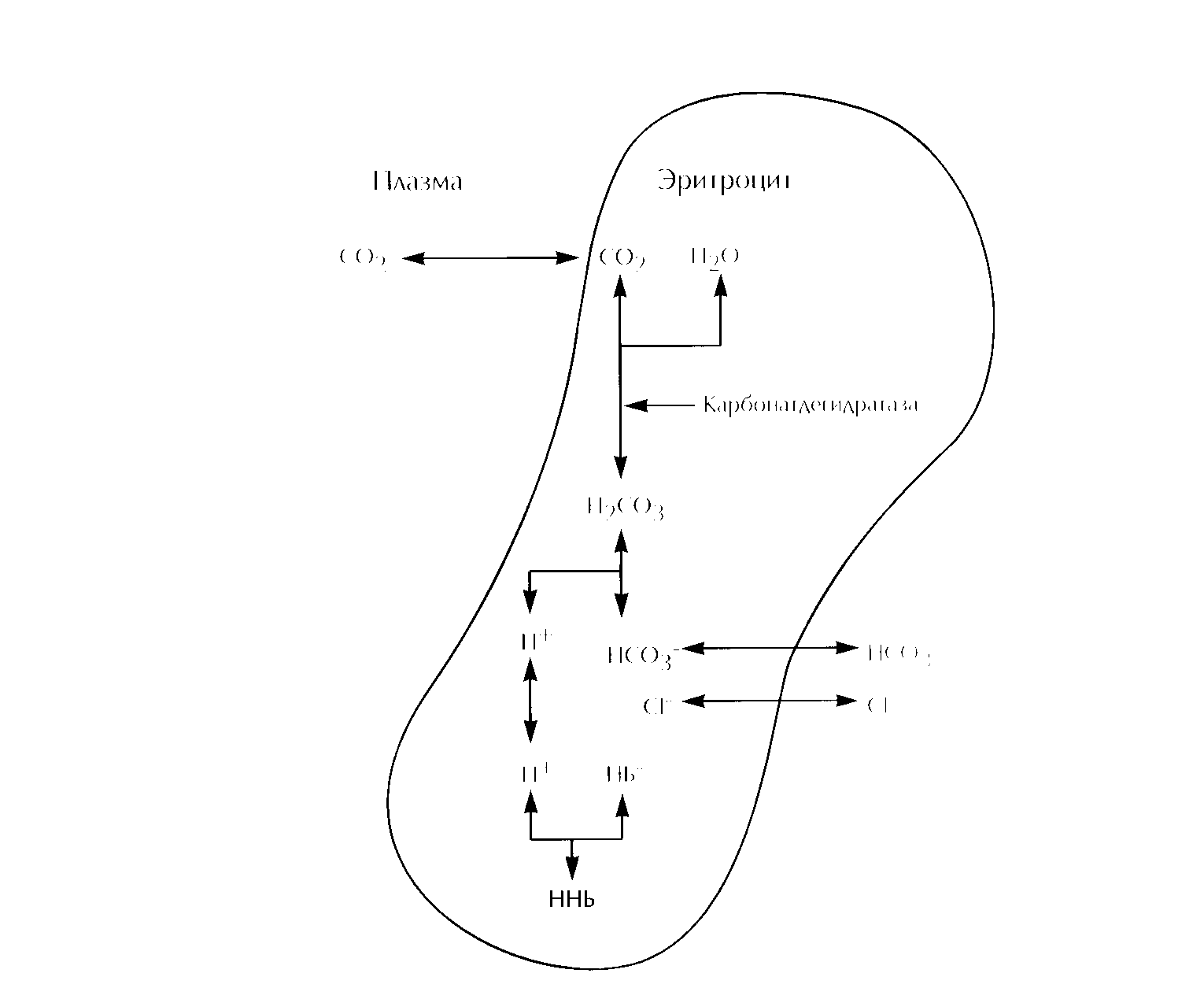
Рис. 2. Транспорт СО2 в крови.
В капиллярах СО2 диффундирует в эритроциты, где при взаимодействии с водой превращается в Н2СО3, реакция катализируется карбонатдегидратазой. Н2СО3 в свою очередь диссоциирует на Н+ , который связывается гемоглобиновым буфером, и НСО3--, который выходит из клеток в обмен на ионы Сl--. В альвеолах процесс проходит в обратном направлении и СО2, удаляется с выдыхаемым воздухом.
При нормальной вентиляции раСО2 находится в диапазоне 38 - 42 мм Hg (5,06 - 5,60 кПa ). Некоторые авторы считают нормальным диапазон раСО2 35-45 мм Hg (4,7-6,0 кПа ). Патологическими являются отклонения за пределы < 30 и > 50 мм Hg (< 4 и > 6,7 кПа ).
Накопление или уменьшение количества СО2 существенно влияют на кислотно-основное состояние. СО2 физически растворяется в плазме крови. После растворения СО2 вступает в химическую реакцию, в которой вода и двуокись углерода взаимодействуют и образуют угольную кислоту
СО2 + Н2О <->H2CO3 (уравнение 3)
Хотя сама СО2 не кислота, но она является предшественником угольной кислоты (уравнение 3), которая диссоциирует на ион водорода (Н+) и ион бикарбоната (НСО3-- ).
Н2СО3 <-> Н+ + НСО3-- (уравнение 4)
Н2СО3 является слабой кислотой, а НСО3-- достаточно активным анионом. Таким образом, в результате физического растворения СО2 в плазме меняется рНа. Так как растворение СО2 сразу же сопровождается образованием угольной кислоты, то накопление СО2 приводит к ацидозу. Поэтому при гиповентиляции развивается дыхательный ацидоз. При гипервентиляции СО2 избыточно удаляется из организма и пополняется из нестойкой Н2СО3. В свою очередь происходит смещение уравнения 4 влево в сторону образования угольной кислоты. В результате снижается концентрация Н+, увеличивается рН, развивается дыхательный алкалоз.
Схематически физиологическое системы двуокись углерода/бикарбонат можно изобразить в виде физического аналога сообщающихся сосудов с перетекающими жидкостями ( рисунок 3 ).
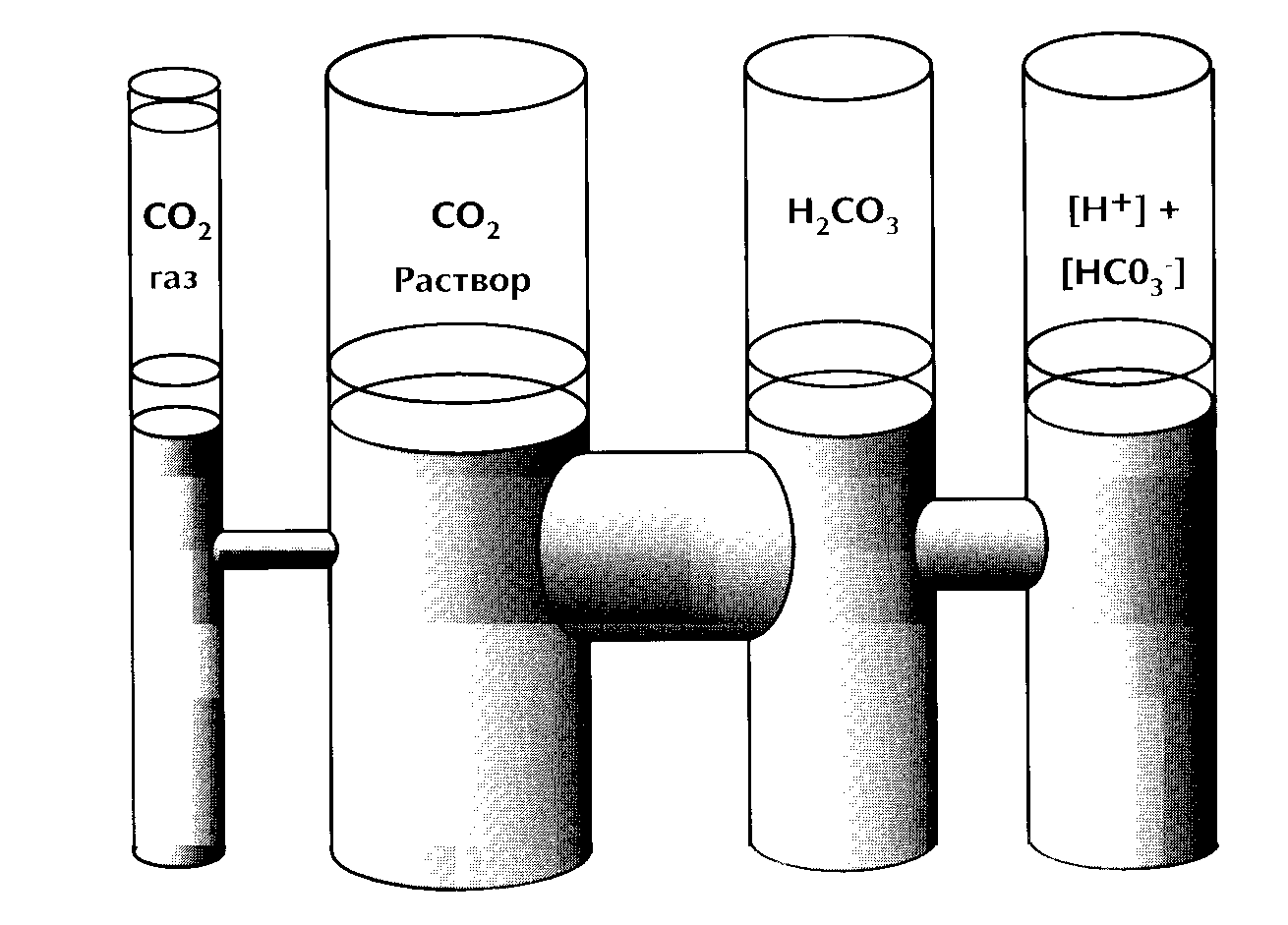
Рис. 3. Физический аналог равновесия системы СО2 / НСО3--.
Уровень жидкости во всех отделах при равновесном состоянии постоянен. При изменении уровня жидкости в одном из отделов в других уровень будет стремиться к новому равновесию со скоростью, пропорциональной диаметру переходных трубок.
При устойчивом состоянии уровень жидкости одинаков в отделах СО2 - газ, СО2 - жидкость, Н2СО3 и ([Н+] х [НСО3--]). Повышение (снижение) уровня жидкости в любом из сосудов приведет с большей или меньшей скоростью к выравниванию уровня в других,
Определение раСО2 клинически используется как индекс, отражающий дыхательный компонент кислотно-основного состояния.
