
Журнал неврологии и психиатрии / 2006 / NEV_2006_01_06
.pdf
ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
Рандомизированное двойное слепое плацебо-контролируемое исследование эффективности и безопасности толперизона при спастичности после церебрального инсульта*
П. СТАМЕНОВА, Р. КОЙТЧЕВ, К. КЮН, К. ХАНСЕН, Ф. ХОРВАТ, С. РАММ, Д. ПОНГРАТЦ
A randomized, double blind, placebo-controlled study of the efficacy and safety of tolperisone in spasticity following cerebral stroke
P. STAMENOVA, R. KOYTCHEV, K. KUHN, C. HANSEN, F. HORVATH, S. RAMM, D. PONGRATZ
University Hospital “Queen Giovanna”, София, Болгария; CCDRD AG, Берлин; Strathmann AG, Гамбург; PP Nature-Balance Lizenz GmbH, Гамбург; Med-Log, Гамбург; Friedrich-Baur-Institut bei der Medizinischen und der Nеurologischen Klinik, Klinikum Innenstadt der Universitаt Munchen, Мюнхен, Германия
Выполнено рандомизированное двойное слепое плацебо-контролируемое мультицентровое исследование, направленное на оценку эффективности и безопасности толперизона (мидокалма) — мышечного релаксанта центрального действия с мембраностабилизирующим действием. Лечили связанную с инсультом спастичность. Лечение продолжалось 12 нед и начиналось с периода титрации препарата (суточные дозы толперизона варьировали от 300 до 900 мг). Главным показателем была степень спастичности, которую определяли по шкале Ашворта в наиболее тяжелой по выраженности области. Выборку составили 120 пациентов (43 женщины, 77 мужчин), средний возраст 63,3±10,6 года. У большинства пациентов отмечалась двусторонняя локализация спастичности в обеих конечностях. Средняя длительность спастичности равнялась 3,3±4,4 года. 62% больных получали толперизон в суточной дозе более 600 мг. Толперизон обеспечивал редукцию среднего балла Ашворта в среднем на 1,03±0,71 по сравнению со средней редукцией балла на 0,47±0,54 в группе плацебо (р<0,0001). Снижение показателя шкалы Ашворта на ≥1 балл наблюдалось у 78,3% больных в группе толперизона, у 45% в группе плацебо (р<0,0001). Результаты функциональной и общей оценки подтверждают превосходство толперизона по эффективности. В группе активной терапии побочные явления развивались реже (n=19), чем в группе плацебо (n=26), и, как правило, оставались в пределах легкой и умеренной степени. В группе толперизона не было ни одного случая преждевременной отмены терапии из-за побочных явлений. Результаты исследования свидетельствуют об эффективности и очень хорошей переносимости толперизона. Полученные результаты позволяют предположить, что индивидуальная титрация дозы свыше максимального рекомендуемого уровня 450 мг/сут обеспе- чивает оптимальный терапевтический эффект.
Ключевые слова: плацебо, рандомизированное контролируемое исследование, спастичность, инсульт, толперизон (мидокалм).
To study the efficacy and safety of tolperisone — a centrally acting muscle relaxant with membrane stabilizing activity
— in the treatment of stroke-related spasticity. This was a randomized, double-blind, placebo-controlled, multicenter study with parallel groups. Treatment lasted 12 weeks and was started with a titration period of variable length (dose range 300—900 mg tolperisone daily). The degree of spasticity determined on the Ashworth Scale in the most severely affected joint area was denned as primary target parameter. Hundred and twenty patients (43 females, 77 males) in a mean age of 63,3±10,6 years were recruited and received treatment. In the majority of patients both limbs of each side were affected by the spasticity which on average had been present for 3,3±4,4 years. A 62% of the patients were treated with a daily dose >600 mg tolperisone. Tolperisone reduced the mean Ash-worth Score by a mean of 1,03±0,71 compared with a mean reduction of 0,47±0,54 in the placebo group (ð<0,0001). A 78,3% of the patients on tolperisone versus 45% of the placebo patients experienced a reduction by at least 1 point on the Ashworth Scale (ð<0,0001). Functional and overall assessments of efficacy confirmed superior efficacy of tolperisone. Adverse events occurred less often on active treatment (n=19) than on placebo (n=26) and were mostly of mild-to-moderate intensity. No withdrawals caused by adverse events were reported in the tolperisone group. The findings of the present study demonstrate the efficacy and excellent tolerance of tolperisone in the treatment of spastic hypertonia following cerebral stroke. Study data further suggest that an individual dose titration which may exceed the recommended maximum dose of 450 mg daily results in optimized therapeutic benefit.
Êåó words: placebo, randomized controlled trial, spasticity, stroke, tolperisone.
© Коллектив авторов, 2006 |
* С разрешения European Journal of Neurology. Опубликова- |
|
íî: Eur J Neurol 2005;12:453—461. |
Zh Nevrol Psikhiatr Im SS Korsakova 2006;106: 1: 34—42 |
|
34 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2006 |
Nv_1_06_.p65 |
34 |
20.12.2005, 10:38 |
Введение
Распространенность связанной с инсультом спастичности изучена недостаточно. Спастичность часто встречается в случаях обусловленного инсультом поражения верхних моторных путей. Однако спастич- ность после инсульта не является ни универсальным, ни острым расстройством. Спастичность развивается медленно в течение дней, недель и месяцев восстановления после инсульта, и не всегда представляет опасность для пациента. Спастичность может быть даже полезной, когда гипертонический синергизм разгибающих мышц помогает удерживать вес тела на ослабленных нижних конечностях [24]. Но в большинстве случаев она представляет серьезную проблему в связи с нарушениями элементарных движений и повседневной активности [3].
Спастичность определяется как зависимое от скорости сопротивление мышц пассивному растяжению с усилением сухожильного рефлекса [4, 12, 30]. Она требует терапии только в тех случаях, когда нарушает функции, вызывает дискомфорт и ухудшает гигиену пациента [5, 24]. Терапия включает нефармакологи- ческие методы, такие как физиотерапия, фармакотерапия и инвазивные методы, например хирургия, нервная блокада [24]. Баклофен, бензодиазепины и тизанидин относятся к наиболее широко применяемым пероральным средствам фармакотерапии для лечения спастического гипертонуса церебрального происхождения. Эти медикаменты не обладают селективностью, имитируют эффекты нейротрансмиттеров в нисходящих регуляторных системах (например, норадренергической системе) или действуют как нейротрансмиттеры на уровне локальных нервных сетей (как гаммааминомасляная кислота) [7]. Пере- численные препараты могут вызывать общие побоч- ные эффекты, включая седацию, сонливость, слабость, изменения настроения и когнитивных функций [3, 10, 11, 15, 21, 24, 31, 33], ограничивающие возможность их применения.
Толперизона гидрохлорид (1-пиперидино-2-метил- 3-р-толил-пропанон-3 HCl) является мышечным релаксантом центрального действия, который отлича- ется от других мышечных релаксантов механизмом действия и спектром побочных эффектов. Толперизон близок к лидокаину по химической структуре и также как этот препарат обладает мембраностабилизирующим действием. Толперизон имеет, кроме того, дозозависимое влияние на поток натрия через мембрану нервных клеток, ограничивая его, в результате чего снижается амплитуда и частота активных потенциалов. Подтвержден также подавляющий эффект толперизона на вольтажзависимые кальциевые каналы, что позволяет предположить наличие у него способности снижать выделение нейротрансмиттеров [8, 26]. В исследованиях на животных было показано, что толперизон снижает активность спинальных путей, участвующих в формировании патологически повышенного мышечного тонуса [23].
Клинические данные, полученные в ходе обследования более 9000 пациентов, свидетельствуют, что толперизон в дозах до 450 мг/сут купирует мышеч- ные спазмы и спастичность вплоть до нормализации
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2006
ЛЕЧЕНИЕ ЦЕРЕБРАЛЬНОГО ИНСУЛЬТА
мышечного тонуса. При этом отмечаются минимальные побочные эффекты или они полностью отсутствуют. В отличие от других мышечных релаксантов центрального действия толперизон не вызывает седации и нарушений внимания, что было доказано результатами применения препарата в дозах 150—450 мг/сут в рамках двойного слепого исследования с применением чувствительных и валидных психомоторных тестов [6, 17]. Отсутствие седативных свойств определяет ценность толперизона в терапии связанного с инсультом спастического гипертонуса, так как пожилые пациенты, перенесшие инсульт, отличаются повышенной чувствительностью к центральным побочным эффектам лекарственных средств [15, 24].
Поскольку толперизон был внедрен в клиниче- скую практику более 40 лет назад, большинство клинических исследований этого препарата не соответствуют современным научным стандартам. Однако в выполненном сравнительно недавно проспективном рандомизированном двойном слепом исследовании показано статистически достоверное превосходство толперизона над плацебо в эффективности терапии болезненных рефлекторных мышечных спазмов, связанных с патологией позвоночника и проксимальных суставов [28]. Подобных исследований толперизона в терапии спастического гипертонуса, связанного с заболеваниями центральной нервной системы, до сих пор не проводилось.
Сказанное определило актуальность и цель данного исследования.
Материал и методы
Выполнено двойное слепое плацебо-контролируе- мое рандомизированное исследование с параллельными группами.
Были обследованы 120 пациентов в возрасте 18— 75 лет с центральной спастичностью после церебрального инсульта, перенесенного более 2 мес назад.
Отбор пациентов осуществлялся за период с июня 1999 г. до мая 2000 г. в одном центре Болгарии и двух центрах Германии. Основными критериями включе- ния больных в исследование были: требование, чтобы спастичность достигала 2-го уровня или выше по шкале Ашворта как минимум в области одного сустава; прекращение приема препаратов с миорелаксирующими свойствами за 7 дней до начала настоящего исследования; недопустимость во время исследования применения бензодиазепинов и других мышеч- ных релаксантов, а также любых других препаратов, способных помешать реализации целей исследования, и изменений в текущей соматической терапии. К критериям исключения относились сопутствующие неврологические заболевания, ортопедическая патология и любые другие заболевания с высокой вероятностью нарушений мышечного тонуса, затруднения движений или иного влияния на результаты исследования; гиперчувствительность к толперизону или лидокаину; женщины репродуктивного возраста, не использующие адекватные средства контрацепции; беременность или лактация; установленное или предполагаемое злоупотребление алкоголем или наркоти- ческими средствами; терапия любыми препаратами
35
Nv_1_06_.p65 |
35 |
20.12.2005, 10:38 |
ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ |
|
|
исследования в течение последних 3 мес; юридиче- |
верхности в течение 2 мин; на каждом визите регист- |
|
ски установленная недееспособность и/или другие об- |
рировалась максимальная дистанция, пройденная |
|
стоятельства, препятствующие пониманию пациен- |
пациентом. |
|
том природы, целей и потенциальных последствий |
У пациентов со спастичностью только в области |
|
исследования, либо ограничивающие способность па- |
верхних конечностей вместо оценки ходьбы исполь- |
|
циента к сотрудничеству, а также явные признаки |
зовался тест с пружинным балансиром по методике |
|
оппозиционного отношения со стороны больного. |
N. Ogawa и соавт. [25]. Для проведения этого теста па- |
|
Исследование проводилось в соответствии с тре- |
циента укладывали на спину на кровать и просили |
|
бованиями Качественной клинической практики, |
полностью расслабиться. Затем применяли пружин- |
|
включая последнюю версию Хельсинкской деклара- |
ный балансир, закрепляя пружину на запястье спаз- |
|
ции, и с одобрения соответствующих местных этиче- |
мированной руки. Во время теста регистрировали уси- |
|
ских комитетов. Письменное информированное со- |
лие в граммах, необходимое для разгибания в локте |
|
гласие было получено от всех пациентов до включе- |
из согнутого положения на 90°. |
|
ния в исследование. |
Общая оценка эффективности терапии пациен- |
|
Оценочные шкалы |
тами и врачами регистрировалась по 4-пунктовой |
|
порядковой шкале: 1 — нет эффекта; 2 — слабый |
||
|
||
Для оценки спастичности в периоде включения и |
эффект; 3 — умеренный эффект; 4 — очень хороший |
|
в периоде исследования использовались разные шка- |
эффект. |
|
лы. Степень спастичности, которая служила главным |
В качестве дополнительного параметра использо- |
|
целевым показателем, определяли по шкале Ашворта. |
вался модифицированный индекс Бартел (Barthel In- |
|
Шкала Ашворта представляет собой 5-пунктовую |
dex) в версии S. Shah и соавт. [29]. Модифицирован- |
|
порядковую шкалу для оценки резистентности во вре- |
ный индекс Бартел предназначен для измерения функ- |
|
мя пассивного растяжения мышцы по следующим |
циональной способности пациента в повседневной |
|
критериям: 0 — отсутствие повышения мышечного |
активности по самообслуживанию. Суммарный балл |
|
тонуса; 1 — легкое повышение мышечного тонуса с |
этого индекса варьирует в пределах от 0 до 100, где |
|
ощущением «тормоза» при движении конечности; 2 |
максимальное значение 100 баллов соответствует пол- |
|
— более отчетливое повышение мышечного тонуса, |
ной независимости пациента. |
|
но конечность легко сгибается; 3 — значительное по- |
Для оценки безопасности применения толпери- |
|
вышение мышечного тонуса, пассивное движение |
зона использовались следующие параметры: (i) со- |
|
затруднено; 4 — конечность не поддается сгибанию |
матическое обследование, (ii) лабораторный скри- |
|
или разгибанию (отведению/приведению) [12]. Шка- |
нинг (гематология, биохимия крови, анализ мочи), |
|
ла Ашворта является признанным на международном |
(iii) ЭКГ, (iv) сообщения о нежелательных явлениях. |
|
уровне и валидизированным инструментом [4, 12, 30, |
Исследователям и пациентам предлагалось, кроме |
|
32] для регистрации и контроля клинической дина- |
того, оценить переносимость препарата исследова- |
|
мики спастичности во время лечения. Однако надеж- |
ния по 6-пунктовой порядковой шкале общего само- |
|
ность шкалы в аспекте однородности оценки вызы- |
чувствия: 1 — улучшение; 2 — без изменений; |
|
вает сомнения у некоторых исследователей [12, 16]. |
3 — легкое ухудшение; 4 — умеренное ухудшение; |
|
По этой причине в данном исследовании степень |
5 — тяжелое ухудшение; 6 — преждевременное исклю- |
|
спастичности в области наиболее пораженного сус- |
чение из исследования из-за плохой переносимости. |
|
тава (целевой сустав) при первом и всех последую- |
Проведение исследования |
|
щих визитах оценивалась одним и тем же исследова- |
||
|
||
телем через 2 ч после приема утренней дозы, когда у |
Лечение начиналось с периода титрации дозы |
|
всех пациентов устанавливался пиковый уровень кон- |
длительностью от 4 до 20 дней. Начальная доза для |
|
центрации препарата в плазме (tmax: îò 0,80±0,24 äî |
всех пациентов составляла 2 покрытых оболочкой |
|
1,13±0,45 ч; эффективный период полувыведения: |
таблетки, содержащих 50 мг толперизона гидрохло- |
|
6—8 ч; неопубликованные данные). |
рида 3 раза в сутки (Мидокалм®, «Гедеон Рихтер А.О.» |
|
Дополнительно оценивались следующие показате- |
от «Strathmann AG & Co», Германия) или плацебо. |
|
ли: способность к повседневной активности, способ- |
Далее допускалось повышение стартовой дозы пре- |
|
ность к ходьбе в течение 2 мин, количественная оцен- |
парата до 3 табл. 3 раза в сутки, 4 табл. 3 раза в сутки |
|
ка спастического гипертонуса с применением пружин- |
или 6 табл. 3 раза в сутки с интервалами по 4—5 дней |
|
ного балансира и общая оценка эффективности. |
до получения оптимального терапевтического эффек- |
|
Способность к повседневной деятельности оце- |
та или до появления непереносимых побочных эф- |
|
нивалась на каждом визите по 5-пунктовой порядко- |
фектов. Соответственно, суточные дозы толперизона в |
|
вой шкале: 1 — действия выполняются идеально без |
исследовании варьировали от 300 до 900 мг. Если не |
|
посторонней помощи; 2 — действия выполняются |
удавалось достичь оптимального эффекта, но при от- |
|
почти идеально без посторонней помощи; 3 — дейст- |
сутствии нежелательных реакций, терапию продолжа- |
|
вия выполняются медленно без посторонней помо- |
ли максимально допустимой дозой (900 мг/сут). В слу- |
|
щи; 4 — все действия выполняются с посторонней |
чае побочных эффектов допускалось снижение суточ- |
|
помощью; 5 — полная утрата способности к выпол- |
ной дозы препарата до прежнего уровня или терапия |
|
нению действий. |
преждевременно отменялась. Пациенты получали ин- |
|
У пациентов со спастичностью нижних конечно- |
струкции о необходимости приема препарата 3 раза в |
|
стей после выполнения теста Ашворта оценивалась |
сутки с разделением суточной дозы на 3 равные части |
|
способность к ходьбе по горизонтальной ровной по- |
сразу после еды. Общая продолжительность терапии |
|
36 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2006 |
Nv_1_06_.p65 |
36 |
20.12.2005, 10:38 |
(включая варьирующий по длительности период титрации) ограничивалась 12 нед.
Врач обследовал пациентов при включении, затем через каждые 4—5 дней в периоде титрации дозы, далее через каждые 4 нед в периоде терапии индивидуальной оптимальной терапевтической дозой и, наконец, на финальном визите через 12 нед после на- чала терапии. На каждом визите использовались все предусмотренные исследованием оценочные шкалы. Также на каждом визите регистрировались нежелательные явления и сопутствующая фармакотерапия. Дополнительно при включении и завершении исследования проводилось клиническое обследование, включая оценку общего состояния, питания, витальных показателей, температуры тела, патологических признаков со стороны внутренних органов и систем, регистрацию ЭКГ и лабораторные исследования (гематология, биохимия крови и анализ мочи). Переносимость препарата исследования оценивалась по завершении периода титрации, через каждые 4 нед приема индивидуальной оптимальной терапевтической дозы и по завершении исследования.
Статистические методы
Использовалась система статистического анализа для Windows 3.1. Выполнялись двусторонние тесты, статистически значимым считался уровень 5%. В анализ общей выборки (intention-to-treat; ITT) и безопасности включались все пациенты, начавшие терапию. В анализ выборки по протоколу (per protocol; PP) включались все пациенты, завершившие исследование в соответствии с протоколом.
Главным показателем служили различия между исходными значениями и интенсивностью спастичности (балл Ашворта) в наиболее пораженном суставном регионе через 4 нед терапии оптимальной индивидуальной терапевтической дозой (анализ выборки ITT). Гипотеза Ho — «толперизон не превосходит плацебо по степени редукции спастичности» тестировалась в сопоставлении с альтернативной гипотезой о превосходстве толперизона над плацебо. Для сравнения главных целевых показателей в обеих группах использовался ранговый тест сумм Уилкоксона (Wilcoxon). Для восполнения пропущенных данных использовался метод переноса последнего значения вперед.
Единственный главный целевой показатель (шкала Ашворта) устанавливался от начала исследования. Дополнительные анализы проводились для оценки изменений мышечного тонуса в контексте изменений функциональной и общей дезадаптации. Дополнительные целевые показатели анализировались с применением описательных и, если была возможность, сравнительных методов статистики. Дополнительные показатели и показатели безопасности анализировались с применением теста χ2 (для дискретных переменных), t-теста или теста Уилкоксона (для непрерывных переменных) в зависимости от типа распределения значений.
Расчет объема выборки был основан на прогнозируемых различиях в 1 балл в редукции балла Ашворта между пациентами группы толперизона и пациентами группы плацебо, с предполагаемой редукцией этого показателя в группе плацебо на 1,2 балла.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2006
ЛЕЧЕНИЕ ЦЕРЕБРАЛЬНОГО ИНСУЛЬТА
В соответствии с этими условиями требовалось по 60 пациентов в каждой из терапевтических групп (α=0,05; 1 — β=80%).
Результаты
Всего в исследование были включены и рандомизированы 43 женщины и 77 мужчин, страдающих связанной с инсультом спастичностью. Эти 120 пациентов составили выборку ITT (n=60 в каждой группе). В ходе исследования из нее выбыли 2 пациента, получавших толперизон (1 по собственному желанию и 1 из-за утраты контакта для катамнестической оценки). Из группы плацебо выбыли 7 пациентов (2 из-за нежелательных явлений; 2 из-за отсутствия эффекта; 2 из-за утраты контакта для катамнестической оценки и 1 по собственному желанию). Из выборки РР были исключены по 7 пациентов из каждой группы из-за нарушений условий протокола. Таким образом, выборку PP составили 97 пациентов (37 женщин и 60 мужчин): 51 из группы толперизона и 46 из группы плацебо.
Исходная характеристика пациентов представлена в табл. 1. Средний возраст больных составил 63,3±10,6 года (от 20 до 78 лет). В среднем церебральный инсульт развивался за 3,3±4,4 года (от 0,2 до 30,5 года) до включения в исследование. У 15 пациентов из группы плацебо и у 9 из группы толперизона период между инсультом и началом исследования был <6 мес. В целом терапевтические группы и выборки исследования (т.e. выборки ITT и PP) не различались по демографическим характеристикам, исходным показателям и анамнестическим данным, имеющим значение для результатов исследования. Различия между группами выявлялись только в отношении распределения по полу (больше пациентов женского пола в группе толперизона). Однако эти различия оценивались как незначимые, так как терапевтические группы были хорошо сбалансированы по всем другим исходным показателям. Более того, не было научных оснований считать пол фактором, определяющим тип
èдинамику спастического гипертонуса.
Âначале исследования наличие спастичности верифицировалось у всех пациентов. Средний балл Ашворта в выборке ITT составил 3,0±0,6. В большинстве случаев отмечалось поражение обеих конечностей с одной стороны (n=56 в группе толперизона, n=59 в группе плацебо). Сопутствующие заболевания выявлялись у 52 пациентов в обеих терапевтических группах (толперизон — 88 заболеваний, плацебо — 91). Среди них первое место по частоте занимала сосудистая патология (толперизон — 51, плацебо — 54), затем болезни пищеварительной системы (14 и 10 соответственно), эндокринная патология, расстройства питания и метаболизма (12 и 9 соответственно). Соматическую терапию получали меньшинство пациентов (выборка ITT: толперизон — 11 и плацебо — 17).
По завершении периода титрации у 4 пациентов доза толперизона составила 2 табл. 3 раза в сутки (300 мг), у 17 — 3 табл. 3 раза в сутки (450 мг), у 27 — 4 табл. 3 раза в сутки (600 мг), у 1 — 5 табл. 3 раза в сутки (750 мг) и еще у 9 — 6 табл. 3 раза в сутки (900 мг). В периоде титрации из группы толперизона выбыли 2 пациента. Соответственно наиболее часто исполь-
37
Nv_1_06_.p65 |
37 |
20.12.2005, 10:38 |

ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
Таблица 1. Исходные характеристики пациентов, леченных толперизоном и плацебо в разных выборках (среднее значение ± SD).
|
Выборка ITT |
Выборка PP |
|||
Показатель |
|
|
|
|
|
толперизон |
плацебо |
толперизон |
плацебо |
||
|
|||||
|
(n=60) |
(n=60) |
(n=51) |
(n=46) |
|
|
|
|
|
|
|
Ïîë: |
|
|
|
|
|
женщины |
27 |
16 |
25 |
12 |
|
мужчины |
33 |
44 |
26 |
34 |
|
Возраст, годы |
64,2±10,9 |
62,3±10,2 |
65,5±9,1 |
62,9±10,5 |
|
Интервал между инсультом и началом исследования, |
3,0±3,7 |
3,6±5,0 |
3,2±3,7 |
3,2±4,8 |
|
ãîäû |
|
|
|
|
|
Локализация спастичности, число больных |
|
|
|
|
|
левая верхняя конечность |
3 |
0 |
3 |
0 |
|
правая верхняя конечность |
1 |
0 |
0 |
0 |
|
обе конечности справа |
27 |
32 |
23 |
25 |
|
обе конечности слева |
29 |
27 |
25 |
20 |
|
все конечности |
0 |
1 |
0 |
1 |
|
Балл Ашворта |
3,0±0,6 |
3,0±0,52 |
3,0±0,59 |
3,0±0,49 |
|
Способность к ходьбе, м1 |
38,5±26,7 |
30,9±18,7 |
37,7±26,5 |
28,4±15,6 |
|
Измерение силы спастического гипертонуса в верхних |
2,2±1,7 |
1,6±0,8 |
1,6±0,5 |
1,5±0,9 |
|
конечностях, кг2 |
|
|
|
|
|
Модифицированный индекс Бартел |
82,9±16,0 |
83,7±14,8 |
82,5±2,3 |
83,9±1,8 |
|
|
|
|
|
|
|
Примечание. 1 — число доступных для оценки пациентов: ITT — толперизон (n=43), плацебо (n=51); PP — толперизон (n=39), плацебо (n=38); 2 — число доступных для оценки пациентов: ITT — толперизон (n=16), плацебо (n=10); PP — толперизон (n=12), плацебо (n=8).
зовалась доза толперизона 600 мг/сут, 15% пациентов получали 900 мг/сут. В результате корреляционного анализа не было обнаружено отчетливой связи между дозой препарата исследования и уровнем эффекта, а также между дозой препарата исследования и исходной тяжестью симптомов. Более того, не выявлено различий между группами по количеству принятых таблеток.
В среднем пациенты получали терапию толперизоном в течение 88,3±17,1 сут и плацебо в течение 88,1±16,4 сут. Средняя длительность периода титрации в группах толперизона и плацебо составила 14,6±4,4 и 14,2±4,5 сут соответственно.
Главный показатель: мышечный тонус
В результате анализа показателя мышечного тонуса было подтверждено, что толперизон достоверно превосходит плацебо по степени редукции центральной спастичности, как в выборке ITT, так и в выборке PP (р<0,0001). Как видно из табл. 2, снижение спастичности минимум на 1 балл отмечалось у 47 (78,3%) пациентов в группе толперизона и лишь у 27 (45,0%) в группе плацебо. Терапевтический эффект стойко сохранялся на протяжении всего периода ле- чения. При завершении исследования в группе толперизона балл Ашворта снизился на 3 пункта у 2 (3,3%) пациентов, у 15 (25,0%) на 2 пункта, у 30 (50,0%) на 1 пункт и у 13 (21,7%) этот показатель не изменился.
Соответствующие показатели в группе плацебо составили: 0, 2 (3,3%), 27 (45,0%) и 31 (51,7%) пациент. Средний балл шкалы Ашворта снизился на
38
1,03±0,71 в группе толперизона в сравнении с 0,47±0,54 в группе плацебо через 4 нед терапии в индивидуальной оптимальной терапевтической дозе (р<0,0001). Статистически достоверные различия между группами в пользу толперизона выявлялись начиная с 4—5-го дня терапии (–0,80±0,61 против —0,45±0,50; р=0,0017) и сохранялись вплоть до 12-й недели лечения (–1,10±0,77 против 0,52±0,57; р<0,0001).
Дополнительные показатели и модифицированный индекс Бартел
Результаты анализа дополнительных показателей также показали устойчивую тенденцию к превосходству толперизона по эффективности в сравнении с
Таблица 2. Улучшение показателя спастичности в выборке ITT через 4 нед терапии в оптимальной индивидуальной дозе: балл Ашворта
Балл Ашворта |
Толперизон |
Плацебо |
|||
|
|
|
|
||
àáñ. |
% |
àáñ. |
% |
||
|
|||||
|
|
|
|
|
|
–3 |
1 |
1,7 |
0 |
0 |
|
–2 |
13 |
21,7 |
1 |
1,7 |
|
–1 |
33 |
55,0 |
26 |
43,3 |
|
0 |
13 |
21,7 |
33 |
55,0 |
|
Всего |
60 |
100,0 |
60 |
100,0 |
|
|
|
|
|
|
|
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2006
Nv_1_06_.p65 |
38 |
20.12.2005, 10:38 |
ЛЕЧЕНИЕ ЦЕРЕБРАЛЬНОГО ИНСУЛЬТА
Таблица 3. Различия между группами пациентов, леченных толперизоном и плацебо, по способности больных к повседневной деятельности до и после лечения в выборке ITT
|
|
|
|
|
|
|
|
Толперизон |
|
|
|
|
|
Плацебо |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Показатель |
|
начало |
окончание |
|
|
|
начало |
окончание |
||||||||||||
исследования |
исследования |
исследования |
исследования |
|||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
àáñ. |
% |
àáñ. |
% |
|
àáñ. |
% |
àáñ. |
% |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Действия выполняются идеально |
0 |
— |
6 |
10,0 |
0 |
|
— |
1 |
1,67 |
|||||||||||
без посторонней помощи |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Действия выполняются почти |
4 |
6,67 |
11 |
18,33 |
1 |
1,67 |
3 |
5,0 |
||||||||||||
идеально без посторонней помощи |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Действия выполняются медленно |
13 |
21,67 |
17 |
28,0 |
21 |
35,0 |
22 |
36,67 |
||||||||||||
без посторонней помощи |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Все действия выполняются с |
42 |
70,0 |
23 |
38,33 |
36 |
60,0 |
27 |
45,0 |
||||||||||||
посторонней помощью |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Полная утрата способности к |
1 |
1,67 |
1 |
1,67 |
2 |
3,33 |
1 |
1,67 |
||||||||||||
выполнению действий |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Нет данных |
|
|
|
|
|
|
0 |
— |
2 |
3,33 |
0 |
|
— |
6 |
10,0 |
|||||
Всего |
|
|
|
|
|
|
60 |
100,0 |
60 |
100,0 |
60 |
100,0 |
60 |
100,0 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
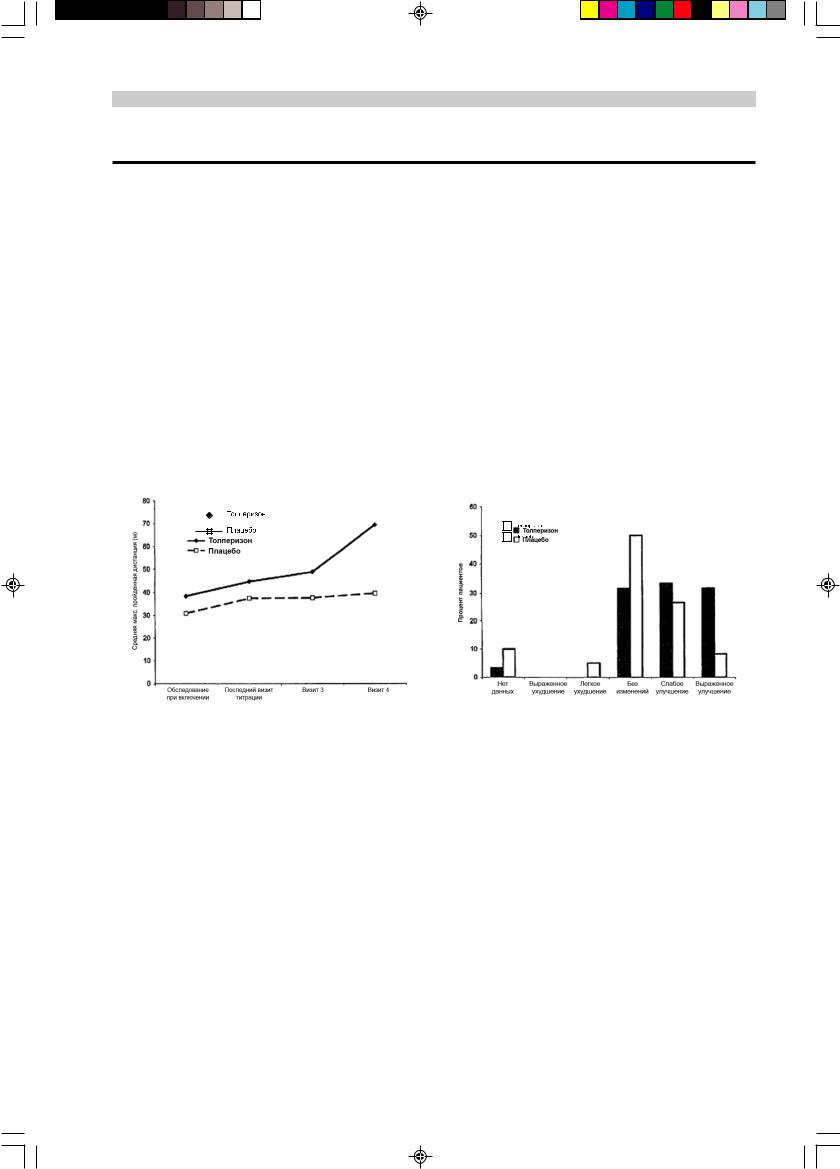
Рис. 1. Динамика показателя дистанции, пройденной по ровной горизонтальной поверхности в течение 2 мин в выборке ITT: толперизон (n=43); плацебо (n=51).
плацебо, что подтверждает клинически значимое влияние терапии толперизоном на повседневную активность больных.
Выявлена отчетливая статистическая тенденция (р=0,053) к улучшению способности выполнять повседневную деятельность через 4 нед терапии в индивидуальной оптимальной терапевтической дозе, явно нарастающая вплоть до завершения исследования (табл. 3).
Дистанция, которую пациенты способны преодолевать при ходьбе по ровной горизонтальной поверхности за 2 мин также значительно увеличивалась на последней неделе лечения в сравнении с плацебо (рис. 1). Соответственно, усилие, необходимое для разгибания в локтевом суставе, увеличивалось (неделя 4 —
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2006
Рис. 2. Общая оценка эффективности исследователями че- рез 4 нед терапии в индивидуальной оптимальной терапевти- ческой дозе в выборке ITT: толперизоном (n=60); плацебо (n=60).
исходно; р=0,08), причем различия между толперизоном и плацебо неуклонно возрастали по мере увеличения длительности терапии.
По завершении исследования превосходство толперизона выявлялось и в показателях модифицированного индекса Бартел: средние изменения исходных значений составили 5,3 в группе толперизона и 1,7 в группе плацебо.
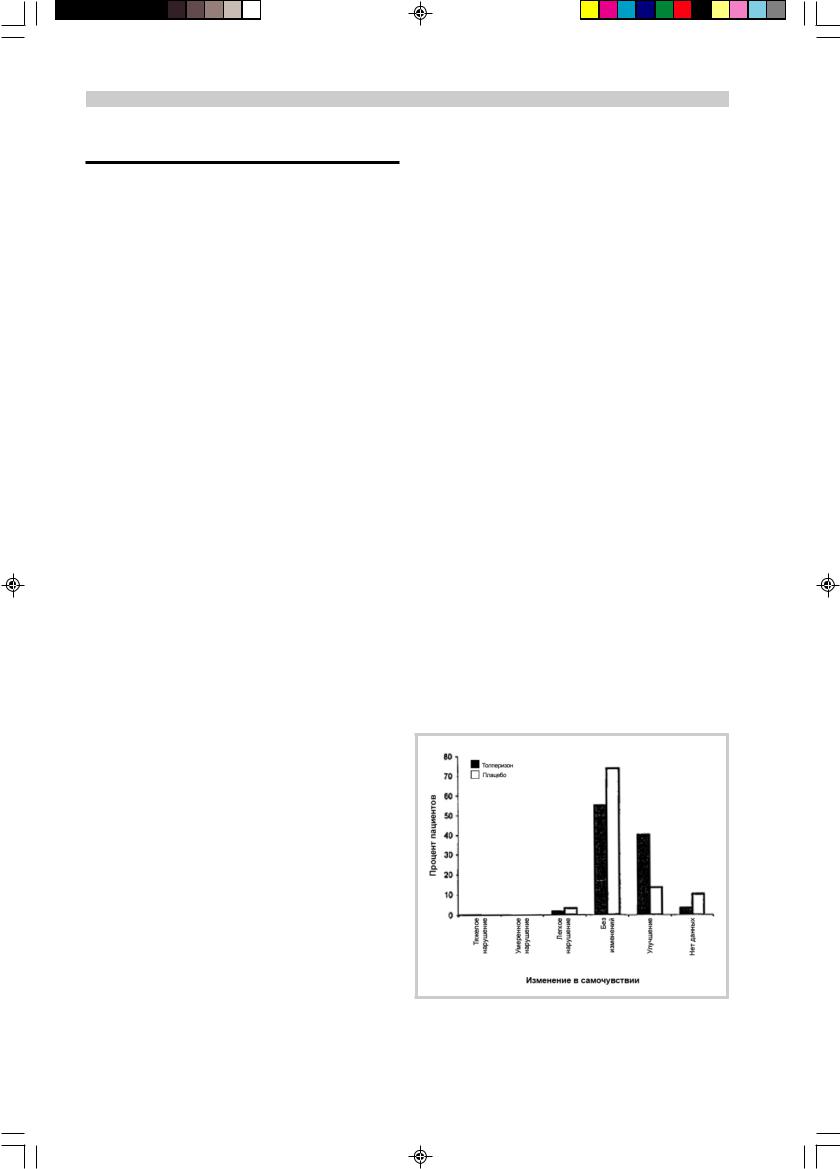
Наконец, общая оценка эффективности пациентами и исследователями также подтвердила преимущества толперизона над плацебо (р<0,001; рис. 2).
Безопасность и нежелательные явления
За весь период исследования отмечалось 45 нежелательных нежелательных явлений, которые имели
39
Nv_1_06_.p65 |
39 |
20.12.2005, 10:38 |
ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
Таблица 4. Нежелательные явления в терапевтических группах и независимо от причинной связи с терапией
Побочное явление |
Толперизон |
Плацебо |
|
|
|
Боль в желудке/ |
5 |
6 |
абдоминальная боль |
|
|
Тошнота |
3 |
4 |
Головокружение |
3 |
0 |
Обычная простуда/Грипп |
2 |
1 |
Высокий холестерин |
0 |
1 |
Головная боль |
1 |
2 |
Дискомфорт в груди |
1 |
0 |
Растяжение |
1 |
0 |
Диарея |
1 |
1 |
Рвота |
1 |
1 |
Стенокардия |
1 |
0 |
Артериальная гипертензия |
0 |
2 |
Переломы костей |
0 |
1 |
Мышечные судороги |
0 |
1 |
Ñûïü |
0 |
1 |
Инсомния |
0 |
1 |
Тревога |
0 |
1 |
Диспноэ |
0 |
1 |
Цистит |
0 |
1 |
Подагра |
0 |
1 |
Всего |
19 |
26 |
|
|
|
место у 22 из 120 пациентов. Количество нежелательных явлений было больше в группе плацебо (26), чем в группе толперизона (19). Зарегистрировано лишь одно серьезное нежелательное явление, которое имело место в группе плацебо и было оценено как «маловероятно» связанное с исследованием: у пациента отмечались боли в области желудка, тошнота и диспепсия, послужившие причиной госпитализации; в последующем у больного была диагностирована кровоточащая язва. Следует отметить, что этот пациент для профилактики тромбоза принимал ацетилсалициловую кислоту.
Различий между терапевтическими группами по клиническим проявлениям (табл. 4) и тяжести нежелательных явлений, а также их причинной связи с терапией исследования не обнаружено. 13 нежелательных явлений в группе пациентов, леченных толперизоном (боль в желудке/абдоминальная боль — 5 слу- чаев, тошнота — 3, головокружение — 2, вздутие — 1, диарея — 1, рвота — 1), и 9 таковых в группе плацебо (боль в желудке — 4 случая, тошнота — 3, головная боль — 1, сыпь — 1) были оценены как, вероятно, отчасти связанные с лечением.
Большинство нежелательных явлений было легкими (толперизон — 7 случаев; плацебо — 16) или
40
умеренным (11 и 9 соответственно). У 2 пациентов в группе плацебо потребовалась преждевременная отмена терапии из-за нежелательных явлений. В группе толперизона подобных случаев преждевременной отмены не отмечалось. Случаев смерти не отмечалось.
В результате оценки лабораторных показателей не обнаружено никаких указаний на связанные с препаратом исследования клинически значимые изменения. Только у 1 пациента из группы лечившихся толперизоном (450 мг) отмечалось повышение трансаминаз до 77,1 IU/л для AСT и 45,1 IU/л для AЛT. Эти значения не были расценены как нежелательные явления и не требовали наблюдения исследователем, так как степень их изменений не соответствовала ка- кой-либо тяжелой патологии. В показателях температуры тела, частоты сердечных сокращений, артериального давления и параметрах ЭКГ также не выявлено каких-либо связанных с исследуемым препаратом патологических изменений. Аналогичные результаты были получены и при анализе данных о коморбидных заболеваниях и сопутствующей терапии.
Как показано на рис. 3, результаты окончательной оценки переносимости пациентами и исследователями свидетельствуют о явном превосходстве толперизона над плацебо [р=0,015 (пациенты) и р=0,026 (исследователи)].
Обсуждение
Результаты проведенного исследования подтверждают эффективность толперизона гидрохлорида в купировании спастичности после церебрального инсульта. Доказательства статистически достоверного и клинически значимого превосходства толперизона над плацебо получены на материале обеих выборок исследования (ITT и PP).
Количественная оценка спастичности остается трудной проблемой. Шкалы функциональной оценки повседневной активности не могут решить этой
Рис. 3. Оценка исследователями переносимости через 12 нед терапии в выборке ITT: толперизон (n=60); плацебо (n=60).
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2006
Nv_1_06_.p65 |
40 |
20.12.2005, 10:38 |
|
ЛЕЧЕНИЕ ЦЕРЕБРАЛЬНОГО ИНСУЛЬТА |
проблемы, так как позволяют измерять лишь кос- |
пациентов пожилого возраста с сопутствующими за- |
венные проявления этого физиологического фено- |
болеваниями. |
мена и непригодны для измерения спастического |
Данные проведенного исследования согласуются |
гипертонуса [12]. Поэтому, несмотря на определен- |
с результатами предыдущих контролируемых иссле- |
ное критическое отношение [14], сегодня шкала |
дований толперизона в сравнении с плацебо, в кото- |
Ашворта является наилучшим валидизированным |
рых также были получены доказательства эффектив- |
инструментом для оценки спастичности [12, 16, 32]. |
ности толперизона при спастическом гипертонусе [13, |
Она с успехом использовалась во многих исследова- |
20]. Преимущества толперизона были установлены и |
ниях эффективности других антиспастических пре- |
в проведенном M. Feher и соавт. [9] контролируемом |
паратов. В связи с этим именно шкала Ашворта была |
исследовании 48 пациентов с гемиплегией и спасти- |
отобрана в качестве главного показателя, а шкалы |
ческим гипертонусом вследствие травмы или заболе- |
функциональной оценки активности использовались |
вания центральной нервной системы. Методом ран- |
в качестве дополнительных параметров в данном |
домизации пациентам назначали 150 мг толперизона |
исследовании. Шкала Ашворта позволила получить |
или 25 мг баклофена 3 раза в сутки в течение 6 нед. |
доказательства превосходства толперизона над пла- |
Терапевтический эффект отмечался в обеих группах, |
цебо в редукции повышенного мышечного тонуса. |
однако у пациентов, принимавших толперизон, по- |
Более чем у 3/ пациентов в группе толперизона от- |
вышение мобильности и уверенности в себе было |
4 |
|
мечалось снижение степени спастичности по пока- |
более выраженным, чем в группе баклофена. |
зателям 5-пунктовой шкалы Ашворта после завер- |
В отличие от этих ранних исследований в данном |
шения терапии исследования. |
исследовании допускалось повышение дозы толпери- |
Данный эффект имеет большое клиническое зна- |
зона в интервале от 300 до 900 мг/сут. Такое решение |
чение, так как дополнительные показатели, связан- |
было основано на выраженных индивидуальных раз- |
ные с повседневной активностью пациентов, также |
личиях в фармакокинетике, обнаруженных в одном |
свидетельствуют о превосходстве толперизона над |
из недавних исследований (неопубликованные дан- |
плацебо. Эти данные выгодно отличают толперизон |
ные). Была установлена значительная вариабельность |
от других антиспастических препаратов, включая бо- |
фармакокинетических показателей толперизона. У 24 |
тулинический токсин, который также способен дос- |
здоровых добровольцев после перорального приема |
таточно эффективно редуцировать мышечный гипер- |
однократной дозы 150 мг максимальные и минималь- |
тонус. Но, как было установлено [1, 2, 10, 12, 18, |
ные значения Cmax различались почти в 20 раз. Приве- |
19, 21, 22, 31, 34], не оказывает значимого влияния |
денные фармакокинетические данные наряду с дли- |
на повседневную активность пациентов. В отличие от |
тельным клиническим опытом применения препара- |
других миорелаксантов, таких как баклофен или дан- |
та позволяют предположить, что индивидуальная тит- |
тролен [10], толперизон, как было показано в дан- |
рация дозы может существенно повысить уровень |
ном исследовании, не ослабляет мышечной силы. Так, |
эффективности толперизона без чрезмерного риска |
дистанция, которую были способны пройти пациен- |
для здоровья пациентов. |
ты по ровной горизонтальной поверхности, при ле- |
Результаты нашего исследования полностью под- |
чении толперизоном значительно увеличивалась. |
тверждают это предположение. Нами установлено, что |
Толперизон обладает хорошей переносимостью. |
явное преимущество толперизона над плацебо по |
Нежелательные явления при лечении им встречались |
эффективности реализуется при отсутствии достовер- |
реже, чем в группе, где использовалось плацебо, и |
ных различий между терапевтическими группами по |
были преимущественно легкой и умеренной степени |
каким-либо из показателей безопасности (нежелатель- |
тяжести. В группе толперизона не зафиксировано ни |
ные явления, лабораторные параметры, ЭКГ, дан- |
одного случая преждевременной отмены терапии. |
ные соматического обследования и др.). Эти данные |
Обращаясь к общей оценке переносимости лекарст- |
имеют особое значение, так как в нашем исследова- |
венного препарата следует отметить, что использо- |
нии 62% из всех пациентов в группе толперизона по- |
вавшаяся для этого рейтинговая шкала не является |
лучали препарат в дозах, превышающих рекомендуе- |
специфичным инструментом для измерения собствен- |
мые, — т.е. свыше 450 мг толперизона в сутки. Мак- |
но переносимости, а позволяет скорее оценивать |
симальная доза толперизона 900 мг/сут назначалась |
совокупные показатели переносимости и эффектив- |
после индивидуальной титрации лишь 15% пациен- |
ности. Соответственно результаты оценки по этой |
тов. Точной регистрации причин воздерживания от |
шкале не позволяют утверждать, что толперизон пе- |
дальнейшего повышения дозы в индивидуальных ре- |
реносится лучше, чем плацебо, так как категория |
гистрационных картах пациентов специально не про- |
«улучшение самочувствия» отражает скорее превос- |
водилось. Есть лишь данные о том, что у 2 пациентов |
ходство исследуемого препарата по эффективности. |
из группы толперизона и 3 из группы плацебо даль- |
Результаты нашего исследования могут иметь |
нейшее повышение дозы было прекращено из-за не- |
большое значение для фармакотерапии центральной |
желательных явлений, которые требовали некоторо- |
спастичности, поскольку толперизон не только по- |
го снижения дозы, как было оговорено в протоколе. |
зволяет купировать спастический гипертонус, но и |
У других пациентов повышение дозы прекращалось |
способствует улучшению повседневной активности |
по причине оптимального терапевтического эффекта |
пациентов и росту их независимости и способности к |
по оценке исследователя либо по причине отказа па- |
самообслуживанию. Хорошая переносимость с мини- |
циентов принимать до 18 таблеток в сутки (900 мг). |
мальными противопоказаниями определяет возмож- |
Следовательно, вполне вероятно, что оптимальная |
ность широкого применения толперизона, включая |
доза толперизона при терапии спастического гипер- |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2006 |
41 |
Nv_1_06_.p65 |
41 |
20.12.2005, 10:38 |
ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ |
|
тонуса может быть еще выше, чем дозы в данном |
тиспастическую эффективность толперизона в тера- |
исследовании, если удастся избежать приема боль- |
пии пациентов со спастическим гипертонусом после |
шого числа таблеток, что имеет существенные пси- |
церебрального инсульта. Толперизон обеспечивает |
хологические и практические ограничения. Эти дан- |
выраженную редукцию спастичности, достаточную |
ные свидетельствуют о потребности в таблетках с дру- |
для улучшения активности и способности к самооб- |
гой дозировкой, например по 150 мг толперизона. Они |
служиванию в повседневной жизни, при очень хоро- |
могут быть более адекватными для пациентов, тре- |
шей переносимости. Результаты анализа индивидуаль- |
бующих высоких доз для достижения индивидуаль- |
ных режимов титрации стартовой дозы свидетельст- |
ного оптимального эффекта. |
вуют, что индивидуальные терапевтические дозы мо- |
В заключение необходимо отметить, что резуль- |
гут значительно превышать рекомендуемый макси- |
таты проведенного исследования подтверждают ан- |
мальный уровень 450 мг в сутки. |
ЛИТЕРАТУРА
1.Bakheit A.M.O, Thilmann A.F., Ward A.B. et al. A randomized, dou18. Lataste X., Emre M., Davies C., Groves L. Comparative profile of tiza-
ble-blind, placebo-controlled, dose-ranging study to compare the efficacy and safety of three doses of botulinum toxin type A (Dysport) with placebo in upper limb spasticity after stroke. Stroke 2000;31:2402—2406.
2.Bass B., Weinshenker B., Rice G.P. et al. Tizanidine versus baclofen in the treatment of spasticity in patients with multiple sclerosis. Can J Neurol Sci 1988;15:15—19.
3.Bes A., Eyssette M., Pierrot-Deseilligny E. et al. A multi-centre, dou- ble-blind trial of tizanidine, a new antispastic agent, in spasticity associated with hemiplegia.Curr Med Res Opin 1988;10:709—718.
4.Bohannon R.W., Smith M.B. Interrater reliability of a Modified Ashworth Scale of muscle spasticity. Phys Ther 1987;67:206—207.
5.Dictz V. Syndrom der spastischen Parese. Aktuelle Neurol 2001;28:49—52.
6.Dulin J., Kovacs L., Ramm S. et al. Evaluation of sedative effects of single and repeated doses of 50 mg and 150 mg tolperisone hydrochloride. Results of a prospective, randomized, double-blind, place- bo-controlled trial. Pharmacopsychiatry 1998;31:137—142.
7.Emre P. New development in the medical treatment of spasticity. In: Spasticity: Mechanisms and Management. Eds. A.F. Thilmann, D.J. Burke, W.Z. Rymer. Berlin—Heidelberg—New York: Springer 1993;372—384.
8.Farkas S., Gere A. Pharmacology of Tolperisone (Mydocalm). Studies on the Mechanism of Action. Gedeon Richter Ltd, Company Report RGD 47012, 1994.
9.Feher M., Juvancz P., Szontagh M. Effect of Mydocalm in the rehabilitation of hemiparesis. Balneologia Rehailitdcio Gyogyfurdougy 1985;6:201—205.
10.Gracies J.M., Elovic E., McGuire J., Simpson D. Traditional pharmacological treatments for spasticity part II: general and regional treatments. Muscle Nerve 1997;6:Suppl:92—120.
11.Groves L., Shellenberger M.K., Davis C.S. Tizanidine treatment of spasticity: a meta-analysis of controlled, double-blind, comparative studies with baclofen and diazepam. Adv Ther 1998;15:241—251.
nidine in the management of spasticity. Neurology 1994;44:Suppl 9:53—59.
19.Medici M., Pebet M., Ciblis D. A double-blind, long-term study of tizanidine (Sirdalud) in spasticity due to cerebrovascular lesions. Curr Med Res Opin 1989;11:398—407.
20.Melka A., Haimanot R.T. Tolperisone HCl (Mydocalm): A Randomized Doubleblind and Placebo Controlled Drug Trial. International Conference on Lathyrus and Lathyrism. Ethiopia, Addis Abeba 1995;31—32 (book of abstracts).
21.Meythaler J.M., Guin-Renfroe S., Johnson A., Brunner R.M. Prospective assessment of tizanidine for spasticity due to acquired brain injury. Arch Phys Med Rehabil 2001;82:1155—1163.
22.Milanov I.G. Mechanisms of baclofen action on spasticity. Acta Neurol Scand 1992;85:305—310.
23.Miskolczi P., Vereczkcy L., Frenkl R. Gas-liquid chromatographic method for the determination of tolperisone in human plasma: pharmacokinetic and comparative bioavarilability studies. Pharm Biomed Anal 1987;5:695—700.
24.O’Brien C.F., Seeberger L.C., Smith D.B. Spasticity after stroke. Epidemiology and optimal treatment. Drugs Aging 1996;9:332—340.
25.Ogawa N., Asanuma M., Hirata H. et al. Development of a simple spasticity quantification method: effects of tizanidine on spasticity in patients with sequelae of cerebrovascular disease. J Int Med Res 1992;20:78—86.
26.Ono H., Fukuda H., Kudo Y. Mechanism of depressant action of muscle relaxants on spinal reflexes: participation of membrane stabilizing action. J Pharmacobiodyn 1984;7:171—176.
27.Ono H., Matsumoto K., Kato K. et al. Effects of tizanidine, a centrally acting muscle relaxant, on motor systems. Gen Pharmacol 1986;17:137—142.
28.Pratzel H.G., Alken R.G., Rainm S. Efficacy and tolerance of repeated oral doses of tolperisone hydrochloride in the treatment of painful reflex muscle spasm: results of a prospective placebo-controlled dou- ble-blind trial. Pain 1996;67:417—425.
12.Haas B.M., Bergstrom E., Jamous A., Bennie A. The inter rater relia29. Shah S., Vanclay F., Cooper B. Improving the sensitivity of the Bar-
bility of the original and of the modified Ashworth Scale for the assessment of spasticity in patients with spinal cord injury. Spinal Cord 1996;34:560—564.
13.Haque A., Hossain M., Khan J.K. et al. New findings and symptomatic treatment for neurolathyrism, a motor neuron disease in north west Bangladesh. Paraplegia 1994;32:570—572.
14.Hinderer S.R., Lehmann J.F., Price R. et al. Spasticity in spinal cord injured persons: quantitative effects of baclofen and placebo treatments. Am J Phys Med Rehabil 1990;69:311—317.
15.Hulme A., MacLennan W.J., Ritchie R.T. et al. Baclofen in the elderly stroke patient — its side-effects and pharmacokinetics. Eur J Clin Pharmacol 1985;29:467—469.
16.Katz R.T., Rovai G.P., Brait C., Rymer W.Z. Objective quantification of spastic hypertonia: correlation with clinical findings. Arch Phys Med Rehabil 1992;73:339—347.
17.Kohnen R., Kriiger H.P., Dulin J. Die humanexperimentelle Unlersuchung sedierender Wirkungen von Medik-amenten im Zusammenwirken mit Alkohol. Psychologic 1995;21:768—775.
thel Index for stroke rehabilitation. J Clin Epidemiol 1989;42:703— 709.
30.Sloan R.L., Sinclair E., Thompson J. et al. Inter-rater reliability of the modified Ashworth Scale for spasticity in hemiplegic patients.Int J Rehabil Res 1992;15:158—161.
31.Stien R., Nordal H.J., Oftedal S.I., Slettebo M. The treatment of spasticity in multiple sclerosis: a double-blind clinical trial of a new antispastic drug tizanidine compared with baclofen. Acta Neurol Scand 1987;75:190—194.
32.The United Kingdom Tizanidine Trial Group. A double-blind, pla- cebo-controlled trial of tizanidine in the treatment of spasticity caused by multiple sclerosis.Neurology 1994;44:Suppl 9:70—78.
33.Wallace J.D. Summary of combined clinical analysis of controlled clinical trials with tizanidine. Neurology 1994;44:Suppl 9:60—69.
34.Wisscl J., Miiller J., Dressnandt J. et al. Management of spasticity associated pain with botulinum toxin A. J Pain Symptom Manage 2000;20:44—49.
Поступила 07.11.05
42 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2006 |
Nv_1_06_.p65 |
42 |
20.12.2005, 10:38 |
