
Журнал неврологии и психиатрии / 2006 / NEV_2006_01_09
.pdf
КРАТКИЕ СООБЩЕНИЯ
Антитела к ацетилхолиновому рецептору у больных с различными клиническими формами миастении и миастеническим синдромом Ламберта — Итона
Д.В. СИДНЕВ, М.Ю. КАРГАНОВ, Н.И. ЩЕРБАКОВА, И.Б. АЛЧИНОВА, А.Г. САНАДЗЕ
Antibodies to acetylcholine receptor in patients with different clinical forms of myasthenia and Lambert—Eaton myasthenic syndrome
D.V. SIDNEV, M.YU. KARAGANOV, N.I. SHCHERBAKOVA, I.B. ALCHINOVA, A.G. SANADZE
НИИ общей патологии и патофизиологии РАМН, Москва
Увеличение титра антител к ацетилхолиновому рецептору (АХР) наряду с клиническими проявлениями болезни, положительной реакцией на введение антихолинэстеразных препаратов и электромиографическими феноменами, отражающими нарушения нервно-мышечной переда- чи, являются классическими критериями диагностики миастении [1, 6, 9, 14], хотя большинство авторов подчеркивают отсутствие корреляции между титром антител к АХР и тяжестью клинических проявлений миастении [1, 6, 14, 19, 21]. Выделяют [19] группу больных (около 20%), у которых титр антител не превышает значения у здоровых лиц, — это пациенты с серонегативной миастенией. Антитела к АХР, как правило, не выявляются у больных с миастеническим синдромом Ламберта — Итона [7, 11, 12, 16]. Вместе с тем известно, что у больных миастенией, сочетающейся с тимомой, и у пациентов с поздним началом заболевания выявляются антитела к мышечному белку — титину и к рианодиновым рецепторам [2, 3, 20].
Целью настоящей работы явилось исследование титра антител к АХР у больных с разными клиническими формами миастении и с миастеническим синдромом Ламберта — Итона, а также у больных с наличием тимомы без клиниче- ских признаков миастении.
Материал и методы
Обследовали 47 больных: 34 c миастенией, 9 с миастеническим синдромом Ламберта — Итона и 4 с тимомой без признаков миастении. Мужчин было 12 (возраст от 21 года до 79 лет, в среднем 54,6±19,8 года), женщин — 35 (от 13 до 79 лет, в среднем 43,6±19,4 года).
Среди 34 больных миастенией было 6 мужчин и 28 женщин в возрасте 13—79 лет (в среднем 47,5±20,7 года). У 12 из них была выявлена и удалена тимома. Из 22 больных без тимомы у 13 (все женщины) болезнь возникла в возрасте до 60 лет, у 9 (4 мужчины и 5 женщин) — в более позднем возрасте.
Из 9 пациентов с миастеническим синдромом Ламберта — Итона было 5 мужчин и 4 женщины в возрасте 21—62 года (в среднем 46,0±18,1 года). У 2 мужчин была выявлена карцинома легких, у остальных пациентов после тщательного обследования по органам паранеопластического процесса не было обнаружено.
Пациенты с тимомой без миастении (1 мужчина и 3 женщины) были в возрасте 20—63 лет (37,8±18,1 года).
Диагноз миастении и миастенического синдрома основывался на результатах клинического и электромиографи-
© Коллектив авторов, 2006
Zh Nevrol Psikhiatr Im SS Korsakova 2006;106: 1: 53—55
ческого исследований, а также данных фармакологического теста с введением прозерина или калимина-форте, диагноз тимомы — на данных КТ или МРТ переднего средостения.
Тяжесть клинических проявлений миастении оценивалась по 5-балльной шкале согласно Международной клинической классификации [4, 5]: 1 — слабость только окулярных мышц, во всех других мышцах сила нормальная, 2А — 4В — нарастающая слабость туловищной и бульбарной мускулатуры (А — отсутствие, В — наличие бульбарных нарушений).
Концентрацию антител к АХР определяли радиоиммунологическим методом с помощью коммерческой тест-сис- темы DLD Diagnostica GMBH (Германия). Образцы сыворотки хранили при –20°С. Перед анализом их размораживали, отбирали аликвоты по 5 мкл и помещали в пробирки. К пробам добавляли по 100 мкл 125 I-рецептора ацетилхолина (удельная активность 342 Ci/ммоль), 50 мкл антител к IgG человека, перемешивали и инкубировали 30 мин при комнатной температуре. Затем добавляли по 1 мл промывоч- ного буфера, центрифугировали при 3000 g в течение 20 мин, надосадочную жидкость удаляли декантацией. Полученный осадок ресуспендировали и повторяли процедуру промывки. Определяли радиоактивность проб и вычисляли концентрацию антител в нмоль/л по формуле с использованием фактора, учитывающего дату изготовления набора и удельную активность метки, радиоактивность пробы, а также радиоактивность негативного контроля. Повышенным титром антител к АХР являлось значение выше 0,40 нмоль/л.
Результаты
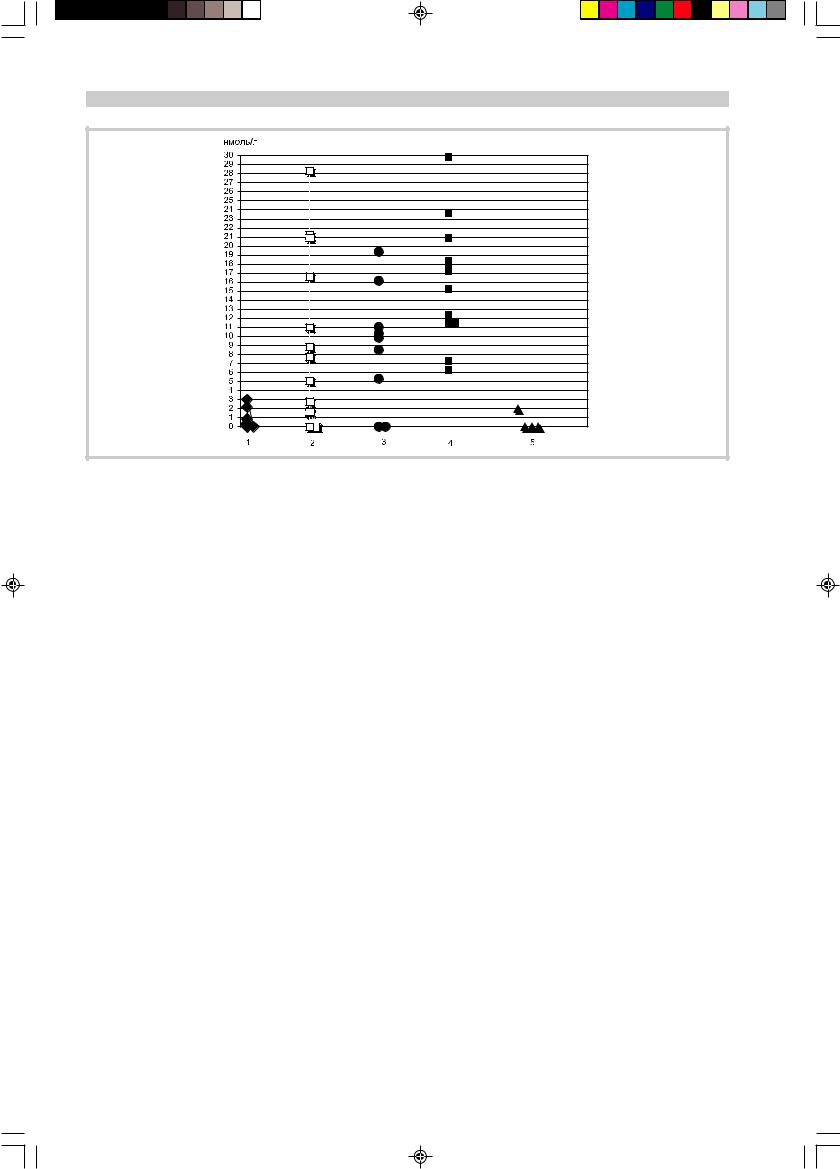
Результаты определения титра антител к АХР в сыворотке крови представлены на рисунке.
Из него видно, что у 3 (33%) из 9 пациентов с миастеническим синдромом Ламберта — Итона он был увеличен (от 0,88 до 3,03 нмоль/л), тогда как у 6 находился в пределах нормы либо антитела не выявлялись.
Из 3 больных с повышенным титром антител к АХР только у одного были выявлены признаки паранеопласти- ческого процесса, тогда как у другого больного — с карциномой легкого антитела не обнаруживались.
У 30 (88,2%) из 34 пациентов с миастенией был повышен титр антител к АХР с колебаниями от 1,5 до 29,8 нмоль/л. У 4 (11,8%) больных антитела выявлены не были (серонегативная группа).
В подгруппе больных миастенией, сочетавшейся с тимомой, титр антител составил в среднем 16,0±6,8 нмоль/л (от 6,3 до 29,8 нмоль/л), что достоверно превышало его зна- чения у пациентов с миастенией без тимомы — 9,4±8,1 нмоль/л (от 0 до 28,3 нмоль/л).
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2006 |
53 |
Nv_1_06_.p65 |
53 |
20.12.2005, 10:38 |
КРАТКИЕ СООБЩЕНИЯ
Титр антител к АХР.
1 — больные с миастеническим синдромом Ламберта — Итона; 2 — больные с миастенией без тимомы с ранним началом заболевания — до возраста 60 лет; 3 — больные с миастенией без тимомы с поздним началом заболевания — после 60 лет; 4 — больные с миастенией, сочетающейся с тимомой; 5 — пациенты с тимомой без признаков миастении.
При миастении с ранним началом болезни титр антител к АХР составил в среднем 9,7±9,3 нмоль/л (от 1,5 до 28,3 нмоль/л), что практически не отличалось от значений у пациентов с поздним началом миастении — 8,9±6,5 нмоль/л (от 5,3 до 19,3 нмоль/л). В обеих подгруппах больных миастенией без тимомы было по два «серонегативных» пациента.
Только у 1 из 4 пациентов с тимомой без миастении выявлено увеличение титра антител к АХР — 2,0 нмоль/л.
Не выявлено корреляции между титром антител и тяжестью клинических проявлений миастении, а также полом, возрастом больных и длительностью заболевания (p>0,05).
Обсуждение
Известно, что в сыворотке крови больных с миастени- ческим синдромом Ламберта — Итона выявляется большое количество «разнонаправленных» антител [18]. В его диагностике ключевая роль принадлежит определению титра антител к потенциалзависимым кальциевым каналам [11, 12, 16]. У 8 (89%) из 9 наших пациентов с миастеническим синдромом Ламберта — Итона такие антитела выявлялись.
Значимое увеличение титра антител к АХР было обнаружено у больного с карциномой легкого, имеющего среди пациентов с миастеническим синдромом Ламберта — Итона максимальный титр антител к потенциалзависимым кальциевым каналам. Однако у большинства больных с миастеническим синдромом Ламберта — Итона антитела к АХР не выявлялись [10, 17].
Максимальные значения титра антител к АХР наблюдались у больных с миастенией, сочетавшейся с тимомой. Эта подгруппа характеризовалась также увеличением уровня антител к мышечному белку титину, рианодиновым рецепторам и к α3- è α7-субъединицам холинорецептора [1— 3, 8, 13, 15, 20].
Как и большинство других авторов [6, 9, 14, 19], мы не выявили корреляции между титром антител к АХР и тяжестью клинических проявлений миастении. Максимальные значения титра были выявлены при тяжести миастении как 3В, так и 2В. Самая легкая степень миастении — 2А (отсутствие бульбарных нарушений при минимальной туловищной слабости) характеризовалась значениями титра антител от 1,7 до 11,5 нмоль/л (при норме не более 0,4 нмоль/л). Серонегативная миастения выявлялась у пациентов как с наибольшей — 4В, так и с 3В и 3А степенью тяжести болезни.
По данным разных авторов [22, 23], миастения развивается у 30—50% пациентов с тимомой. В этой связи повышение титра антител к АХР в единственном случае тимомы без миастении может свидетельствовать о высокой вероятности возникновения болезни после проведения тимомэктомии.
Таким образом, оценка титра антител к АХР у больных с разными клиническими формами миастении показала, что факт наличия тимомы определяет выраженность аутоагрессии, которая проявляется максимальными зна- чениями этого показателя. У больных с миастенией с ранним и с поздним началом болезни без тимомы средняя величина титра антител к АХР была одинаковой и достоверно меньшей, чем у больных миастенией, сочетающейся с тимомой. В обеих подгруппах больных миастенией без тимомы одинаково часто встречаются пациенты с серонегативной миастенией.
Полученные данные подтверждают высокую диагности- ческую значимость определения титра антител к АХР, позволяя выделить группу «серонегативных» пациентов. Вместе с тем, несмотря на отчетливые клинические различия больных с ранним и с поздним началом миастении без тимомы и с разной частотой выявления антител к титин-бел- ку, титр антител к АХР в этих подгруппах не различался.
54 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2006 |
Nv_1_06_.p65 |
54 |
20.12.2005, 10:38 |
МИАСТЕНИЯ
ЛИТЕРАТУРА
1.Санадзе А.Г., Гехт Б.М., Сиднев Д.В. и др. Антитела к ацетилхолиновому рецептору в диагностике миастении и других форм, связанных с патологией нервно-мышечной передачи. Неврол журн 2003; 8: приложение 1: 19—21.
2.Сиднев Д.В., Санадзе А.Г., Давыдова Т.В. и др. Антитела к мышцам (антититиновые антитела) в диагностике миастении, со- четающейся с тимомой. Неврол журн 2003; 8: приложение 1: 21—23.
3.Aarli J., Skeie G., Mygland A., Gilhus N. Muscle striation antibodies in myasthenia gravis. Diagnostic and functional significance. Ann NY Acad Sci 1998; 841: 505—515.
4.Barohn R.J. How to administer the quantitative Myasthenia Gravis Foundation of America. Inc 1996.
5.Barohn R.J., McIntire D., Herbelin L. et al. Reliability testing of the quantitative myasthenia gravis score. Ann NY Acad Sci 1998; 841: 769—772.
6.Drachman D.B., Adams R.N., Josifek L.F., Self S.G. Functional activities of autoantibodies to acetylcholine receptors and the clinical severity of myasthenia gravis. N Engl J Med 1982; 307: 769—773.
7.Engel A. The investigation of congenital myasthenic syndromes. Ann NY Acad Sci 1993; 681: 425—435.
8.Gotti C., Balestra B., Mantegazza R. et al. Detection of antibody subpopulations in myasthenia gravis using a non radioactive new enzyme immunoassay. Muscle & Nerve 1997; 20: 800—808.
9.Kennel P.F., Vilquin J.T., Braun S. et al. Myasthenia gravis: comparative autoantibody assays using human muscle, TE671 and glucocor- ticoid-treated TE671 cells as sources of antigen. Clin Immunol Immunopathol 1995; 74: 293—296.
10.Lang B., Newsom-Davis J., Prior C., Wray D. Antibody specificities in Lambert—Eaton myasthenic syndrome. Ann NY Acad Sci 1994; 681: 382—393.
11.Lang B., Newsom-Davis J. Immunopathology of the Lambert — Eaton myasthenic syndrome. Springer Seminars in Immunopathology 1995; 17: 3—15.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2006
12.Lennon V.A., Kryzer Th.J., Griesmann G.E. et al. Calcium channel antibodies in the Lambert — Eaton syndrome and other paraneoplastic syndromes. N Engl J Med 1995; 332: 1467—1474.
13.Lennon V.A., Ermilov L.G., Szurszewski J.H., Vernino S. Immunization with neuronal nicotinic acetylcholine receptor induces neurological autoimmune disease. J Clin Invest 2003; 111: 907—913.
14.Lindstrom J., Shelton D., Fujii Y. Myasthenia gravis. Adv Immunol 1988; 42: 233—284.
15.Lindstrom J. Nicotinic acetylcholine receptors in health and disease. Molecular Neurobiology 1997; 15: 2: 193—222.
16.Motomura M., Johnston I., Lang B. et al. An improved diagnostic assay for Lambert — Eaton myasthenic syndrome. J Neurol Neurosurg Psychiat 1995; 58: 85—87.
17.Oh S.J., Sher E. MG and LEMS overlap syndrome: case report with electrophysiological and immunological evidence. Clin Neurophysiol 2005; 116: 5: 1167—1171.
18.O’ Neill J., Murray N., Newsom-Davis J. The Lambert — Eaton myasthenic syndrome. A review of 50 cases. Brain 1988; 111: 577— 596.
19.Vincent A., Whiting P.J., Schluep M. et al. Antibody heterogeneity and specificity in myasthenia gravis. Ann NY Acad Sci 1987; 505: 106— 120.
20.Vernino S., Lennon V.A. Autoantibody profiles and neurological correlations of thymoma. Clin Cancer Res 2004; 10: 7270—7275.
21.Voltz R., Hohlfeld R., Faten-Moghadam A. et al. Myasthenia gravis: measurement of anti-AchR autoantibodies using cell line TE671. Neurology 1991; 41: 1836—1838.
22.Willcox N., Schluep M., Ritter M. A. et al. Myasthenic and nonmyasthenic thymoma: an expansion of a minor cortical epithelial cell subser? Am J Pathol 1987; 127: 447—460.
23.Willcox N. Myasthenia gravis. Curr Opin Immunol 1993; 5: 910— 917.
Поступила 31.08.05
55
Nv_1_06_.p65 |
55 |
20.12.2005, 10:38 |
