
Журнал неврологии и психиатрии / 2010 / NEV_2010_10_040
.pdf
ЭКСПЕРИМЕНТАЛЬНО-ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ
Рецепторный аппарат сосудов головного мозга при артериальной гипертензии
Д.м.н., проф. В.М. ЧЕРТОК1, к.м.н., доц. А.Е. КОЦЮБА
Receptor system of brain vessels in arterial hypertension
V.M. CHERTOK, A.E. KOTSYUBA
Кафедра анатомии человека Владивостокского государственного медицинского университета
Рецепторный аппарат сосудов головного мозга человека в норме и при артериальной гипертензии (АГ) II—III степени исследовали на аутопсийном материале с использованием импрегнации и метода для выявления NADPH-диафоразы. Установлено, что рецепторный аппарат стенки артерий представлен древовидными и клубочковыми приборами, обладающими в основном умеренной активностью ферментов. При АГ в артериях головного мозга отмечаются реактивные и деструктивные нарушения рецепторного аппарата, которые отчетливо проявляются при использовании гистохимического метода. Выраженность изменения нервного аппарата сосудов тесно связана с калибром артерий, их локализацией, тяжестью и продолжительностью заболевания. При этом более ранним и глубоким изменениям подвергаются афферентные волокна и рецепторы артерий мягкой оболочки. Во внутримозговых сосудах реактивные нарушения рецепторных приборов обнаружены при длительно текущей АГ I степени, деструктивные — II—III степени.
Ключевые слова: рецепторы сосудов головного мозга, NADPH-диафораза, артериальная гипертензия.
We conducted a post-mortem study of the receptor system of brain vessels in patients with arterial hypertension (AG), stages I—III, and healthy people using impregnation and a method of measuring NADPH-diaphorase. The receptor system of arterial wall is represented by treelike and glomerular structures with moderate enzyme activity. Reactive and destructive disturbances of the receptor system that were distinctly seen on histochemical preparations were found in brain arteries of AG patients. The intensity of changes in the nervous apparatus of brain vessels was closely related to the artery caliber, their localization, disease duration and severity, with the most early and deep changes in the afferent fibers and receptors of the pia mater arteries. In intracerebral arteries, reactive changes in receptor structures were found in long-term hypertension and destructive changes were found in AG, stages II—III.
Key words: receptors of brain vessels, NADPH-diaphorase, arterial hypertension.
В последние годы вновь приобретает сторонников некогда популярная концепция, согласно которой артериальная гипертензия (АГ) является результатом нарушения нервной регуляции, а изменение барорецепторного рефлекса — основным звеном, инициирующим повышение сосудистого тонуса [23, 35, 38]. Основным «виновником» изменений барорецепции часто называют центральные механизмы регуляции сосудистого тонуса, в первую очередь ядро одиночного пути [22, 30]. Еще в середине прошлого века с использованием классических методов нейроанатомии были представлены убедительные доказательства изменений сосудистых рецепторов при гипертонической болезни, что позволило предположить участие в ее развитии афферентного звена рефлекторной дуги [23, 38]. Позднее было показано, что в функциях чувствительной иннервации немаловажную роль играет ацетилхолин, а изменение его обмена может стать причиной нарушений афферентных механизмов, в том числе и при сосудистой патологии [15]. Затем список включенных в процессы рецепции и проведения нервного импульса веществ пополнился другими биологически активными веществами [6, 39], в том числе и оксидом азота (NO) [9, 20].
Целью настоящего исследования явилось изучение на материале аутопсий рецепторного аппарата сосудов головного мозга при жизни у практически здоровых людей и при АГ I—III степени.
Материал и методы
Артерии мягкой оболочки и вещества мозга изучали на аутопсийном материале в 28 случаях смерти мужчин 22—39 лет от травм, не связанных с повреждением головного мозга.
На основании результатов медицинских осмотров, приведенных в амбулаторных картах поликлиник по месту жительства погибших и представленных в дальнейшем на судебно-медицинскую экспертизу, были сформированы несколько групп: 1-я — 7 практически здоровых; 2-я
—5 больных с АГ. Критериями включения в 1-ю группу явилось прижизненное отсутствие жалоб на состояние здоровья, нормальные показатели артериального давления (систолическое — 110—120 мм рт.ст., диастолическое
—70—80 мм рт.ст.), а также отсутствие отклонений от нормы при других методах исследования. Во 2-ю группу
© В.М. Черток, А.Е. Коцюба, 2010 |
1e-mail: chertokv@ mail.ru |
Zh Nevrol Psikhiatr Im SS Korsakova 2010;110:10:40
40 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 10, 2010 |

РЕЦЕПТОРЫ МОЗГОВЫХ СОСУДОВ ПРИ ГИПЕРТЕНЗИИ
вошли больные с АГ I степени (средние показатели систолического давления — 130—140 мм рт.ст., диастолического — 85—90 мм рт.ст.) и продолжительностью заболевания 1—2 года. 3-ю группу составили больные с аналогичными показателями АД, но длительностью заболевания 3—5 лет. 4-ю и 5-ю группы составляли больные соответственно с АГ II (АД 160—180 и 100—110 мм рт.ст.) и III степени (АД 190—200 и 110—120 мм рт.ст.) по 5 человек с длительностью заболевания 4—6 лет. Верификация диагноза проводилась на основании анализа специалистами субъективных и объективных данных. В группы были включены только больные, не имевшие цереброваскулярных заболеваний, болезней сердца, почек, периферических артерий, сахарного диабета.
В качестве маркера рецепторов использовали выявление NADPH-диафоразы (NADPH-d). Для этой цели образцы ткани обрабатывали по методу В. Hope и S. Vinsent [29]. На препаратах, приготовленных импрегнацией по Кампосу, определяли количество рецепторов и относительную площадь, занимаемую ими в стенке сосуда (из расчета на 1 мм2); долю, приходящуюся на измененные рецепторы, а среди них на реактивно и деструктивно измененные нервные окончания. В энзимопозитивных рецепторах определяли средний показатель активности ферментов, а также долю, приходящуюся на нервные окончания с высокой, умеренной и низкой активностью NADPH-d.
Количественную обработку материала проводили на автоматизированной системе анализа изображений Allegro MC. Методика проведения количественных исследований была подробно изложена ранее [25]. Для удобства сравнения количественных показателей, полученных при изучении сосудистых рецепторов при АГ I—III степени, установленные изменения выражали в процентах от их значений, вычисленных в 1-й группе. Забор материала производился не позднее 6 ч после наступления смерти. Значимость различий средних значений оценивали по t-критерию Стьюдента.
Результаты
При изучении образцов 1-й группы в стенке внутримозговых и пиальных артерий, а также мягкой оболочке мозга постоянно определялись рецепторы, которые отличаются строением и активностью в них ферментов (рис. 1). В более крупных пиальных артериях диаметром 450—200 мкм чаще наблюдались просто устроенные древовидные арборизации, которые с уменьшением калибра сосудов замещались компактными клубочковыми рецепторами (см. рис. 1, а — д). Кустиковые и клубочковые рецепторы выявлялись также в мягкой оболочке, прилежащей к стенке артерий. Чувствительные нервные окончания образованы ветвями нервных волокон диаметром 4—10 мкм. Клубочки имеют величину от 10 до 80 мкм и располагаются по ходу сосудистого русла очень неравномерно: у мест деления и у начала вновь образованных ветвей, отмечается высокая концентрация рецепторов (до 25 на 1 мм2 длины сосуда), на других участках нервные терминали встречаются значительно реже (6—8 на 1 мм2 длины сосуда). Однако во всех случаях относительная плотность NADPH-d-позитивных рецепторов, а также занимаемая ими площадь составляет около 16—20% от величины соответствующих показателей, установленных при импрегнации препаратов.
Во внутримозговых сосудах также встречались кустиковые и клубочковые рецепторы. При гистохимических исследованиях видно, что отростки нервных клеток не только сопровождают сосуды, но и взаимодействуют с ними, оплетая терминалями. Складывается впечатление, что большинство (если не все) нитроксидергических нейронов имеет отношение к иннервации сосудов. На наших препаратах мы наблюдали разные варианты нейровазальных отношений на внутримозговых сосудах (рис. 2). Часто тела нервных клеток лежали на поверхности сосуда или в непосредственной близости от его стенки. В других случаях отростки нейронов, прежде чем достигнуть сосуд, проходили значительное (до 1500—2000 мкм) расстояние от одного нейрона к другому. При этом дендриты и аксоны одного клеточного тела нередко взаимодействовали одновременно с несколькими нейронами и сосудами. NADPH- d-позитивные нейроны могут устанавливать связи одновременно с сосудами разного типа — артериями и венами, артериями и капиллярами, артериями, венами и капиллярами, находящимися в поверхностных и глубоких слоях коры. Иногда рецепторные приборы наблюдаются и в стенке вен.
Рецепторы, выявленные в пиальных и внутримозговых сосудах, заметно отличаются между собой интенсивностью гистохимической реакции (см. рис. 1, д — ж). На отрезках сосудистого русла, зачастую расположенных рядом друг с другом, определяются чувствительные нервные аппараты как с более высокой, так и низкой плотностью отложения продукта реакции, хотя большинство из них обладает умеренной активностью ферментов. В местах деления артерий, у истоков образования мелких артерий и артериол, как правило, располагаются рецепторы с более высокой интенсивностью реакции.
При АГ в пиальных и внутримозговых артериях наблюдаются преобразования структуры рецепторных приборов и активности в них ферментов (рис. 3). Изменения нервного аппарата сосудов слагаются из реактивных и различной степени деструктивных нарушений, тесно связанных с калибром артерий, их локализацией, тяжестью и продолжительностью заболевания. Более ранним и глубоким изменениям подвергаются афферентные волокна и рецепторы артерий мягкой оболочки. Уже при АГ I степени у больных 2-й группы на пиальных артериях любого диаметра встречались рецепторы с явлениями реактивного раздражения, что выражалось прежде всего в усиленном разрастании концевых ретикуляров, избыточном росте образующих их нервных волокон (см. рис. 3, а). Тонкие концевые веточки древоили кустиковидных арборизаций приобретали вид многочисленных петлеобразных извитостей с неравномерными выпячиваниями в виде капель, шаров или муфтообразных расширений, отличающихся высокой активностью ферментов (см. рис. 3, б — г). Подсчеты показывают, что на всех пиальных артериях относительная площадь, занимаемая рецепторами, возрастала примерно одинаково — на 18—20% (p<0,05) (рис. 4, А), а доля измененных рецепторов — на 25—30% (p<0,05) (рис. 4, Б). Среди последних встречались нервные окончания и с явлениями деструкции, но это весьма редкие находки — их доля не превышала 1—3% (см. рис. 4, Б). Афферентные волокна, участвующие в образовании рецепторов, умеренно утолщены (до 8—14 мкм в диаметре), а по их ходу обнаруживаются спиралевидные или лентообразные извитости. В большинстве проводников,
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 10, 2010 |
41 |

ЭКСПЕРИМЕНТАЛЬНО-ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ
а
г
б
д
в |
е |
ж |
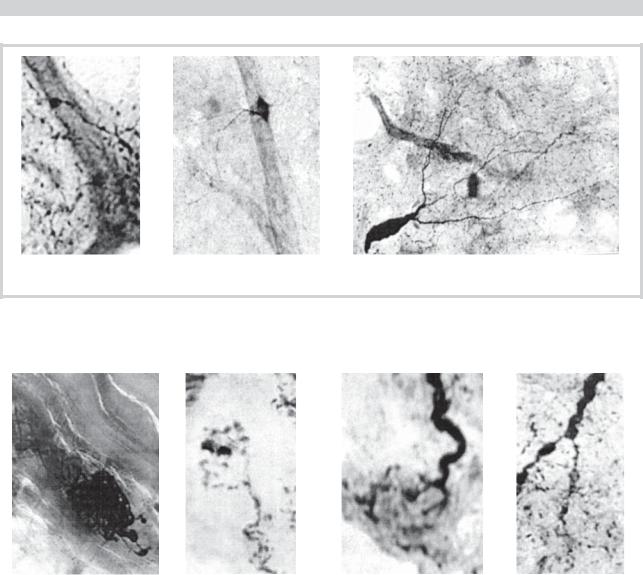
Рис. 1. Рецепторные нервные окончания в артериях и мягкой оболочке головного мозга у практически здоровых людей.
Фрагмент а — рецепторные поля мягкой оболочки; б — д — клубочковые рецепторы на артериях мягкой оболочки; клубочковый (д) и кустиковые (е, ж) рецепторы, отличающиеся активностью NADPH-d, в сосудах мягкой мозговой оболочки.
а — г — импрегнация по Кампосу; д — ж — метод V. Hope и S. Vincent. Увеличение: а — объектив×4,3, окуляр×10; б — ж — объектив×20, окуляр×10.
42 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 10, 2010 |
РЕЦЕПТОРЫ МОЗГОВЫХ СОСУДОВ ПРИ ГИПЕРТЕНЗИИ
а |
б |
в |
Рис. 2. Нейровазальные отношения на внутримозговых сосудах.
а — клубочковый рецептор на внутримозговом сосуде; б, в — варианты нейровазальных отношений. Метод V. Норе и S. Vincent. Увеличение: объектив×20, окуляр×10.
а |
б |
в |
г |
|
|
|
|
Рис. 3. Рецепторные нервные окончания артерий мягкой оболочки мозга при артериальной гипертензии с явлениями реактивного раздражения (а, б) и деструктивных изменений (в, г).
а — импрегнация по Кампосу; б — г — метод V. Hope и S.Vincent. Увеличение: а, б — объектив×20, окуляр×10; в, г — объектив×40, окуляр×10.
особенно в их терминальных отделах, участвующих в фор- |
причем особенно значительно в сосудах тоньше 200 мкм |
мировании рецепторов, повышалась интенсивность реак- |
(см. рис. 4, Б). В той же последовательности возрастали |
ции NADPH-d. Однако, как и в контрольной группе, |
показатели относительной площади рецепторов и доли |
большинство нервных окончаний имели умеренную ак- |
измененных рецепторов в стенке сосуда (см. рис. 4, А, Б). |
тивность энзима, поэтому средние значения показателя |
В мелких артериях с диаметром меньше 80 мкм в 1,5—2 |
увеличивались в среднем на 6—8% (p>0,05). |
раза чаще, чем в сосудах с поперечником 400—200 мкм, |
Сходные качественные изменения нервных прово- |
встречались нервные окончания с очень плотным отложе- |
дников и окончаний наблюдались при АГ I степени с бо- |
нием продукта реакции, приводя к более существенному |
лее длительным сроком развития болезни. При изучении |
повышению среднего показателя активности NADPH-d |
образцов 3-й группы наблюдалось увеличение размеров |
(рис. 5). |
клубочков, некоторые из которых достигали 100—120 |
При дальнейшем прогрессировании заболевания (в |
мкм, а их число 10—14 на 1 мм2 длины сосуда. У мест деле- |
образцах 4-й и 5-й групп) в артериях мягкой оболочки |
ния артериальных стволов концентрация рецепторов воз- |
мозга общее количество измененных рецепторов досто- |
растала более значительно: до 25—30 на 1 мм2 длины со- |
верно не менялось (p>0,05), но среди них существенно |
суда. Среди них преобладали признаки реактивного раз- |
возрастала доля чувствительных окончаний и нервных |
дражения чувствительных окончаний. Однако количество |
проводников с деструктивными изменениями (см. рис. 4, |
деструктивно измененных рецепторов увеличивалось, |
Б). В этих случаях нервные волокна, формирующие ре- |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 10, 2010 |
43 |
ЭКСПЕРИМЕНТАЛЬНО-ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ
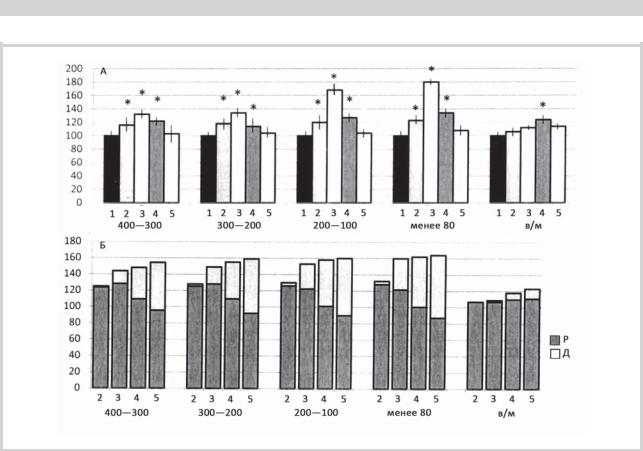
Рис. 4. Изменения количественных показателей при артериальной гипертензии в рецепторах сосудов разного диаметра, выявленных методом импрегнации, во 2-й — 5-й группах.
А — относительная площадь, занимаемая рецепторами в стенке сосудов (мм); Б — доля измененных рецепторов, в том числе реактивно (Р) и деструктивно (Д) измененных нервных окончаний. По оси ординат — диаметр сосудов мягкой оболочки головного мозга: 400—300; 200—100 и меньше 80 мкм, а также во внутримозговых сосудах (в/м) диаметром менее 80 мкм. По оси абсцисс — процентное соотношение указанных показателей. За 100% принята величина соответствующих показателей в образцах 1-й группы: * — р<0,05 по сравнению с 1-й группой.
цепторные аппараты, неравномерно утолщены и интенсивно окрашивались. Строение афферентных проводников в большей или меньшей степени нарушено. По их длине обнаруживались участки с интенсивным отложением продукта гистохимической реакции, другие — бледно красились, а их анатомическая целостность прерывалась участками, имеющими мелкозернистую структуру. Появляются сильно извитые, неравномерно утолщенные, иногда фрагментированные волокна. Тонкие концевые веточки, которые в норме образуют концевые аппараты, находились на некотором расстоянии от рецепторного волокна, или не определялись совсем. В ряде случаев в клубочковых рецепторах чаще мелких пиальных артерий терминальные волокна отличались интенсивным отложением преципитата, а их утолщенные дистальные концы как бы «ампутированы» (см. рис. 3, в). Уменьшалась концентрация (до 2—4 на 1 мм2) чувствительных окончаний. Отмеченные изменения приводили к сокращению значений относительной площади рецепторов, особенно выраженному в мелких пиальных сосудах (p<0,05) (см. рис. 4, А). В стенке сосудов выявлялось также небольшое число клубочков с неструктурированным содержимым, которое отличалось низкой плотностью отложения NADPH-d. Однако, несмотря на это, доля рецепторов с высокой активностью фермента была очень велика — на 30—40% больше
контрольных цифр, что приводило к значительному повышению среднего показателя активности фермента у больных 4-й и 5-й групп (p<0,05) (см. рис. 5). Между тем даже при АГ III степени в сосудах любого калибра сохранялось немалое количество вполне нормальных нервных окончаний.
В органных сосудах преобразования рецепторных приборов были сходны с теми, что наблюдаются в оболочечных артериях, однако в качественном и количественном отношении уступали изменениям, установленным в пиальных сосудах соответствующего калибра (см. рис. 4 и 5). Отметим, что в образцах 2-й группы абсолютное большинство воспринимающих чувствительных аппаратов сосудов не отличалось от контрольных образцов. В 3-й группе больных с длительным периодом течения АГ около 90% нервных проводников и рецепторов также не обнаруживали признаков раздражения, в других — преобладали реактивные преобразования (см. рис. 3, а, б). На отдельных внутримозговых сосудах в этот период прослеживались деструктивные изменения рецепторных приборов. Более выраженные деструктивные нарушения афферентного компонента иннервации органных сосудов можно наблюдать при АГ II или III степени (см. рис. 3, в, г). В этих случаях появлялись сильно извитые, неравномерно утолщенные, иногда фрагментированные волокна. Одновременно
44 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 10, 2010 |
РЕЦЕПТОРЫ МОЗГОВЫХ СОСУДОВ ПРИ ГИПЕРТЕНЗИИ
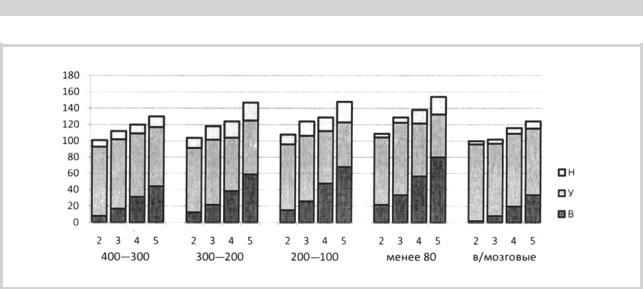
Рис. 5. Изменение среднего показателя активности NADPH-диафоразы и доля среди них нервных окончаний с высокой (В), умеренной (У) и низкой (Н) активностью фермента во 2-й — 5-й группах.
По оси ординат — диаметр сосудов мягкой оболочки головного мозга: 400—300; 200—100 и меньше 80 мкм, а также во внутримозговых сосудах (в/м) диаметром менее 80 мкм. По оси абсцисс — процентное соотношение указанных показателей. За 100% принята величина соответствующих показателей в образцах 1-й группы.
выявлялись многочисленные рецепторы с явлениями реактивных изменений в виде разрастаний тонких терминалей, которые по своему ходу формируют спиралевидные скручивания и множественные расширения.
Обсуждение
Регуляция мозгового кровообращения — сложная система, обеспечивающая циркуляторный и метаболический гомеостаз в ткани мозга [16, 17, 24]. В литературе представлены убедительные доказательства активного участия в этом процессе чувствительной иннервации мозговых сосудов [17, 24]. Однако большинство работ, выполненных современными методами морфологического анализа, были направлены на изучение эфферентной иннервации сосудов мозга [10, 14, 24]. Проведенные нами исследования показали, что в стенке артерий мягкой оболочки и вещества мозга находятся разнообразные по форме рецепторные окончания и многочисленные афферентные волокна. Примерно в пятой части рецепторов обнаруживается NADPH-d, элективно маркирующая NOсинтазу (NOS), которая является ферментом синтеза NO [19, 29]. Широкое представительство NOS в структурных элементах чувствительной иннервации мозговых артерий разного диаметра позволяет рассматривать NO в качестве вероятного кандидата в обеспечении афферентной функции сосудов, а различия в интенсивности гистохимической реакции в рецепторах свидетельствуют в пользу непосредственного участия этого газообразного посредника
врегуляции кровотока.
Сиспользованием метода электронной цитохимии было показано, что NOS определяется по всей длине дендрита, включая его окончание, миелиновую оболочку и тело нейрона [26]. Эти данные свидетельствуют, что наряду с ортоградным транспортом NO возможен его локальный синтез в терминальной части дендрита. Вероятно, что к этим механизмам имеют отношение и другие медиаторы. В частности, в стенке артерий мягкой оболоч-
ки головного мозга выявлены рецептивные поля, содержащие АХЭ [8, 32], а спинного — L-аспартат [14].
Действие NO в нервной системе разнообразно. Он может как увеличивать, так и уменьшать возбудимость нейронов, контролировать их «пачечную» и тоническую активность [5, 13, 36, 40]. Он способен выступать медиатором проведения нервного импульса в афферентном и эфферентном волокнах, участвовать в различных видах рецепции (ноци-, термо-, тензоцепция, обоняние), передавать возбуждение на гладкую или поперечнополосатую мускулатуру [20, 31, 33]. NO сосуществует в нервных клетках с другими традиционными медиаторами, но чаще определяется в холинергических нейронах, в которых NOS выявляется вместе с АХЭ и холинацетилтрансферазой [21].
В периферической нервной системе эндогенный NO облегчает высвобождение ацетилхолина путем активации гуанилатциклазы и выходом на сигнальный путь вторичного мессенджера цГМФ [11, 12, 37]. Последний, активируя натрий-калиевый насос наружной клеточной мембраны, приводит к изменению электрического потенциала мембраны и генерации нервного импульса [21]. Однако в энтеральной нервной системе NO обладает ингибиторным действием на вызванное освобождение ацетилхолина [7, 36]. Ацетилхолин в свою очередь может активировать NOS, стимулируя, таким образом, выработку NO [10]. Возможностью взаимного влияния на функциональные свойства друг друга ацетилхолин и NO в обычных условиях жизнедеятельности организма обеспечивают тонкую регуляцию афферентного потока, адаптируя его к потребностям организма.
Относительная нестойкость NO (время полужизни составляет 5 с) и небольшие количества (измеряемые пикомолями), образующиеся в нейронах, делают его идеальным локальным регулятором гомеостаза, способным осуществлять быстрые процессы адаптации рецепторов к меняющимся условиям среды [21, 39]. Подтверждением этому могут служить и наши данные, свидетельствующие,
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 10, 2010 |
45 |

ЭКСПЕРИМЕНТАЛЬНО-ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ
что на отрезках сосудистого русла, зачастую расположенных недалеко друг от друга, обнаруживаются чувствительные нервные окончания, отличающиеся не только структурой, но и интенсивностью гистохимической реакции. При этом повышение активности ферментов наблюдается, как правило, в рецепторах, которые находятся в функционально важных участках сосудистого русла: в местах деления артерий, у начала вновь образующихся мелких артерий и артериол — этих своеобразных кранов артериальной системы. Рецепторный сигнал, возникающий в периферической части дендритов, передается к нейронам сердечно-сосудистого центра, сигнализируя об изменении кровяного давления, тонусе и сократительной деятельности сосудов, количестве протекающей по ним крови, обеспечивая перераспределение кровотока в пользу активно работающих зон мозга и создавая необходимые предпосылки для нормальной работы нейронов.
При АГ наблюдаются различной степени выраженности реактивные и деструктивные нарушения чувствительной иннервации головного мозга, которые отчетливо проявляются при использовании нейроанатомического и гистохимического методов. По сумме наблюдений складывается впечатление, что при начальных проявлениях болезни изменения афферентной иннервации более выражены в артериях мягкой оболочки, чем внутримозговых сосудах. Проведенные нами исследования у больных 2-й группы не позволяют связать количество и глубину изменений рецепторов и нервных проводников на этом этапе болезни с каким-то определенным калибром пиальных артерий. При увеличении длительности болезни преобразованиям все чаще подвергаются чувствительные аппараты более мелких пиальных артерий, следуя, очевидно, за общей реакцией артериальной сети мягкой оболочки, возникающей при повышении АД [4, 27], и изменениями эфферентной иннервации артерий мозга [10].
На пиальных сосудах любого диаметра у исследуемых 3-й группы отмечалось усиленное разрастание рецепторов, в 1,5 раза возрастали значения средней площади рецептивного поля и относительного количества чувствительных окончаний. На 16—20% увеличивались показатели доли, приходящейся на энзимопозитивные рецепторы. Наблюдалось утолщение нервных проводников, а как проявление избыточного роста по их ходу обнаруживались спиралевидные или лентообразные извитости. В большинстве рецепторов и нервных волокон повышалась интенсивность реакции NOS и, как следствие, существенно увеличивался средний показатель активности ферментов.
Расширение иннервируемой площади и увеличение потока генерируемых импульсов вызывает гипертрофию афферентного нейрона, увеличение его объема [14]. Начиная с Кахаля, гипертрофию клетки, реактивный рост и разрастание нервных структур принято считать одним из основных признаков приспособительных изменений в нервной системе. Адаптационные процессы начинаются на уровне рецепторов, захватывая постепенно все нейронные уровни сенсорной системы. Экспериментально установлено, что в некоторых рецепторах процессы приспособления проходят довольно быстро, после чего они практически не сообщают в мозг о длящемся раздражении, но и в других, медленно адаптирующихся, информация передается в значительно ослабленном виде. В сенсорной адаптации важную роль играют эфферентные воз-
действия, которые чаще всего имеют тормозной характер, ограничивая тем самым поток афферентных сигналов [18].
Впоследние годы обсуждается значение в этом процессе повышения концентрации NO в нервной клетке. В больших концентрациях, образующихся, как правило, индуцибильной изоформой NOS, оксид азота может производить токсический эффект [21]. Известно, что у человека при различных формах сосудистой патологии, хронической сердечной недостаточности наблюдается повышение активности NOS и значительное увеличение синтеза NO [34, 35]. Гиперпродукция этой регуляторной молекулы увеличивает порог возбуждения, что приводит к уменьшению чувствительности рецепторов [18].
Даже при небольшом, но стойком повышении кровяного давления приспособительные изменения афферентной импульсации вызывают рефлекторное повышение тонуса сосудосуживающего центра, вследствие чего сосуды сокращаются и артериальное давление повышается. Целесообразность таких изменений весьма относительна. Возникая как адаптация, они могут служить путями распространения и передачи патологических раздражителей, создавая условия не только для генерализации афферентных импульсов, но делая их в дальнейшем постоянными, длительными и нарастающими [18].
Втаком процессе, как длительная синаптическая потенциация, значение NO проявляется наиболее ярко. В этом случае Ca2+ под влиянием нейротрансмиттера возбужденного нейрона входит в клетку, где связывается в единый комплекс с кальмодулином в цитозоле. Комплекс Ca — кальмодулин выступает как кофактор, активирующий NOS, что приводит к увеличению синтеза NO. Оксид азота, диффундируя в соседние клетки, активизирует в них образование цГМФ, под влиянием которого изменяется проводимость ионных каналов, а следовательно, и электрогенез нейронов. Этот процесс обеспечивает усиление и увеличение длительности выделения из пресинапса нейромедиатора, который в свою очередь оказывает возбуждающее действие на постсинаптический нейрон и приводит к возникновению обратной положительной связи с постоянным усилением [21, 35]. В изменившихся условиях происходит как бы перенастройка свойств нейронов на оптимальное восприятие внешних сигналов. Во многом благодаря NO центр сосудистой регуляции при хронической АГ постоянно находится в состоянии повышенного возбуждения.
Как известно, перегрузка функциональных систем вызывает их повреждение [1]. По мере прогрессирования заболевания нарастают изменения чувствительной иннервации мозговых сосудов. У больных 4-й и особенно 5-й группы часто встречались рецепторы, терминальные ветви которых утолщены, а дистальные концы находятся на некотором расстоянии от нервного волокна или не определяются совсем, что приводило к значительному уменьшению площади рецептивного поля. Уменьшалось
иколичество энзимопозитивных рецепторов, хотя многие из них в этот период отличаются исключительно высокой активностью NOS.
Описанные изменения афферентной иннервации сосудов мозга приводят к истощению компенсаторных возможностей регуляторных центров, и они сами начинают посылать на периферию извращенные импульсы, усугубляя и без того имеющиеся нарушения кровообращения в
46 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 10, 2010 |

РЕЦЕПТОРЫ МОЗГОВЫХ СОСУДОВ ПРИ ГИПЕРТЕНЗИИ
мозге. Этот процесс затрагивает функционально различные группы ядер продолговатого мозга, входящие в состав так называемого «бульбарного вазомоторного центра». При гипертензии как в чувствительных, так и двигательных ядрах отмечено уменьшение концентрации NOпозитивных нейронов и активности в них фермента [2]. Снижение активности нитроксидергической системы является одной из причин гиперактивации симпатической
нервной системы и стойкого повышения артериального давления [21, 23], что в свою очередь провоцирует ремоделирование сосудистой стенки и смещение артериальной гипертензии в сторону более высокого давления [3, 28]. Совокупность отмеченных изменений закрепляет синдром гипертензии и играет известную роль в патогенезе тяжелых сосудистых осложнений этой болезни.
ЛИТЕРАТУРА
1.Анохин П.К. Очерки по физиологии функциональных систем. М: Ме22. Цырлин В.А., Хрусталев Р.С. Роль адренергических механизмов мозго-
дицина 1975; 445.
2.Бабич Е.В., Чертока В.М., Коцюба А.Е. Нитроксидергические нейроны в ядрах продолговатого мозга у нормо- и гипертензивных крыс. Бюл экспер биол 2009; 147: 8:157—160.
3.Бойцов С.А. Что мы знаем о патогенезе артериальной гипертензии? Артериальная гипертензия 2004; 5: 1—10.
4.Ганнушкина И.В., Лебедева Н.В. Гипертоническая энцефалопатии. М: Meдицина 1987; 224.
5.Зефиров А.Л., Халиуллина Р.Р., Анучин А.А. Эффекты экзогенного оксида азота на секрецию медиатора и ионные токи двигательного нервного окончания. Бюл экспер биол 1999; 128: 8: 144—147.
6.Калиниченко С.Г., Мотавкин П.А. Кора мозжечка. М: Наука 2005; 319.
7.Капилевич Л.В., Баскаков М.Б., Ковалев И.В. и др. Роль оксида азота во внутриклеточной регуляции гладкомышечных клеток. Вестн СибГМУ 2000; 1: 7—19.
8.Коцюба А.Е. Активность NADPH-диафоразы и ацетилхолинэстеразы
врецепторном аппарате артерий мягкой оболочки головного мозга человека и ее изменения при артериальной гипертензии. Дальневосточный мед журн 2009; 2: 99—101.
9.Коцюба А.Е., Черток В.М. Нитроксидсодержащие элементы чувствительной иннервации артерий головного мозга. Тихоокеанский мед журн 2009; 2: 69—72.
10.Коцюба А.Е., Бабич Е.В., Черток В.М. Вазомоторная иннервация мягкой оболочки головного мозга человека при артериальной гипертензии. Журн неврол и психиат 2009; 109: 9: 56—62.
11.Кравченко Н.А., Ярмыш Н.В. Биохимические и молекулярногенетические механизмы регуляции синтеза оксида азота эндотелиальной NO-синтазой в норме и при сердечно-сосудистой патологии. Украiнський терапевтичний журн 2007; 1: 82—89.
12.Марков Х.М. Оксид азота и сердечно-сосудистая система. Успехи физиол наук 2001; 32: 3: 49—65.
13.Меньшиков Е.Б., Зенков Н.К., Реутов В.П. Оксид азота и NO-синтазы
ворганизме млекопитающих при различных функциональных состояниях. Биохимия 2000; 65: 4: 485—503.
14.Мотавкин П.А., Пиголкин Ю.И., Каминский Ю.В. Гистофизиология крвообращения в спинном мозге. М: Наука 1994; 233.
15.Мотавкин П.А., Черток В.М., Пиголкин Ю.И. Морфологические исследования регуляторных механизмов внутримозгового кровообращения. Арх анат 1982; 82: 6: 42—49.
16.Мотавкин П.А., Черток В.М. Гистофизиология сосудистых механизмов мозгового кровообращения. М: Медицина 1980; 200.
17.Мотавкин П.А., Черток В.М. Иннервация мозга. Тихоокеанский мед журн 2008; 3: 11—23.
18.Основы психофизиологии: Учебник. Отв. ред. Ю.И. Александров. М: ИНФРА-М 1998; 432.
19.Охотин В.Е., Куприянов В.В. Нейровазальные отношения в новой коре головного мозга человека. Морфология 1996; 110: 4: 17—22.
20.Охотин В.Е., Шуклин А.В. Значение нейрональной, эндотелиальной и индуцибельной изоформ NO-синтаз в гистофизиологии сердечной мышцы. Морфология 2006; 129: 1: 7—17.
21.Сосунов А.А. Оксид азота как межклеточный посредник. Соровский образовательный журн 2000; 6: 12: 27—34.
вого ствола и спинного мозга в центральной регуляции кровообращения. Вестн аритмол 2001; 22: 75—80.
23.Цырлин В.А. Бульбарный вазомоторный центр — морфофункциональная и нейрохимическая организация. Артериальная гипертензия 2003; 9: 3: 77—81.
24.Черток В.М., Пиголкин Ю.И. Иннервация пиальных артерий разного диаметра человека при атеросклерозе. Журн невропатол и психиат 1990; 90: 12: 43—46.
25.Черток В.М., Афанасьев А.А., Коцюба А.Е. Применение автоматизированной системы анализа изображений Allegro MC для морфометрических исследований. Морфология 2003; 124: 4: 88—93.
26.Черток В.М., Коцюба А.Е. Оксид азота в механизмах афферентной иннервации артерий головного мозга. Цитология 2010; 52: 1: 24—29.
27.Черток В.М., Коцюба А.Е., Бабич Е.В. Эфферентная иннервация артерий мягкой оболочки мозга человека при артериальной гипертензии. Морфология 2009; 135: 3: 35—41.
28.Шляхто Е.В., Моисеева О.М. Клеточные аспекты ремоделирования сосудов при артериальной гипертензии. Артериальная гипертензия 2002; 8: 2: 45—49.
29.Hope B.T., Vincent S.R. Histochemical characterization of neuronal NA- DPH-diaphorase. J Neurochem Cytochem 1989; 37: 653—661.
30.Ma S.-X., Fang Q., Morgan B. et al. Cardiovascular regulation and expressions of NO synthase-tyrosine hydroxylase in nucleus tractus solitarius of ovine fetus. Am J Physiol Heart Circ Physiol 2003; 284: 4: 1057—1063.
31.Mohan R.M., Choate J.K., Golding S. et al. Peripheral presinaptic pathway reduces the heart rate response to sympathetic activation following exercise training:role of NO. Cardiovasc Res 2000; 47: 1: 90—98.
32.Motavkin P.A., Lomakin A.V., Pigolkin Y.I. et al. Receptor glomeruli and their ultrastructural organization in the arteries and pia mater of the human brain and spinal cord. Neuroscience and Behavioral Physiol 1990; 20: 5: 471—475.
33.Okhotin V.E., Goncharuk V.D. Nitric oxide containing and receptor terminals in the rabbit heart. Medicina 1996; 32: 4: 111—112.
34.Panza J.A., Casino P.R., Kilcoyne C.M. et al. Role of endothelium—derived nitric oxide in the abnormal endothelium—dependent vascular relaxation of patients with essential hypertension. Circulation 1993; 87: 1468—1474.
35.Patel K.P., Li Y.-F., Hirooka Y. Role of nitric oxide in central sympathetic outflow. Experimental Biol and Med 2001; 226: 814—824.
36.Prast H., Philippu A. Nitric oxide as modulator of neuronal function. Progr Neurobiol 2001; 64: 51—68.
37.Schuman E.M., Madison D.V. Nitric oxide and synaptic function. Annu Rev Neurosci 1994; 17: 153—183.
38.Spyer K.M. Neural organisation and control of the baroreceptor reflex. Rev Physiol Biochem and Pharmacol 1981; 88: 123—124.
39.Toda N., Okamura T. The pharmacology of nitric oxide in the peripheral nervous system of blood vessels. Pharmacol Rev 2003; 55: 271—324.
40.Tomas S., Robitaille R.J. Differential frequency-dependent regulation of transmitter release by endogenous nitric oxide at the amphibian neuromuscular synapse. Neuroscience 2001; 21: 4: 1087—1095.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 10, 2010 |
47 |
