
Журнал неврологии и психиатрии / 2010 / NEV_2010_05_033
.pdf
Холинергическая терапия болезни Альцгеймера и ее влияние на здоровье и качество жизни ухаживающих за больными лиц
К.м.н., в.н.с. И.В. КОЛЫХАЛОВ1, врач Г.А. РАССАДИНА2, д.м.н., проф. С.И. ГАВРИЛОВА1, к.м.н., гл. врач Н.П. ГЕРАСИМОВ2
Cholinergic therapy of Alzheimer’s disease and its effect on health and quality of life of caregivers to the patients
I.V. KOLYKHALOV, G.A. RASSADINA, S.I. GAVRILOVA, N.P. GERASIMOV
1Отдел по изучению болезни Альцгеймера и ассоциированных с ней расстройств Научного центра психического здоровья РАМН;
2Психиатрическая клиническая больница №15, Москва
Оценка эффективности и безопасности 4-месячного курса терапии ривастигмином, а также изучение динамики показателей, оценивающих нагрузку на лиц, осуществляющих уход за больными, были выполнены на невыборочной группе из 25 пациентов с болезнью Альцгеймера (БА). Всем пациентам ривастигмин назначался внутрь, а 22 больным при поступлении в стационар одновременно с ривастигмином назначалась также антипсихотическая терапия. Лечение продолжалось 16 нед (12 нед в стационаре и 4 нед амбулаторно). Исследование показало, что применение ривастигмина у пациентов БА с поведенческими и психотическими расстройствами на стадии умеренно выраженной деменции улучшает не только когнитивное функционирование больных, но и положительно влияет на редукцию у них психотических
иповеденческих расстройств. Включение ривастигмина в комплексную терапию пациентов с БА приводит к существенному снижению доз необходимых психотропных препаратов, а у ряда больных — и к полной отмене всех антипсихотических средств. Чрезвычайно важно подчеркнуть, что применение терапии ривастигмином у пациентов с умеренно выраженной БА и поведенческими расстройствами приводит к существенному (до 30%) снижению времени, затрачиваемому на уход
иприсмотр за такими пациентами, уменьшению уровня стрессовой нагрузки и улучшению здоровья лиц, ухаживающих за больными, что сказывается на повышении качества жизни как самого больного, так и его семьи.
Ключевые слова: болезнь Альцгеймера, холинергическая терапия, ривастигмин, ухаживающие за больными, качество жизни.
To assess efficacy and safety of 4-month therapy with rivastigmine in Alzheimer’s disease (AD) and to evaluate the burden of caregivers to these patients, 25 AD patients have been studied. Rivastigmine was prescribed internally and 22 patients were assigned to additional antipsychotic therapy at the admission to the hospital. The treatment duration was 16 weeks (12 weeks in the hospital and 4 weeks after the discharge). The study revealed that rivastigmine improved cognitive functions and led to the reduction of psychotic and behavioral disorders in AD patients at the moderate stage of the disease. The inclusion of rivastigmine in the complex treatment of AD patients resulted in the significant reduction in doses of necessary psychotropic drugs and in the complete withdrawal of all antipsychotic drugs in some patients. It should be specifically emphasized that the treatment with rivastigmine of patients with moderate AD and behavioral disorders led to the significant (up to 30%) reduction of the time spent for caregiving, the decrease of burden and the health improvement of caregivers that increase quality of life of both the patient and the family.
Key words: Alzheimer's disease, cholinergic therapy, rivastigmine, caregivers, quality of life.
В 2005 г. в мире насчитывалось 24,3 млн лиц, страдаю- |
торы публикаций на тему БА именуют ее «молчаливой |
|
щих деменцией и ежегодно регистрируется еще 4,6 млн |
эпидемией» или «тикающей бомбой» [8, 12, 14]. В послед- |
|
новых случаев [3]. Наиболее частой причиной деменции |
ние годы опубликован целый ряд работ [1, 13, 15, 16], уде- |
|
остается болезнь Альцгеймера (БА), на долю которой при- |
ляющих внимание влиянию БА на людей, которые осу- |
|
ходится 60—70% случаев деменции в Европе [5]. Ожидает- |
ществляют уход за пациентами с этим заболеванием, в том |
|
ся, что показатели распространенности БА вырастут к |
числе на изменение качества их жизни и здоровья. Наи- |
|
2014 г. в развитых странах вдвое, а в развивающихся (та- |
более сильно возрастает груз проблем, связанных с уходом |
|
ких как Китай, Южная Азия и западный тихоокеанский |
и присмотром за пациентами, когда болезнь достигает |
|
регион) — втрое [3]. |
стадии умеренной и особенно тяжелой деменции, что, как |
|
БА причиняет страдания не только самим больным, |
правило, сопровождается появлением поведенческих и |
|
но и членам их семей, осуществляющим уход за пациента- |
психотических симптомов. |
|
ми. Рост численности таких больных будет в ближайшие |
По данным Альцгеймеровской ассоциации [2], 40% |
|
годы становиться еще большей нагрузкой и для служб об- |
родственников, ухаживающих за пациентами с деменци- |
|
щественного здравоохранения. В связи с этим многие ав- |
ей, оценивают собственный эмоциональный стресс, раз- |
|
|
|
|
© Коллектив авторов, 2010 |
e-mail: ikolykhalov@yandex.ru |
|
Zh Nevrol Psikhiatr Im SS Korsakova 2010;110:5:33 |
|
|
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 5, 2010 |
33 |

ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
вивающийся из-за необходимости ухода за этими больными и совместного проживания с ними, как высокий или очень высокий, а примерно треть из них имеют признаки депрессии. Появление стресса у ухаживающего лица особенно тесно связано с наличием поведенческих нарушений у больных и необходимостью принятия решения о помещении их опекаемого в стационар. По данным отчета указанной ассоциации [2], у непосредственно ухаживающих за больными лиц нарушения здоровья более выражены по сравнению с другими членами семьи. У них отмечаются значительные гормональные стрессовые сдвиги, снижен иммунитет, медленнее заживают раны, более выражена сердечно-сосудистая патология (гипертония и ишемическая болезнь сердца), имеются признаки ускоренного старения, в том числе на генетическом уровне (укорочение теломер).
Всвязи со сказанным актуальность приобрел вопрос
отом, в какой степени лечение пациентов с БА способно оказать позитивное влияние не только на их когнитивное и повседневное функционирование, но и снизить нагрузку (как физическую, так и психологическую) на осуществляющих повседневный уход членов семьи и соответственно улучшить их качество жизни и состояние здоровья.
Целью данного исследования являлась оценка эффективности и безопасности 4-месячного курса терапии ривастигмином у пациентов с психотическими и поведенческими расстройствами при умеренно выраженной деменции, связанной с БА, с учетом динамики показателей нагрузки на лиц, осуществляющих уход за больными.
Материал и методы
Настоящая работа была выполнена как простое, открытое исследование. Обследовали невыборочную группу из 25 пациентов с БА, поступивших на лечение связи с поведенческими или психотическими расстройствами в мужское геронтопсихиатрическое отделение Московской городской клинической психиатрической больницы №15. Им была назначена терапия ривастигмином в течение 12 нед. После выписки из стационара больные продолжали лечение ривастигмином в течение последующих 4 нед в амбулаторных условиях. Таким образом, общая продолжительность лечения была 16 нед.
Критериями включения пациентов в исследование были: диагноз БА, установленный в соответствии с критериями МКБ-10 и соответствующий диагностическим критериям БА NINСS/ADRDA [9] для «вероятной»; возраст от 50 до 95 лет включительно; 2-я стадия деменции по критериям Clinical Dementia Rating (CDR) [11] на момент скринингового визита; оценка по шкале Хачински <5 баллов; оценка по шкале Mini-Mental State Examination (MMSE) в диапазоне от 10 до 18 баллов; наличие нейровизуализационных признаков БА или смешанной (альцгеймеровско-сосудистой) деменции по данным КТ или МРТ, сделанным в период не более 1 года до начала терапии; наличие постоянно проживающего совместно с пациентом ближайшего родственника или другого попечителя, который осуществляет наблюдение и ухаживает за больным; отсутствие противопоказаний к приему препарата внутрь в течение предусмотренного времени; отсутствие показаний к одновременному проведению терапии препаратами, способными исказить результаты исследо-
вания; отсутствие грубого двигательного или сенсорного дефекта или иных нарушений, которые могут затруднить оценку первичных или вторичных переменных.
Критерии исключения: неврологические заболевания
— врожденные и/или приобретенные метаболические энцефалопатии, токсические и лекарственные энцефалопатии, болезнь Паркинсона, мультиинфарктная деменция, инсульт, эпилепсия, инфекционные заболевания, демиелинизирующие и наследственно-дегенеративные заболевания ЦНС; неопластические и/или травматические повреждения головного мозга; системные заболевания; психические болезни; тяжелая органная патология, злокачественные опухоли, ВИЧ-инфекция, сахарный диабет в стадии декомпенсации, другие эндокринные заболевания; алкоголизм и/или лекарственная зависимость; медикаментозная или иная интоксикация; одновременное проведение иной терапии, которая способна исказить результаты исследования или неблагоприятно взаимодействовать с исследуемым препаратом; наличие брадикардии (частота сердечных сокращений <50).
Всем пациентам ривастигмин назначался внутрь. У 21 больного путем титрования доза ривастигмина была доведена до 12 мг в сутки, 4 человека не смогли завершить участие в исследовании из-за нежелательных явлений. При поступлении в стационар 22 больным одновременно
сривастигмином назначалась антипсихотическая терапия: 8 больных принимали тиапридал (до 300 мг в сутки), 5 — сероквель (до 100 мг в сутки), 3 — пропазин (до 150 мг в сутки), 1 — рисполепт (2 мг в сутки), кроме того, 3 больным назначалась сочетанная терапия пропазином и тиапридалом, 1 больной принимал галоперидол и тиапридал, еще 1 пациент — сероквель и тиаптридал.
При поступлении у большинства пациентов было диагносцировано обострение хронических соматических заболеваний, которые могли спровоцировать появление поведенческих и психотических расстройств. Так, у 10 больных, страдающих гипертонической болезнью, при поступлении отмечалось повышение АД до 180—220/100 мм рт.ст., у 5 — повышение уровня сахара в крови и обострение хронического бронхита, а у 6 — обострение хронического пиелонефрита. При выписке из стационара (через 12 нед) соматическое состояние всех больных удалось скомпенсировать. Пациенты с гипертонической болезнью получали эналаприл, амлодипин и метопролол, больные с сахарным диабетом — диабетон и сиофор, пациенты
собострением хронического пиелонефрита лечились уроантисептиками.
Для оценки терапевтической динамики когнитивного функционирования использовались краткая шкала оценки психического статуса — MMSE [6] и когнитивная подшкала шкалы оценки БА — ADAS-Cog (Alzheimer’s Disease Assessment Scale—Cognitive subscale [10]), оценка повседневной активности больных проводилась по шкале DAD (Disability Assessment for Dementia [7]), выраженность поведенческих и психотических симптомов деменции оценивалась по специальному нейропсихиатрическому опроснику — NPI (Neuropsychiatric Inventory [4]). Для определения нагрузки на лиц, ухаживающих за больными, применялся опросник RUD (Resource Utilization in Dementia [17]).
Оценка состояния пациентов осуществлялась до начала терапии (0-й день) и к моменту окончания курса лечения ривастигмином — после 16 нед по перечисленным
34 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 5, 2010 |

ТЕРАПИЯ БОЛЕЗНИ АЛЬЦГЕЙМЕРА
выше шкалам. Кроме того, состояние пациентов дополнительно оценивалось по когнитивным шкалам MMSE и ADAS-cog к концу 12-й недели лечения, т.е. на момент выписки больного из стационара.
Оценка нагрузки на лиц, ухаживающих за больными в домашних условиях (шкала RUD), проводилась при поступлении больного в стационар и через 4 нед после выписки, т.е. после 16 нед лечения пациента ривастигмином.
Втабл. 1 представлены демографические показатели
ихарактеристика клинического состояния больных к началу исследования, в том числе средне-групповые показатели когнитивного функционирования, повседневной активности и выраженности поведенческих и психотических симптомов деменции.
Статистическая оценка результатов проводилась с использованием программы Statistica, версия 6. Для подтверждения достоверности результатов терапии использовались методы непараметрической статистики — вычисление критерия Вилкоксона (для выборок с любым распределением признаков).
Результаты и обсуждение
В соответствии с общим клиническим впечатлением (шкала CGI) положительный эффект терапии после 16 нед лечения был отмечен у 76% больных, при этом у 28% улучшение было умеренно выраженным; у 12% пациентов изменений состояния не наблюдалось и у 12% состояние оценивалось как минимальное ухудшение.
Улучшение в состоянии больных определялось в большей мере редукцией поведенческих и психотических расстройств и в меньшей степени — улучшением их когнитивного функционирования.
Динамика состояния когнитивных функций пациентов
Достоверное улучшение когнитивного функционирования пациентов по сравнению с исходным уровнем (шкалы MMSE и ADAS-cog) наблюдалось уже к окончанию 12-й недели терапии ривастигмином. На протяжении последующих 4 нед лечения отмечалось нарастание позитивного эффекта в отношении когнитивных функций (табл. 2).
Повседневное функционирование пациентов по шкале DAD
Шкала DAD включает в себя 40 пунктов, оценивающих навыки физического самообслуживания, в том числе прием пищи и лекарств, одевание, уход за собой, а также работа по дому, приготовление еды, передвижение, фи-
Таблица 1. Демографическая и клиническая характеристика группы больных к началу исследования
Показатель |
M±m |
Число больных с БА |
|
с ранним началом |
7 |
с поздним началом |
18 |
Средний возраст, годы |
73,1±1,3 |
MMSE, баллы |
14,0±0,6 |
ADAS-cog, баллы |
36,2±1,4 |
NPI, баллы |
39,1±3,6 |
DAD, баллы |
28,2±4,0 |
нансовая деятельность и переписка. Суммарный показатель, характеризующий качество повседневной активности больных, достоверно улучшился к моменту окончания терапии (через 16 нед) по сравнению с исходной оценкой.
Достоверно улучшились показатели, отражающие инициативу, планирование и организацию деятельности и успешность в выполнении различных видов бытовой активности деятельности (рис. 1).
Динамика выраженности психотических и поведенческих расстройств
До начала терапии поведенческие и психотические нарушения, оцениваемые по шкале NPI, распределялись в группе больных следующим образом: бредовые расстройства выявлялись у 68% больных (17 человек), галлюцинации — у 24% (6), агрессия и раздражительность — у 84% (21), депрессивные расстройства и тревога — у 64% (16), апатия — у 32% (8), расторможенность — у 36% (9), абберантное моторное поведение и расстройства сна — у 56% (14), расстройства аппетита — у 20% (5) (рис. 2). Заметим, что в большинстве случаев имело место сочетание 2 и более видов нарушений.
Бредовые идеи ущерба, столь характерные для больных старческого возраста, отмечались у 11 больных; 3 больных считали, что в доме живут незваные гости; 2 пациента были убеждены, что их лишили дома и поселили в чужой квартире; 1 больной высказывал бредовые идеи ревности. Галлюцинаторные расстройства были представлены только зрительными галлюцинациями.
Агрессия в поведении у большинства пациентов (17 человек) проявлялась в сопротивлении какой-либо помощи со стороны ухаживающих лиц, так, например, при попытках их переодеть или помыть; 8 пациентов с
Рис. 1. Динамика повседневного функционирования пациентов по шкале DАD (среднегрупповые показатели, баллы).
Светлые столбцы — до лечения; черные — после терапии. * — достоверные различия на уровне р<0,01.
Рис. 2. Распределение больных (в % к общему числу больных) с разными видами поведенческих и психотических нарушений к началу исследования.
1 — бредовые расстройства, 2 — галлюцинации, 3 — агрессия, 4 — депрессия, 5 — тревога, 6 — апатия, 7 — расторможенность, 8 — абберантное моторное поведение, 9 — раздражительность, 10 — расстройства сна, 11 — нарушение аппетита.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 5, 2010 |
35 |
ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
Таблица 2. Динамика когнитивного функционирования в процессе терапии (среднегрупповые показатели шкал MMSE и ADAS-cog)
Шкала |
|
Длительность терапии |
|
|
0-й день |
12 нед |
16 нед |
||
|
||||
MMSE, баллы |
14,0±0,6 |
15,8±0,6* |
16,4±0,7* |
|
ADAS-cog, баллы |
36,2±1,4 |
33,2±1,5* |
31,8±4,3* |
Примечание. * — Достоверные различия по сравнению с оценкой до начала терапии на уровне p<0,01.
Рис. 3. Динамика выраженности поведенческих и психотических расстройств по шкале NPI (улучшение среднегруппового показателя по сравнению с исходной оценкой).
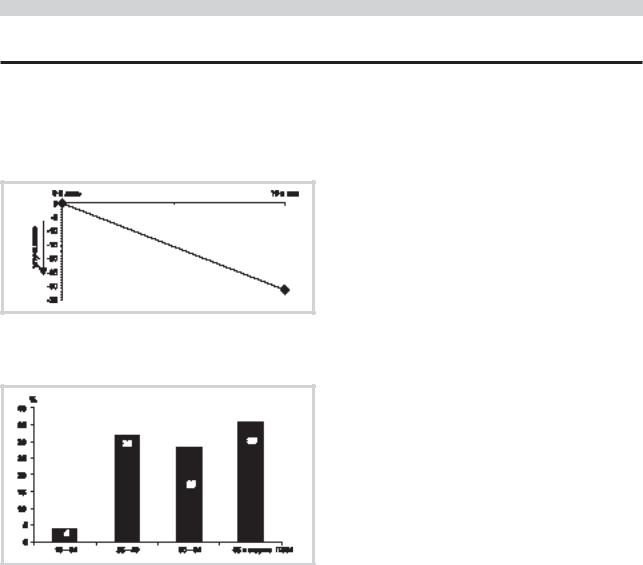
Рис. 4. Распределение ухаживающих за пациентами с БА лиц по возрасту (в % к общему числу ухаживающих).
агрессивным поведением проявляли вербальную агрессию — кричали или ругались на своих близких, у 4 больных агрессия проявлялась в бросании предметов, пинании ногами мебели и хлопании дверьми, и столько же пациентов пытались причинить боль или ударить своих близких.
У подавляющего большинства больных (15 человек) тревога проявлялась беспокойством по поводу предстоящих событий в чувстве напряжения и неуверенности, а у 3 пациентов тревожность появлялась, когда они оставались дома одни.
Раздражительность проявлялась в резких сменах настроения, эмоциональных срывах по незначительным поводам (13 человек). У 11 пациентов отмечались внезапные вспышки гнева, они были капризны и легковозбудимы, выказывали нетерпение, часто вступали в споры с окружающими, с ними было трудно договориться о чем-либо.
Большинство больных с абберантным моторным поведением (11 человек), бесцельно бродили по дому или шагали взад-вперед, при этом 3 пациентов рылись в ящиках, постоянно перебирали вещи в шкафах или теребили пуговицы, полы своей одежды, а 2 больных часто бесцельно надевали и снимали одежду.
К моменту окончания терапии (16-я неделя) установлено достоверное уменьшение выраженности психотических и поведенческих симптомов по суммарному показателю шкалы NPI (рис. 3).
Необходимо подчеркнуть, что к моменту выписки из стационара (12-я неделя) у всех больных удалось значительно снизить дозы психотропных препаратов: тиапридала в среднем с 300 до 100 мг в сутки, пропазина со 150 до 25 мг в сутки, сероквеля с 100 до 25 мг в сутки, а у 5 (20%) пациентов прием антипсихотических средств был полностью прекращен.
Нежелательные явления в период терапии ривастигмином отмечались у 20% больных. Наиболее часто наблюдалось ощущение тошноты в начале терапии или при повышении дозы ривастигмина. У 1 пациента такие явления отмечались на 10-й день лечения (доза 3 мг в сутки) и самостоятельно прошли через 1 день. У другого больного эти симптомы проявились на 14-й день терапии и сопровождались обострением желчнокаменной болезни, из-за чего пациент выбыл из исследования. У 1 пациента тошнота и рвота появились при переходе к дозе 6 мг в сутки (на 30-й день терапии) и продолжались 7 дней, затем пациент отказался от приема препарата.
У 1 больного на 21-й день терапии ривастигмином (доза 3 мг в сутки) в течение 5 дней наблюдалось урежение числа сердечных сокращений и появление болей в области сердца, в связи с чем пациент выбыл из исследования. Еще у 1 пациента при переходе к дозе 9 мг в сутки (60-й день терапии) появились боли в правом подреберье и эпигастральной области, у него было диагностировано обострение хронического панкреатита, вследствие чего исследование было прекращено.
Изменение нагрузки на лиц, ухаживающих за пациентами с деменцией в связи с терапией ривастигмином
Поскольку уход за больными, страдающими деменцией, сопровождается большой стрессовой и физической нагрузкой на ухаживающих лиц, важно было оценить, может ли применение ривастигмина у данной категории пациентов облегчить нагрузку, связанную с уходом за ними.
Уход за больными, включенными в настоящее исследование, осуществляли супруги пациентов (11 человек) и дети (14) в возрасте от 32 до 79 лет (средний — 55,7±2,8 года). Все лица, ухаживающие за больными, проживали совместно с ними, их возрастное распределение показано на рис. 4.
Среднегрупповой показатель временнóй нагрузки на лиц, ухаживающих за больными — времени, которое они тратили на уход и присмотр (по шкале RUD) до начала лечения составлял 12,4 ч в день (табл. 3). К моменту окончания терапии этот показатель сократился на 28,9%. При этом время, затрачиваемое собственно на уход и обслуживание больных, изменилось незначительно, а основная
36 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 5, 2010 |

ТЕРАПИЯ БОЛЕЗНИ АЛЬЦГЕЙМЕРА
Таблица 3. Время, затрачиваемое на уход за больными до начала терапии и к моменту ее окончания, ч
|
|
|
Уменьшение времени |
Время, затрачиваемое на разную деятельность |
До начала лечения |
Через 16 нед терапии |
по отношению к нача- |
|
|
|
лу лечения, % |
Уход |
|
|
|
прием пищи, одевание, туалет, личная гигиена, ку- |
2,2±0,1 |
2,1±0,6 |
4,5 |
пание и прогулки |
|
|
|
Обслуживание |
|
|
|
покупки, приготовление еды, уборка, стирка, по- |
2,2±0,1 |
2,0±0,6 |
9,0 |
ездки, прием лекарств |
|
|
|
Присмотр |
|
|
|
избегание опасных действий |
8,0±0,6 |
4,6±2,0 |
42,5 |
Всего |
12,4 |
8,7 |
29,8 |
Таблица 4. Распределение лиц, осуществляющих уход за больными с психопатологической симптоматикой (в % к общему числу ухаживающих)
Симптом |
До начала лечения |
Через 16 нед терапии |
|||
абс. |
% |
абс. |
% |
||
|
|||||
Депрессивные симптомы |
15 |
60 |
4* |
16 |
|
Тревога |
7 |
28 |
3 |
12 |
|
Слабость, утомляемость |
9 |
36 |
4 |
16 |
|
Раздражительность по отношению к больному |
6 |
24 |
1 |
4 |
|
Примечание. * — Достоверность различий по сравнению с оценкой до начала терапии на уровне p<0,01.
доля сокращения временных затрат пришлась на умень- |
(табл. 4). Сами ухаживающие лица отмечали, что помимо |
шение времени на присмотр за пациентами, что можно |
улучшения настроения они стали чувствовать себя более |
связать с нормализацией их поведения и редукцией пси- |
уверенными, появились вера в возможности терапии и |
хотической симптоматики. |
более позитивная оценка ситуации. |
Анализ динамики показателей шкалы NPI, оценива- |
В заключение можно констатировать, что примене- |
ющих стрессовую нагрузку на лиц, ухаживающих за паци- |
ние ривастигмина у пациентов с умеренно выраженной |
ентами, показал, что применение ривастигмина в сочета- |
БА, имеющих поведенческие и психотические расстрой- |
нии с антипсихотической терапией способствует досто- |
ства, улучшает не только когнитивное функционирование |
верному ее снижению. К моменту окончания терапевти- |
больных, но и положительно влияет на редукцию у них |
ческого курса нагрузка по уходу снизилась на 52,3% по |
психотической и поведенческой симптоматики. |
сравнению с исходным уровнем. |
Включение ривастигмина в комплексную терапию |
До начала лечения пациентов с БА практически у всех |
этой категории особенно трудных для ухода и лечения па- |
лиц, осуществляющих уход за больными, отмечались раз- |
циентов с БА приводит к существенному снижению доз |
личные психогенно обусловленные, ситуационные рас- |
психотропных препаратов, а у некоторых из них — и к |
стройства. Так, симптомы депрессии выявлялись у 60% |
полной их отмене. |
(15 человек), 36% (9) жаловались на повышенную сла- |
Важно подчеркнуть, что применение ривастигмина у |
бость и утомляемость, 28% (7) испытывали состояние тре- |
пациентов с умеренно выраженной БА и поведенческими |
воги, а 24% (6) — повышенную раздражительность по от- |
расстройствами приводит к существенному (до 30%) со- |
ношению к больному. Некоторые из ухаживающих лиц |
кращению времени, затрачиваемому ухаживающими ли- |
имели сочетание нескольких из указанных симптомов. По |
цами на уход и присмотр, а также к уменьшению уровня |
окончании 16 нед терапии психическое состояние ухажи- |
стрессовой нагрузки на них. В конечном итоге улучшение |
вающих лиц существенно улучшилось по всему спектру |
здоровья ухаживающих лиц положительно сказывается на |
расстройств, причем редукция депрессивных симптомов |
изменении качества жизни как самого больного, так и его |
оказалась статистически достоверной (χ2=10,27; р<0,01) |
семьи. |
ЛИТЕРАТУРА
1. |
Allan L., Hays H., Jensen N.H. et al. Randomised crossover trial of transder- |
4. |
Cummings J.L., Mega M., Gray K. et al. The Neuropsychiatric Inventory: |
|
mal fentanyl and sustained release oral morphine for treating chronic non- |
|
comprehensive assessment of psychopathology in dementia. Neurology |
|
cancer pain. BMJ 2001; 322: 1154—1158. |
|
1994; 44: 12: 2308—2314. |
2. |
Alzheimer’s Association. 2008 Alzheimer’s Disease Facts and Figures. Al- |
5. |
Donaldson C., Tarrier N., Burns A. Determinants of carer stress in Alzheim- |
|
zheimer’s Dementia 2008; 4: 2: 110—133. |
|
er’s disease. Int J Geriat Psychiat 1998; 13: 248—256. |
3. |
Croog S.H., Burleson J.A., Sudilovsky A., Baume R.M. Spouse caregivcrs of |
6. |
Folstein M.F., Folstein S.E., McHugh P.R. Mini-Mental State. A practical |
|
Alzheimer patients: problem responses to caregivcr burden. Aging Ment |
|
method of grading the cognitive state of patients for the clinician. J Psychiat |
|
Health 2006; 10: 87—100. |
|
Res 1975; 12: 189—198. |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 5, 2010 |
37 |

ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
7.Gelinas I., Gauthier L., McIntyre M. Development of a functional measure for persons with Alzheimer’s disease: the Disability Assessment for Dementia. Am J Occupational Ther 1999; 53: 471—481.
8.Mahoney R., Regan C., Katona C. Anxiety and depression in family caregivers of people with Alzheimer disease: the LASER-AD study. Am J Geriat Psychiat 2005; 13: 795—801.
9.McKhann G., Drachman D., Folstein M. et al. Clinical diagnosis of Alzheimer`s disease: report of the NINCDS-ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer`s disease. Neurology 1984; 146: 939—944.
10.Mohs R.C., Cohen L. Alzheimer’s Disease Assessment Scale (ADAS). Psychopharmacol Bull 1988; 24: 627—628.
11.Morris J.C. The Clinical dementia rating (CDR). Current version and scoring rules. Neurology 1993; 43: 2412—2413.
12.Sink K.M., Covinsky K.E., Barnes D.E. Caregiver characteristics are associated with neuropsychiatric symptoms of dementia. J Am Geriatr Soc 2006; 54: 796—803.
13.Slattum P.W., Johnson M.A. Caregiver burden in Alzheimer’s disease. Consult Pharm 2004; 19: 352—362.
14.Takechi H., Yamada H., Sugihara Y., Kita T. Behavioral and psychological symptoms, cognitive impairment and caregiver burden related to Alzheimer’s disease patients treated in an outpatient memory clinic [in Japanese]. Nippon Ronen Igakkai Zasshi 2006; 43: 207—216.
15.Travis S.S., Kao H.F., Acton G.J. Helping family members manage medication administration hassles. J Psychiat Ment Health Nurs 2005; 43: 13—15.
16.Valle-Jones C., O’Hara J., O’Hara H. Comparative clinical trial of the tolerability, patient acceptability and efficacy of two transdermal glyceryl trinitrate patches (‘Deponit’ 5 and ‘Transiderm Nitro’ 5) In patients with angina pectoris. Curr Med Res Opin 1989; 11: 331—339.
17.Wimo A., Nordberg G. Validity and reliability of assessments of time. Comparisons of direct observations and estimates of time by the use of the resource utilization in dementia (RUD)-instrument. Arch Gerontol Geriat 2007; 4: 1: 71—81.
38 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 5, 2010 |
