
Журнал неврологии и психиатрии / 2008 / NEV_2008_11_01
.pdf
ОБЩИЕ ВОПРОСЫ НЕВРОЛОГИИ И ПСИХИАТРИИ
Мегалэнцефалическая лейкоэнцефалопатия
с субкортикальными кистами (болезнь van der Knaap)
Р.Ц. БЕМБЕЕВА, С.В. СЕРКОВ, И.А. НАНКИНА, Э.Ю. ВОЛКОВА, Е.С. ШАХБАЗОВА, И.Н. ПРОНИН
Megalencephalic leukoencephalopathy with subcortical cysts (van der Knaap disease)
R.TS. BEMBEEVA, S.V. SERKOV, I.A. NANKINA, E.YU. VOLKOVA, E.S. SHAKHBAZOVA, I.N. PRONIN
Российский государственный медицинский университет; НИИ нейрохирургии РАМН им. акад. Н.Н. Бурденко; Российская детская клиническая больница, Москва
В статье приводятся обзор литературы, история открытия, гипотезы патогенеза, данные нейроморфологии, клинические проявления, дифференциальная диагностика и описание собственного единичного наблюдения редкой наследственно обусловленной лейкоэнцефалопатии у детей, сопровождающейся мегалэнцефалией, изменением строения миелина и субкортикальным кистообразованием. Подчеркивается приоритетная роль МРТ-диагностики болезни, выявляющей типичные признаки этого заболевания при неспецифичных клинических проявлениях и трудностях генетического анализа.
Ключевые слова: лейкоэнцефалопатия с мегалэнцефалией и кортикальными кистами, болезнь van der Knaap.
A history of the discovery, hypotheses of the pathogenesis, neuromorphologic data, clinical appearances, differential diagnostics and an own description of a single case of rare hereditary children leukoencephalopathy, with megalencephaly, changes of myelin structure and formation of subcortical cysts are presented. Taking into account non-specific clinical appearances of this disease and difficulties of genetic analysis, a priority role of MRI-diagnostics revealing typical signs of the disease is emphasized.
Key words: leukoencephalopathy with megalencephaly and subcortical cysts, van der Knaap disease.
Мегалэнцефалическую лейкоэнцефалопатию с субкортикальными кистами (Megalencephalic leukoencephalopathy with subcortical cysts, MLC) впервые описали M. Harboard и соавт. в 1990 г. [4] у двух родных братьев. Как самостоятельная нозологическая единица заболевание выделено через 5 лет голландским неврологом и нейрорадиологом M. van der Knaap и соавт. [5, 7] на основе наблюдаемых клинически 8 случаев, имеющих схожие проявления на МРТ. Та же автор впервые описала гистопатологическую картину новой болезни [8], в дальнейшем получившей ее имя. В последующие годы нозологическая самостоятельность MLC была подтверждена другими авторами. В настоящее время MLC широко освещена в зарубежной литературе, однако отечественные публикации, посвященные этому вопросу, отсутствуют.
MLC — редкое аутосомно-рецессивное заболевание с неуточненной частотой встречаемости в популяции. Наиболее часто заболевание выявляется среди жителей Турции и Индии, главным образом в арагвальской этнической группе. Ген, связанный с белком MLC — MLC1 (KIAA0027), локализован на 22-й хромосоме, в локусе 22qtel. В настоящее время опи-
© Коллектив авторов, 2008
Zh Nevrol Psikhiatr Im SS Korsakova 2008;108:11:4—9
сано более 20 вариантов мутаций гена MLC1 [5]. В арагвальской группе все пациенты гомозиготны по одной и той же мутации. Среди пациентов турецкой популяции были выявлены различные мутации гена, при этом приоритетная мутация не установлена. Мутация в гене MLC1 обнаруживается у 70% пациентов с MLC. В некоторых семьях мутации в гене MLC1 не выявлено, что не исключает наличие другого, неустановленного гена, связанного с MLC. Среди больных отмечается высокая частота (56,5%) близкородственных браков.
Патогенез заболевания изучен недостаточно. Известно, что протеин MLC отсутствует у беспозвоноч- ных и определяется у многих видов позвоночных, в организме которых имеется миелин, что косвенно указывает на его связь с функционированием миелиновой оболочки. В настоящее время существуют две основные гипотезы патогенеза болезни ван дер Кнаап [5].
Согласно одной из них, ген MLC1 кодирует мембранный протеин астроцитов с восемью трансмембранными доменами. Детальный анализ протеина MLC1 не обнаружил сходства его с другими белками или белковыми доменами. Известно, что большинство протеинов с восемью трансмембранными доменами выполняют в биологических организмах транспортную функцию. В организме человека MLC1 бе-
4 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 11, 2008 |

БОЛЕЗНЬ ВАН ДЕР КНААП
лок экспрессируется в клетках мозга и лейкоцитах. В головном мозге MLC1 экспрессируется на терминалях астроцитов в периваскулярном, субэпендимальном и субпиальном регионах. Терминали астроцитов являются частью гематоэнцефалического барьера (ГЭБ), сформированного из эндотелиальных клеток капиллярной стенки, базальной мембраны и терминали астроглиальной клетки. Роль астроцитов в формировании ГЭБ окончательно не определена. Они отделены от эндотелиальных клеток базальной мембраной и не вносят прямой физический вклад в формирование барьера. Периваскулярные астроглиальные терминали содержат множество других транспортных протеинов, включая переносчики монокарбоксилатов, глюкозы, глутамата и воды. Таким образом, соседствующее с ними расположение белка MLC1 в ЦНС предполагает его участие в транспортных функциях через ГЭБ. Учитывая наличие вакуолей в наружных слоях миелиновых волокон при MLC, особый интерес вызывает гипотеза о роли MLC и астроцитарных терминалей в водном обмене. В ткани мозга присутствуют различные идентифицированные белки водных каналов (аквапорины). Аквапорин-4 имеет сходную локализацию на терминале астроцита с MLC1. Известно, что аквапорин-4 связан с дистрофин-ас- социированным гликопротеиновым комплексом (DAGC), связывающим актиновый цитоскелет с экстрацеллюлярным матриксом. Интересно, что у больных некоторыми врожденными мышечными дистрофиями, обусловленными мутациями в отвечающих за DAGC генах, при МРТ также выявляются изменения белого вещества головного мозга. Морфологиче- ские и МРТ-изменения при мерозиновых врожденных мышечных дистрофиях, а также обусловленные мутацией MLC1 особенно близки: в обоих случаях наблюдается вакуолизация миелина.
Другая гипотеза основана на предположении, что белок MLC1 может участвовать в транспорте молекул, необходимых для обмена веществ в олигодендроцитах и формирования самого миелина. В этом слу- чае мутация в MLC1, нарушая транспорт необходимых субстратов, очевидно, приводит к изменению структуры миелиновых оболочек и снижению их плотности. Аргументом в пользу этого служит резкое увеличение прироста окружности головы пациента при MLC в период наиболее активной миелинизации, т.е. на 1-м году жизни, в то время как на 2-м году жизни темп роста головы замедляется и приходит в норму. Возможно, вакуоли в миелине возникают только в период его активного созревания. А. Schmitt и соавт. [5] показали, что экспрессия мРНК MLC1 достигает максимума в мозге мышей в период дифференциации астроцитов, который наблюдается на пике миелинизации. Возможно, это свидетельствует в пользу участия MLC1 в формировании миелина. Развитие неврологической симптоматики после созревания такого дефектного миелина может быть спровоцировано, например, легкой черепно-мозговой травмой или нейроинфекцией, как это неоднократно показано различными авторами при многих других наследственно обусловленных лейкоэнцефалопатиях [1, 2, 5].
При динамических контрольных МРТ-исследова- ниях пациентов с MLC отмечается уменьшение на-
бухания белого вещества и некоторое расширение субарахноидальных пространств и боковых желудоч- ков, что сопровождается клиническим ухудшением состояния больных, причина которого до сих пор не известна.
Морфологические изменения в белом веществе головного мозга у пациентов с MLC находят на ранней стадии заболевания, в то время как неврологический статус все еще в пределах или близок к возрастной норме. При исследовании вызванных потенциалов в этот период также не находят отклонений. Таким образом, в первые годы жизни, несмотря на выраженные морфологические изменения, белое вещество функционально все еще остается интактным. Нормальное функционирование нервной системы на доклинической стадии MLC связывают с локализацией вакуолей только в верхних слоях миелиновой оболочки [5].
Опубликовано единственное описание гистологической картины мозга при MLC у 13-летнего маль- чика [8]. При этом изменений коры мозга выявлено не было. В субкортикальном белом веществе наблюдался интенсивный фибриллярный астроглиоз. Отме- чался распространенный спонгиоз белого вещества больших полушарий с образованием вакуолей в наружных слоях миелиновых оболочек, имевших нормальную толщину. Миелинизированные аксоны были сохранны. Электронная микроскопия выявила расщепление миелиновых оболочек и подтвердила формирование внутримиелиновых вакуолей. Расщепление миелина отмечалось только в его наружных пластинках, вакуоли были покрыты одним или двумя миелиновыми слоями. Аксональная дегенерация, демиелинизация отсутствовали.
Клинические проявления MLC развиваются на 1-м году жизни. Макроцефалия отмечается с рождения или развивается в первые 12 мес, ее выраженность вариабельна и может достигать значительных размеров. После 1-го года жизни темпы прироста головы нормализуются и окружность головы находится на уровне 98 перцентилей. Раннее психомоторное развитие пациентов в большинстве случаев нормальное, у некоторых пациентов возможна умеренная задержка.
Кроме макроцефалии, один из ведущих клини- ческих симптомов в возрасте 1—1,5 года — двигательные нарушения: походка становится неустойчи- вой и ребенок часто падает. Через несколько лет наступает утрата двигательных навыков с развитием статической и динамической атаксии. Отмечается мышечная гипотония. Пирамидные симптомы присоединяются позже: повышаются сухожильные рефлексы, выявляются патологические стопные рефлексы
— симптом Бабинского, Пуссепа. У некоторых пациентов присутствуют экстрапирамидные симптомы
– дистония и атетоз. Эпилептические приступы выявляются рано и встречаются почти у всех больных. Их характер вариабелен, наиболее типичные — генерализованные тонико-клонические приступы и фотосенситивный миоклонус. Приступы носят устой- чивый характер и плохо поддаются противосудорожной терапии.
Постепенно исчезает навык самостоятельной ходьбы и к 10 годам или на 2-м десятилетии жизни паци-
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 11, 2008 |
5 |

ОБЩИЕ ВОПРОСЫ НЕВРОЛОГИИ И ПСИХИАТРИИ
енты полностью перестают ходить. Характерна диссоциация между ранними изменениями МРТ мозга и достаточно длительно сохранными высшими психи- ческими функциями. Умеренное снижение интеллекта возникает на поздних стадиях заболевания. Лишь у небольшого количества больных умственные способности снижаются с раннего возраста. Постепенно присоединяется нарушение речи, отмечается дизартрия
èвозможно развитие дисфагии.
Óчасти больных ухудшение состояния возникало после черепно-мозговой травмы средней степени тяжести, проявляясь эпилептическими пароксизмами с развитием эпилептического статуса, потерей сознания или острым нарушением двигательных функций с последующим постепенным восстановлением утраченных неврологических функций.
Течение заболевания вариабельно. У некоторых пациентов может быть тяжелым – больные самостоятельно ходят только в течение нескольких лет или никогда не приобретают навык самостоятельной ходьбы. Возможно более благоприятное течение. У таких больных в подростковом возрасте все еще сохраняется нормальное двигательное и интеллектуальное развитие, единственным признаком MLC является пограничная макроцефалия. Некоторые пациенты способны самостоятельно передвигаться и до 40-летнего возраста. Четкой корреляции между МРТ-изменения- ми и клиническими проявлениями болезни не существует, так как последние обусловливают нарастающие функциональные нарушения миелиновых оболочек без их макроповреждений и демиелинизации. Так как заболевание описано и выделено в самостоятельную нозологическую форму сравнительно недавно, информации о средней продолжительности жизни больных нет [3, 5].
Данные лабораторных и функциональных исследований
Лабораторные исследования биологических жидкостей не выявляют отклонений от нормы. Электронейромиограмма не изменена. Скорость распространения импульса по моторным и чувствительным нервам сохранена. Вызванные потенциалы на начальном этапе у большинства пациентов нормальные, при этом акустические вызванные потенциалы остаются в пределах нормы, но зрительные и соматосенсорные со временем ухудшаются — удлиняется латентный период и изменяется кортикальный ответ. Электроэнцефалограмма на начальном этапе заболевания нормальная. Впоследствии возникают изменения, в частности острые волны, спайки, комплексы спайк—вол- на различной локализации. У некоторых больных выявляется пароксизмальная активность в ответ на фотостимуляцию.
В настоящее время клинический диагноз основан преимущественно на данных МРТ головного мозга, которая выявляет патогномоничные признаки болезни, позволяя, как правило, поставить точный нозологический диагноз [9]. При MLC диффузно поражается как глубокое, так и субкортикальное белое вещество симметрично с двух сторон с увеличением его в объеме. Набухание белого вещества с облитерацией ликворных путей и сужением желудочков более
заметно в первые годы жизни. В более старшем возрасте у детей и подростков набухание белого вещества головного мозга менее выражено, лучше визуализируются ликворные пространства и расширяется желудочковая система, что связано с развитием умеренной атрофии на поздних стадиях заболевания. Кроме того, часто поражается наружная капсула, а также может частично вовлекаться заднее бедро внутренней капсулы. У некоторых пациентов отмечаются изменения в стволе мозга (варолиев мост, средний мозг), особенно в пирамидном тракте. У всех больных определяются двусторонние кистозные изменения белого вещества в передних отделах височных долей, что на фоне указанных выше изменений белого вещества составляет основу патогномоничной МР-картины заболевания. К настоящему времени передние височные кисты не были обнаружены только
óмладенцев и детей раннего детского возраста с MLC. Кисты часто встречаются также в лобных и теменных областях. Их размер и число с возрастом увеличиваются. У некоторых они становятся очень большими и имеют причудливую зигзагообразную форму, повторяя ход белого вещества в извилинах мозга. Во всех режимах сканирования МР-сигнал от кист по интенсивности такой же, как от свободного ликвора. У всех пациентов описано наличие полости прозрачной перегородки. Мозолистое тело, переднее и, частично, заднее бедро внутренней капсулы, перивентрикулярное белое вещество затылочных долей относительно интактны. Структура коры и базальных ядер не изменена.
Протонная МР-спектроскопия головного мозга
óдетей c MLC выявляет снижение всех метаболитов, уменьшение отношения N-ацетиласпартата/ креатина (Naa)/Cr при сохранных других пиках основных метаболитов было выявлено у взрослых пациентов с МLС, что соответственно отражает более легкое течение болезни. Снижение Naa и повышение миоинозитола соответственно отражает аксональное повреждение и глиоз.
Дифференциальный диагноз и лечение. Клинический дифференциальный диагноз MLC сложен из-за отсутствия патогномоничных клинических признаков болезни. Однако анамнез и клинические данные помогают исключить тяжелые формы метаболических энцефалопатий, так как MLC характеризуется легким течением. Современные принципы дифференциальной диагностики лейкоэнцефалопатий, в том числе и MLC, преимущественно основаны на данных МРтомографии.
Поражение белого вещества мозга с увеличением его в объеме по данным МРТ и нейроморфологиче- ских исследований выявлено лишь при немногих болезнях белого вещества: болезни Канавана (Canavan), болезни Александера, L2-гидроксиглутаровой ацидурии и врожденной мерозиновой мышечной дистрофии, что облегчает проведение дифференциального диагноза. При болезни Канавана на МРТ на фоне общих с MLC диффузных сигнальных изменений белого вещества больших полушарий определяется вовле- чение таламуса и бледного шара, что не обнаруживается при MLC. Больших кистозных полостей не образуется, а микрокавитация определяется только в глу-
6 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 11, 2008 |

боком белом веществе мозга. При L2-гидроксиглута- ровой ацидурии на МРТ выявляется грубая атрофия червя мозжечка, что не встречается при MLC. Болезнь Александера протекает с выраженным поражением лобных долей и колена мозолистого тела, либо могут встречаться более редкие паттерны с поражением ствола мозга. Для этой лейкодистрофии характерна воспалительная демиелинизация с повреждением ГЭБ и патологическим накоплением контрастного вещества в зонах демиелинизации по данным МРТ. Картина МРТ при мерозиновой мышечной дистрофии (ММД) тип MDC1A схожа с MLC. Субкортикальные кисты были найдены у 1 пациента с поздним дебютом мышечной дистрофии. У пациентов с ММД, как правило, изменения белого вещества головного мозга на МРТ возникают в грудном возрасте (после 6 мес жизни). Повреждение белого вещества, как и при MLS, происходит перивентрикулярно с двух сторон диффузно и симметрично. Аркообразные волокна и затылочная область вовлекаются в меньшей степени. Внутренняя капсула, мозолистое тело, базальные ганглии и мозжечок, как и при MLS, интактны. При ММД в отличие от MLS чаще встречаются структурные нарушения: кортикальная атрофия, гипоплазия червя мозжечка и ствола мозга, затылочная полимикрогирия/агирия.
Анализ на определение мутации гена MLC1 положителен у 60—70% пациентов с типичной картиной MLC при МРТ. В некоторых семьях мутация в локусе MLC1 отсутствует, что предполагает наличие другого гена или генов, связанных с белком MLC. Отсутствие положительного анализа на мутацию MLC1 может быть также связано с особенностями проведения стандартного анализа, который может пропустить гетерозиготные делеции, мутации в промоторе гена, в 3′- и 5′- нетранслируемых участках, мутации в интронах, которые влияют на аминокислотную структуру конечного продукта [2]. Пренатальная диагностика возможна в семьях с выявленной мутацией гена MLC1.
До настоящего времени все попытки лечения (применение диуретиков — ацетазоламида) были безуспешны [5].
Приводим собственное наблюдение MLC.
Пациент С., 8 лет, первый ребенок от близкородственного брака (родители двоюродные брат и сестра) поступил в клинику с жалобами на нарушение походки, пароксизмальные состояния с поворотом головы и глаз вправо с последующим выключением сознания и развитием тоникоклонических судорог.
Анамнез: ребенок от 1-й беременности, протекавшей с угрозой прерывания и токсикозом, первых срочных родов. Окружность головы при рождении 33 см. На 1-м году жизни отмечался интенсивный прирост окружности головы, который на 2-м году приостановился. В 1 год окружность головы составляла 54 см (+21 см за 1 год), в 2 года — 56,5 см. Раннее психомоторное развитие соответствовало возрастной норме. В возрасте 4 лет у ребенка в период экзантемной детской инфекции (ветряная оспа) впервые возник парциальный эпилептический приступ. Через 4 мес на фоне противосудорожной терапии отмечен повторный приступ. В возрасте 4 года 5 мес у ребенка появились тремор рук, шаткость при ходьбе. На КТ головного мозга было выявлено диффузное снижение плотности белого вещества больших полушарий (снимки не сохранились). В последующие несколько
БОЛЕЗНЬ ВАН ДЕР КНААП
месяцев двигательные нарушения нарастали: пациент с трудом поднимался по лестнице, не мог прыгать; при ходьбе стал спотыкаться, прихрамывать на правую ногу. Речь стала «замедленной, прерывистой». В 6 лет ребенок не мог самостоятельно подниматься по лестнице. С 6,5 лет отмечалось некоторое улучшение в состоянии ребенка: научился кататься на велосипеде; улучшилась речь. Ребенок посещал школу, учился по общеобразовательной программе. В 7 лет пациент получил закрытую черепно-мозговую травму, сотрясение головного мозга, после чего возникла слабость в нижних конечностях; появились гнусавость голоса, периодические поперхивания при еде, резко усилилась шаткость при ходьбе, ребенок стал ходить с поддержкой, отмечено ухудшение когнитивных функций. В связи с ухудшением и неясностью диагноза госпитализирован для расширенного обследования в психоневрологическое отделение Российской детской клинической больницы.
При внешнем осмотре обращает на себя внимание выраженная макрокрания (рис. 1)1. Окружность головы ребенка при измерении составила 60,5 см.
Неврологический статус. При исследовании функции черепных нервов: зрачки симметричны, фотореакция живая, содружественная; движения глазных яблок в полном объеме, горизонтальный установочный мелкоразмашистый нистагм. Носогубные складки симметричные. Девиация языка вправо. Глоточный и небный рефлексы снижены. Дизартрия. Аксиальные рефлексы положительные. Двигательная сфера: диффузная мышечная гипотрофия. Мышечная сила: в правых конечностях 3—3,5 балла, в левых конечностях 2,5—3 балла. Мышечный тонус — в правой руке гипотония, в левой руке и ногах гипертонус по пластическому типу. Поход-
Рис. 1. Пациент С., 8 лет, при госпитализации в Российскую детскую клиническую больницу.
Выраженная макроцефалия.
1 Фотография приведена с разрешения родителей пациента.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 11, 2008 |
7 |

ОБЩИЕ ВОПРОСЫ НЕВРОЛОГИИ И ПСИХИАТРИИ
ка спастико-атактическая. Рефлекторная сфера: cухожильные
èпериостальные рефлексы высокие с расширением рефлексогенных зон и клонусом стоп S>D. Положительные патологические стопные рефлексы. Брюшные рефлексы живые, быстро истощаются. Координаторная сфера: статодинамическая атаксия. Пяточно-коленную пробу не выполняет, пальценосовую — выполняет с грубой дисметрией и интенцией больше слева. Чувствительных нарушений не выявлено. Функции тазовых органов контролирует.
Высшие психические функции. Ребенок обследован по методике А.Р. Лурия с применением метода синдромного анализа: исследование предметного, буквенного, тактильного гнозиса. Также оценивалось понимание логико-грам- матических конструкций и доступность арифметических операций, сохранность зрительно-пространственных представлений (с помощью прогрессивных матриц Равена, а также самостоятельного рисунка и копирования). Состояние слухоречевой памяти оценивалось с помощью заучивания 2 групп по 3 слова. В процессе обследования были выявлены значительные нарушения тактильного и зрительнопространственного гнозиса, нарушения функций регуляции
èконтроля, что косвенно указывало на вовлечение в патологический процесс теменных и теменно-затылочных отделов правого полушария, префронтальных областей с двух сторон и мозолистого тела.
Показатели лабораторных общеклинических исследований в пределах нормы. Содержание N-ацетиласпартата в моче в норме.
Зрительные вызванные потенциалы не изменены. ЭЭГ — неустойчивый α-ритм в затылочных регионах,
в правой теменно-задневисочной области отмечаются единичные комплексы острая—медленная волна, в височных отделах регистрируются нерегулярные изолированные острые волны моноили дифазного характера, единичные низкоамплитудные комплексы пик—волна с попеременным преобладанием сторон, непостоянным преобладанием справа.
МРТ головного мозга. Исследование выполнено на МРсканере с индукцией магнитного поля 1,5 Тесла. На сериях аксиальных, сагиттальных и фронтальных МР-томограмм головного мозга в режимах Т1, Т2 и Т2-FLAIR (рис. 2 и 3 см. на цв. вклейке) на фоне увеличения в размерах головы выявляется симметричное двустороннее повышение МР-сиг- нала в режиме Т2, снижение в режиме Т1 от всего белого вещества (глубокого и субкортикального) больших полушарий с двух сторон при изоинтенсивном сигнале от него в режиме Т2-FLAIR при относительной сохранности темен- но-затылочных областей. Также имеет место вовлечение в патологический процесс дорсальных отделов внутренней капсулы. Сигнал от белого вещества мозжечка, ствола мозга, подкорковых ядер не изменен. В вентральных отделах левой лобной доли и обеих височных долей в измененном белом веществе определяются кистозные полости, имеющие низкий сигнал в режимах Т1 и FLAIR. Выявляется киста прозрачной перегородки. При введении контрастного вещества его патологического накопления выявлено не было. Диффузионно-взвешенная МРТ выявляет выраженное повышение измеряемого коэффициента диффузии в пораженном белом веществе с преимущественными изменениями в лобных долях (ИКД=2,5±0,54·10–3 ìì2/c) при менее выраженных изменениях в теменно-затылочных регионах (ИКД=1,8±0,35·10-3 ìì2/c (см. рис. 3). При проведении протонной одновоксельной МР-спектроскопии выявляется выраженное снижение отношения N-ацетиласпартата к креатину до Naa/Cr=0,95 и возрастание отношения миоинозитол/креатин (mI/Cr=0,95) (рис. 4 см. на цв. вклейке). Заклю- чение : МР-картина специфична для лейкодистрофии с мегалэнцефалией и кортикальными кистами (болезнь ван дер Кнаап). МРТ, проведенная младшей родной сестре пациента (2,5 года), не выявила у нее каких-либо патологических
изменений.
Обсуждение
В нашем наблюдении первые проявления заболевания у ребенка, рожденного в близкородственном браке, появились на 1-м году жизни в виде прогрессирующей макроцефалии. При этом не отмечалось клинических проявлений внутричерепной гипертензии, а раннее психомоторное развитие соответствовало возрастной норме. Прогрессирование макроцефалии остановилось на 2-м году жизни пациента, что типично для рассмотренного заболевания. Эпилепти- ческий синдром появился в клинической картине заболевания с 4 лет, при этом приступы были редкими и носили генерализованный характер. Диффузное снижение плотности белого вещества больших полушарий, выявленное в то время на КТ, могло натолкнуть врачей на мысль о наследственно обусловленной лейкоэнцефалопатии, однако данные КТ при этом виде патологии малоинформативны. Дальнейшее клиническое течение болезни было характерным для MLC и указывало на отсутствие признаков воспалительной демиелинизации (медленно прогрессирующим, а не волнообразным). Данные неврологического статуса (двигательные, чувствительные нарушения, изменения высших психических функций) неспецифично указывают на вовлечение в патологический процесс центральных проводниковых систем обоих полушарий. Клиническое ухудшение наступило в 7 лет после легкой черепно-мозговой травмы, вероятно, спровоцировавшей функциональные нарушения измененного миелина. Расширенная лабораторная диагностика не проводилась, но, согласно данным литературы, и не имела смысла, так как при MLC не выявлено каких-либо лабораторных маркеров болезни. При исследовании зрительных вызванных потенциалов патологических изменений не определялось, что характерно для ранних и средних стадий заболевания, однако на электроэнцефалограмме были определены признаки функциональной дезорганизации больших полушарий с преобладанием изменений в височных долях (вероятно, за счет кистообразования в этих зонах). Длительное отсутствие квалифицированной нейровизуализации не позволило поставить диагноз раньше, при этом именно с помощью высокопольной МРТ был установлен точный нозологиче- ский диагноз. На МРТ выявлено типичное для наследственно обусловленного дефекта миелина диффузное повышение сигнала в режиме Т2 от белого вещества больших полушарий с двух сторон при сохранности «серых» структур (коры и подкорковой области), визуально интактном в нашем наблюдении белом веществе ствола мозга и мозжечка. Были выявлены типичные для MLC субкортикальные кисты височных и лобных долей, киста прозрачной перегородки. На МРТ отсутствовали признаки демиелинизации и макродеструкции. МР-спектроскопия определяла снижение N-ацетиласпартата и повышение миоинозитола на единицу площади, что, вероятно, связано с диффузным астроглиозом и спонгиозом, выявляемым нейроморфологически при MLC. Результаты диффузионно-взвешенной МРТ указывают на разрежение клеточной структуры, возможно нарушение компактности миелина за счет увеличения со-
8 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 11, 2008 |

|
БОЛЕЗНЬ ВАН ДЕР КНААП |
держания воды между его спиралей, вакуолизации. К |
мо всегда рассматривать возможность наличия болез- |
сожалению, генетический анализ на MLC в нашем |
ни ван дер Кнаап. Главными диагностическими кри- |
случае не проводился (из-за отказа родителей паци- |
териями заболевания являются аутосомно-рецессив- |
ента), при этом у его родной сестры отсутствуют ка- |
ный тип наследования, макроцефалия, развивающая- |
кие-либо клинические и МРТ-проявления заболева- |
ся на 1-м году жизни; относительно медленные кли- |
ния в возрасте 2,5 года, что позволяет считать ее здо- |
ническая манифестация и течение заболевания, диф- |
ровой, так как известно, что макроцефалия и МРТ- |
фузная лейкоэнцефалопатия больших полушарий без |
проявления при MLC появляются уже на 1-м году |
вовлечения коры мозга и подкорковых образований, |
жизни. |
киста прозрачной перегородки, субкортикальные |
При проведении дифференциального диагноза |
кисты височных и лобных долей, отсутствие контра- |
мегалэнцефалии с лейкоэнцефалопатией необходи- |
стного усиления на МРТ. |
ЛИТЕРАТУРА
1.Белоусова Е.Д., Никанорова Н.Ю. Мегалэнцефалия и лейкодистрофия. В кн.: Наследственные нарушения нервно-психическо- го развития детей: Руководство для врачей. Под ред. П.А. Темина, Л.З. Казанцевой. М: Медицина 2001; 215—217.
2.Серков С.В., Пронин И.Н., Фадеева Л.М. и др. Нейрорентгенология в диагностике лейкодистрофий. Медицинская визуализация 2003; 2: 77—90.
3.Серков С.В., Корниенко В.Н., Пронин И.Н. Токсические и метаболические энцефалопатии. В кн.: Диагностическая нейрорентгенология. М: «Андреева Т.М.» 2006; 1051—1087.
4.Harbord M., Harden A., Harding B. et al. Megalencephaly with dysmyelination, spasticity, ataxia, seizures and distinctive neurophysiological findings in two siblings. J Neuropediatrics 1990; 21: 164— 168.
5.Schmitt A., Gofferje V., Weber M. et al. The brain-specific protein MLC1 implicated in megalencephalic leukoencephalopathy with
subcortical cyst (van der Knaap disease): molecular genetic study. Brain Dev 2003; 25: 362—366.
6.van der Knaap M., Barth P., Stroink H. et al. Leukoencephalopathy with swelling and a discrepantly mild clinical course in 8 children. Ann Neurology 1995; 37: 324—334.
7.van der Knaap M., Valk J., Barth P. et al. Leukoencephalopathy with swelling in children and adolescents: MRI patterns and differential diagnosis. J Neuroradiology 1995; 37: 679—686.
8.van der Knaap M., Barth P., Vrensen G. et al. Histopathology of an infantile-onset spongioform leukoencephalopathy with a discrepantly mild clinical course. Acta Neuropathology (Berlin) 1996; 92: 206— 212.
9.van der Knaap M.S., Valk J. Magnetic Resonance of Myelination and Myelin Disorders. Berlin: Springer Verlag 2005.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 11, 2008 |
9 |
К статье Р.Ц. Бембеевой и соавт. «Мегалэнцефалическая лейкоэнцефалопатия с субкортикальными кистами (болезнь van der Knaap)»
А |
Б |
В |
Г |
Д |
Е |
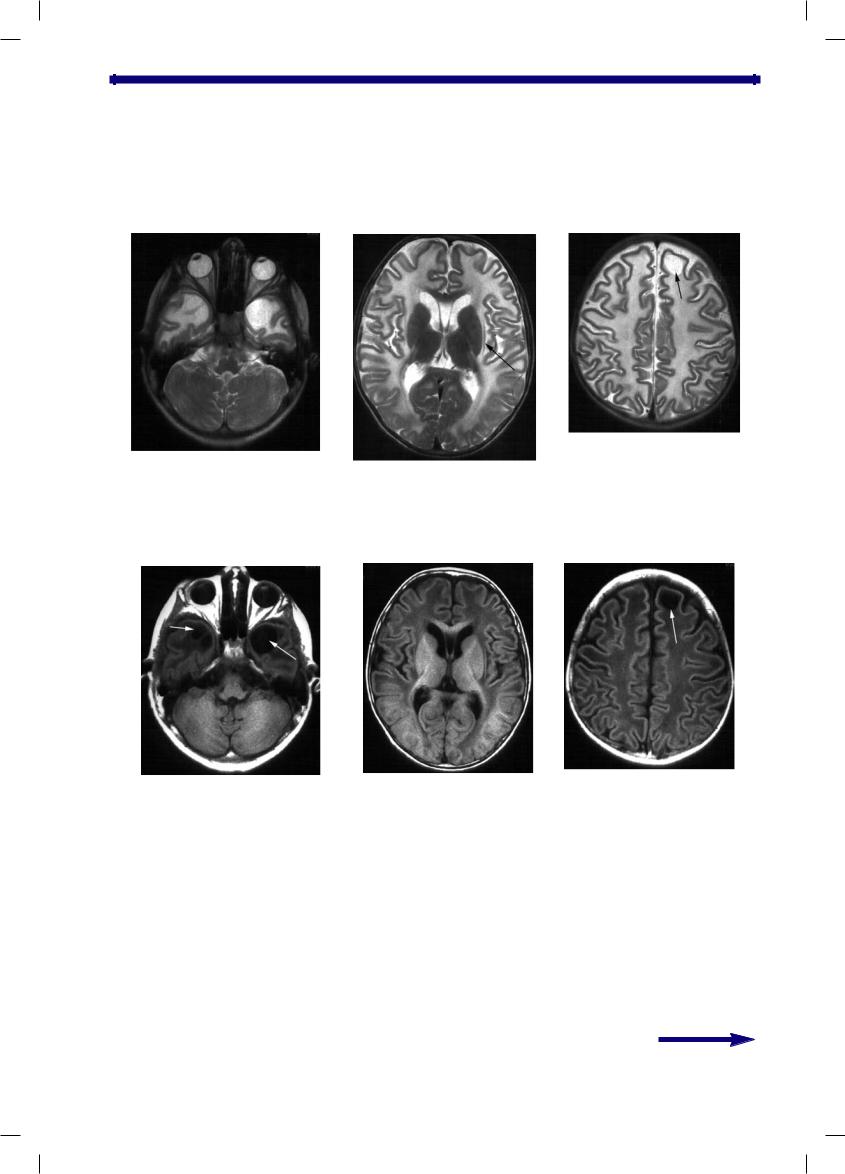
Рис. 2. МРТ головного мозга пациента с MLC в аксиальной проекции.
А, Б, В — режим Т2; Г, Д, Е — режим Т1. Объяснения в тексте. Стрелками указаны субкортикальные кисты в височных долях с двух сторон и вентральном полюсе левой лобной доли. На фоне пораженного белого вещества больших полушарий четко выделяются интактная кора мозга и подкорковые «серые» образования, в частности наружняя капсула (Б, стрелка).
1

К статье Р.Ц. Бембеевой и соавт. «Мегалэнцефалическая лейкоэнцефалопатия с субкортикальными кистами (болезнь van der Knaap)» (продолжение)
А |
Б |
Рис. 3. Результаты диффузионно-взвешенной МРТ.
А — диффузионно-взвешенное изображение на уровне боковых желудочков; Б — соответствующая ему карта измеряемого коэффициента диффузии. Желтым и красным цветом выделены области с патологически высокой диффузией, преобладающей в лобных долях с двух сторон.
Рис. 4. Одновоксельная протонная МР-спектрограмма с выбором зоны интереса в пораженном белом веществе одной из лобных долей.
Отмечается редукция отношения Naa/Cr и повышение mI/Cr.
2
