
Журнал неврологии и психиатрии / 2008 / NEV_2008_09_05
.pdf
ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
Система глутатиона крови при цереброваскулярных заболеваниях и коррекция нарушений ее функции α-липоевой кислотой
Л.С. КОЛЕСНИЧЕНКО, В.И. КУЛИНСКИЙ, В.В. ШПРАХ, В.В. БАРДЫМОВ, Н.В. ВЕРЛАН, Л.П. ГУБИНА, Г.А. ПЕНСИОНЕРОВА, М.П. СЕРГЕЕВА, Л.М. СТАНЕВИЧ, Г.Т. ФИЛИППОВА
The blood glutathione system in cerebral vascular diseases and its treatment with α-lipoic acid
L.S. KOLESNICHENKO, V.I. KULINSKY, V.V. SHPRAKH, V.V. BARDYMOV, N.V. VERLAN, L.P. GUBINA, G.A. PENSIONEROVA, M.P. SERGEEVA, L.M. STANEVICH, G.T. PHYLIPPOVA
Кафедры бионеорганической и биоорганической химии и биохимии Иркутского государственного медицинского университета, кафедры неврологии и нейрохирургии и клинической фармакологии Иркутского государственного института усовершенствования врачей
При дисциркуляторной энцефалопатии и легкой степени ишемического инсульта (ИИ) изменения обмена глутатиона редки. При ИИ средней и тяжелой степени выявлены частые и значительные сдвиги. Выражены и изменения при геморрагическом инсульте. Наиболее характерно увеличение активностей глутатионпероксидазы и глутатионтрансферазы. Увеличение активности ферментов отсутствовало при начале лечения после 3 суток и при тяжелой степени у больных, умерших в дальнейшем. Стандартная терапия уменьшала количество и/или выраженность изменений обмена глутатиона при средней и тяжелой степени ИИ, а при добавлении и α-липоевой кислоты (α- ЛК) при первой достигалась полная нормализация, при второй — нормализовалось большинство показателей. Увеличение функциональной активности системы глутатиона при раннем начале лечения больных ИИ и благоприятные изменения при лечении, особенно при добавлении α-ЛК, совпадали с улучшением неврологического статуса по шкале инсульта NIHSS. Подтверждено, что система глутатиона играет важную роль в толерантности к ишемии головного мозга.
Ключевые слова: система глутатиона, цереброваскулярные заболевания, коррекция инсульта, α-липоевая кислота.
The changes of glutathione metabolism are rare in dyscirculatory encephalopathy and ischemic stroke (IS) of mild severity. The frequent and considerable changes have been revealed in IS of moderate and high severity as well as in hemorrhagic stroke. An increase of activities of glutathione peroxidase and glutathione transferase is the most typical. The increase of enzyme activity was not observed at the beginning of treatment after 3 days and in patients with severe degree of disease who died later. A standard therapy decreased the quantity and/or expression of changes of the glutathione metabolism in patients with IS of moderate and high severity while the addition of α-lipoic acid (α-LA) led to the complete normalization in IS of moderate severity and normalization of most parameters in IS of high severity. The increase of functional activity of the glutathione system at the early stage of treatment of IS and the favorable changes during the treatment, in particular after the addition of α-LA, were correlated with the improvement of neurological status assessed with the NIHSS. It has been confirmed that the glutathione system plays an important role in the tolerance to brain ischemia.
Key words: glutathione system, cerebral vascular diseases, treatment of stroke, α-lipoic acid.
Глутатион и ферменты его обмена играют важную роль в толерантности головного мозга к ишемии [1, 15]. По данным литературы, предшественники восстановленного глутатиона (GSH) — его моноэтиловый эфир [10] и N-ацетил- цистеин [19] способны увеличивать концентрацию GSH в клетках, уменьшая размер инфаркта [10, 19] и улучшая исходы инсульта [19]. Получены также данные о значении GSH митохондрий для толерантности к ишемии мозга [24]. Одна-
© Коллектив авторов, 2008
Zh Nevrol Psikhiatr Im SS Korsakova 2008;108:9:36—40
ко истощение GSH не снижает, а увеличивает толерантность к глобальной ишемии (есть и другие отрицательные результаты [7]). Предварительная сверхэкспрессия глутатионпероксидазы (ГПО) защищает от инсульта и отека [17, 25] и ослабляет неврологический дефицит [25], а при нокауте ГПО объем инфаркта возрастает [14]. Однако лечение экзогенной ГПО оказалось неэффективным [26], а антиоксидант эбселен, частичный миметик ГПО, не влиял на ее активность и устранял защиту мозга ишемическим прекондиционированием [21]. Согласно клиническим наблюдениям, уже в первые часы после инсульта в крови увеличивается концентрация GSH и через 1 сутки — ГПО, при этом активность последней отрицательно коррелировала с оцен-
36 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 9, 2008 |

ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ α-ЛИПОЕВОЙ КИСЛОТЫ
кой по шкале инсульта NIHSS [27]. Было также отмечено, что у части детей с семейным инсультом активность ГПО плазмы значительно снижена [18]. В популяционном исследовании риск инфаркта мозга повышался при низкой концентрациии GSH в плазме [23]. Следует заметить, что авторы приведенных работ исследовали 1—2 показателя, что не позволяет оценить состояние системы глутатиона в целом.
Сильным прямым и вторичным антиоксидантом является α-липоевая кислота (α-ЛК), она увеличивает уровень GSH, восстановленных витаминов С и Е [13, 20], и поэтому названа «антиоксидантом антиоксидантов») [13]. α-ЛК защищает мозг грызунов при ишемии [13, 20] и улучшает состояние больных дисциркуляторной энцефалопатией [9] и инсультом [2, 8]. Однако связь этих изменений с системой глутатиона не изучалась.
Целью работы было исследование концентрации GSH и активности основных ферментов его метаболизма в плазме крови и эритроцитах больных с цереброваскулярными заболеваниями и изучение влияния α-ЛК на обмен глутатиона и ее терапевтического действия при этих формах патологии.
Больным проводили стандартную базисную и дифференцированную (вазоактивную, антиагрегантную и ноотропную) терапию. α-ЛК (берлитион фирмы «Бер- лин-Хеми») вводили капельно внутривенно по 600 мг/сут в течение 10 дней, затем еще 10 дней по 600 мг внутрь.
Состояние больных количественно оценивали по шкале инсульта Национального института здоровья США (NIHSS) [12]. GSH и ферменты его метаболизма ГПО, глутатионтрансферазу (ГТ) и глутатионредуктазу (ГР) определяли стандартными спектрофотометрическими методами [5].
Компоненты системы глутатиона сравнивали по дисперсиям (критерий F) и средним (критерий t Стьюдента). Так как данные по шкале NIHSS отлича- лись от нормального распределения (по тесту Шапи- ро—Уилкса р=0,023), статистический анализ проводили по непараметрическим методам: по критерию Уилкоксона для разностей пар и критерию U Ман- на—Уитни [4]. Описаны только значимые сдвиги (p<0,05).
Материал и методы
Проведено пилотное обследование 135 человек, из них 25 с дисциркуляторной энцефалопатией (ДЭ), 12 — с геморрагическим инсультом (ГИ), 75 — с ишемическим инсультом (ИИ). 23 человека без признаков цереброваскулярных заболеваний составили контрольную группу. Средний возраст больных был 64,9 года, в контроле — 53,4 года; женщин было 57%, мужчин — 43%.
Диагностика цереброваскулярных заболеваний основывалась на клинико-лабораторном и функциональном обследовании с использованием ультразвуковой допплерографии, дуплексного сканирования, эхокардиограммы, компьютерной и магниторезонансной томографии.
Результаты и обсуждение
При ДЭ выявлено выраженное увеличение активности ГТ в эритроцитах и плазме без изменения других показателей (табл. 1). В отличие от этого при ИИ в эритроцитах и плазме резко или выраженно возрастала активность ГПО, в эритроцитах — ГТ, в плазме
— активность ГР и концентрация GSH. При ГИ в плазме увеличивалась активность ГР и особенно ГПО (см. рисунок); меньшая частота значимых изменений может быть связана с малым размером группы. Обращает внимание, что качественно идентичные сдвиги наблюдались только при обоих типах инсульта — ГПО и ГР плазмы, при ДЭ и ИИ — ГТ эритроцитов, но совпадений при всех трех формах цереброваскулярных заболеваний не было. Это свидетельствует о свое-
Таблица 1. Система глутатиона при цереброваскулярных заболеваниях и в контроле
|
n |
GSH |
ÃÏÎ |
ÃÒ |
ÃÐ |
|
|
|
|
|
|
|
|
Эритроциты |
|
|
|
Kонтроль |
23 |
2,27±0,20 |
27,4±3,52 |
4,44±0,44 |
2,76±0,30 |
Больные |
|
|
|
|
|
c ÄÝ |
25 |
2,32±0,08 |
34,8±5,09 |
7,83±0,69 |
2,58±0,32 |
c ÈÈ |
75 |
2,64±0,14 |
38,9±3,09 |
6,04±0,42 |
2,70±0,18 |
c ÃÈ |
12 |
2,80±0,35 |
27,7±6,12 |
4,98±0,84 |
4,64±1,05 |
|
|
Плазма крови |
|
|
|
Kонтроль |
23 |
21,7±3,20 |
2,64±0,33 |
1,02±0,11 |
0,38±0,03 |
Больные |
|
|
|
|
|
ñ ÄÝ |
25 |
24,6±3,20 |
2,30±0,017 |
2,29±0,29 |
0,36±0,024 |
c ÈÈ |
75 |
30,9±2,75 |
6,94±0,94 |
1,28±0,12 |
0,49±0,03 |
c ÃÈ |
12 |
29,0±2,78 |
11,3±3,03 |
2,54±0,80 |
0,75±0,16 |
|
|
|
|
|
|
Примечание. Концентрация GSH в эритроцитах — в мкмоль/г, в плазме — в нмоль/г; активность ферментов — в нмоль/мин на 1 мг белка. Данные проанализированы по параметрическим критериям F и t Стьюдента.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 9, 2008 |
37 |
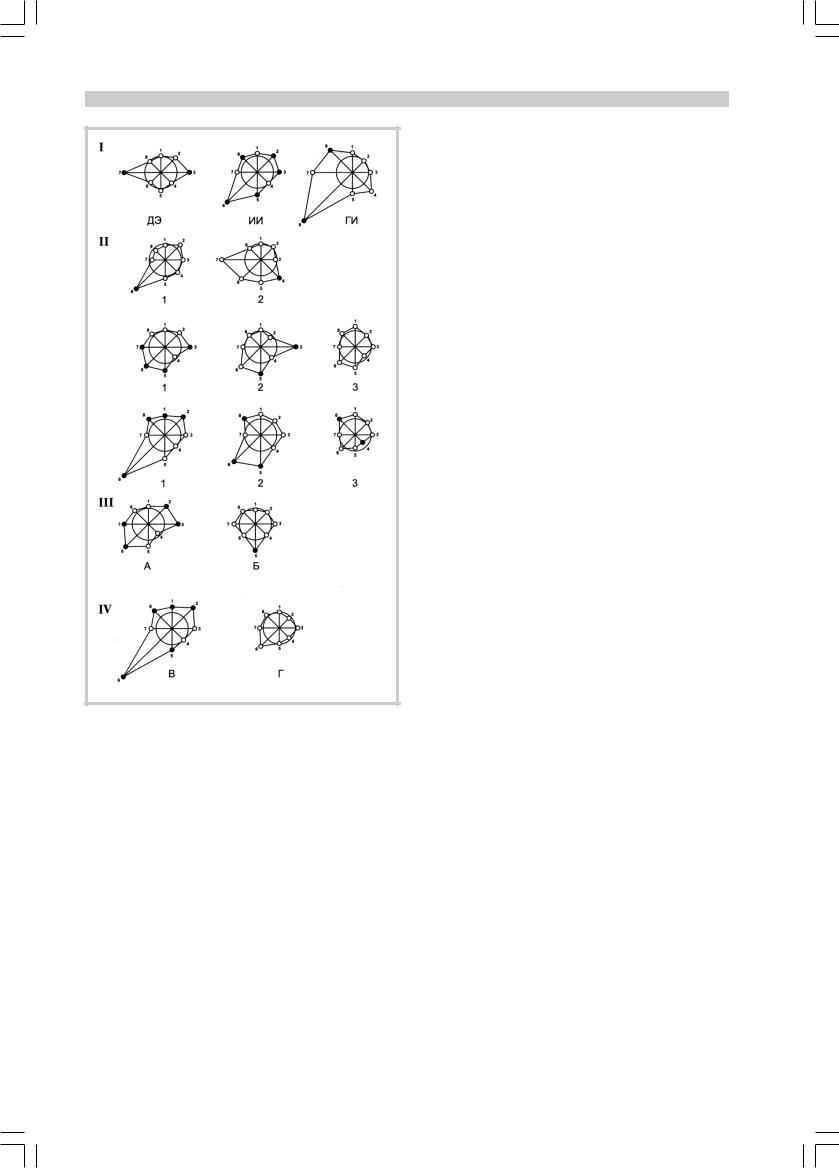
ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
Система глутатиона при цереброваскулярных заболеваниях.
I Общие обозначения: ДЭ — дисциркуляторная энцефалопатия, ИИ
— ишемический инсульт, ГИ — геморрагический инсульт.
На всех фрагментах значения показателей в контроле приняты за 100% и изображены в виде радиуса окружности. Изменения у больных (выражены в процентах к контролю) нарушают симметрич- ность диаграммы: увеличения показателей изображаются в виде «лу- чей», выступающих за пределы окружности, снижение показателей
— в виде впадин. Черные кружки — р<0,05, светлые — р>0,05; цифры по окружности: 1,5 GSH, 2,6 — глутатионпероксидаза (ГПО), 3,7 — глутатионтрансфераза (ГТ), 4,8 — глутатионредуктаза (ГР); 1—4 — в эритроцитах, 5—8 — в плазме крови.
II Сдвиги в системе глутатиона при ИИ разной степени тяжести и их коррекция. Вверху — легкая степень, посередине — средняя степень, внизу — тяжелая степень; 1 — до лечения, 2 — после стандартной терапии, 3 — то же с добавлением α-липоевой кислоты.
III Система глутатиона при ИИ средней степени А — госпитализация и начало лечения в первые 3 сут (n=19), Б — госпитализация и начало лечения после 3 сут (n=13).
IV Система глутатиона при ИИ тяжелой степени (при поступлении в больницу). В — выжившие пациенты (n=24), Г — пациенты (n=10), умершие через 2—25 сут после исследования крови (медиана — 9 сут).
образии реакций системы глутатиона на различные типы цереброваскулярных заболеваний.
Наиболее широко исследовали больных ИИ (см. рисунок, фрагмент II). При легкой степени тяжести
ÈÈнаблюдалось лишь значительное увеличение активности ГПО в плазме. Для средней степени тяжести ИИ было характерно увеличение в плазме и эритроцитах активности ГТ, только в плазме — концентрации GSH и активности ГПО. При тяжелой степени ИИ как в плазме, так и в эритроцитах возрастала активность ГПО, в плазме — активность ГР, в эритроцитах — концентрация GSH. В целом в этих двух группах из исследованных нами восьми биохимиче- ских показателей значимо (в большинстве случаев — в 1,5—2 раза) увеличивалась половина. Следовательно, сдвиги в обмене глутатиона были распространенными и выраженными. У пациентов средней степени
ÈÈпри поступлении в больницу и начале лечения до 3 сут активности ГПО и ГТ в плазме и эритроцитах были закономерно увеличены, а при более поздней госпитализации этого не наблюдалось, и единственным изменением было увеличение GSH в плазме крови (см. рисунок, фрагмен III). При ИИ тяжелой степени у выживших больных в эритроцитах и особенно плазме происходило накопление GSH и резкое увеличение активности ГПО, повышение активности ГР в плазме. У умерших больных ИИ (через 2— 25 сут после исследования крови, медиана — 9 суток) все эти изменения отсутствовали (см. рисунок, фрагмент IV). He исключено, что это различие можно будет использовать как прогностический тест. Наши данные согласуются с сообщением [11], что активация ГР при хорошем прогнозе выражена больше, чем при плохом (другие реакции системы глутатиона авторы не изучали).
Обращает внимание, что независимо от остроты и тяжести цереброваскулярного заболевания сдвиги всегда заключались в возрастании показателей — увеличении активности ферментов и концентрации GSH. Это означает, что система глутатиона закономерно переходила на более высокий уровень функционирования. При инсульте источником глутатиона и ферментов его метаболизма в плазме могут быть поврежденные нейроны и/или глия. Это связано с тем, что инсульт значительно увеличивает проницаемость гемато-энцефалического барьера [3]. Вероятно, это объясняет большую (7 из 11) часть изменений в плазме.
Наиболее часто увеличивались активности ГПО и ГТ. В литературе данных по ГТ при инсульте мы не обнаружили, но она также является важным антиоксидантным ферментом, который обезвреживает многие окисленные метаболиты путем как восстановления, так и конъюгации и, кроме того, восстанавливает окисленные нуклеотиды в ДНК [6, 16] — это четвертая линия защиты от пероксидации [6]. Активация вспомогательного фермента ГР наблюдалась намного реже, чем ГПО и ГТ, так как его активность как в клетках, так и в плазме намного меньше (см. табл. 1). Обращает внимание, что высокая активность в плазме и эритроцитах ферментов метаболизма глутатиона — ГПО и ГТ — не приводит к снижению его концентрации, а иногда GSH даже накапливается, что может быть связано с увеличенным синтезом GSH в клетках, включая эритроциты, а для плазмы — более легким по сравнению с белками выходом в кровоток глутатиона из поврежденных клеток.
38 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 9, 2008 |

ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ α-ЛИПОЕВОЙ КИСЛОТЫ
Таблица 2. Степень тяжести клинического состояния обследованных c ИИ в зависимости от начала и вида лечения
|
|
|
Возраст, |
Медианы баллов NIHSS |
Снижение, |
|
||
Группы |
Лечение |
n |
|
|
p |
|||
äî |
после |
|||||||
ãîäû |
% |
|||||||
|
|
|
|
|||||
|
|
|
|
лечения |
лечения |
|
|
|
|
|
|
|
|
|
|
|
|
Kонтроль |
— |
23 |
53,4 |
— |
— |
— |
— |
|
Больные |
|
|
|
|
|
|
|
|
средняя степень тяжести |
Начало в первые |
19 |
63,4 |
9,0 (6—11) |
3,0 (2—6) |
67 |
<0,001 |
|
состояния |
3 äíÿ |
|
|
|
|
|
|
|
|
Начало после |
9 |
64,2 |
7,0 (6—10) |
7,0 (3—7) |
0 |
1,0 |
|
|
3 äíåé |
|
|
|
|
|
|
|
средняя степень тяжести |
Стандартное |
13 |
63,7 |
8,0 (7—10) |
5,0 (3—7) |
38 |
<0,001 |
|
состояния |
|
|
|
|
|
|
|
|
|
Òî æå + α-ËK |
13 |
63,3 |
9,0 (6—11) |
3,0 (2—5) |
67 |
<0,001 |
|
тяжелое состояние |
Стандартное |
8 |
69,5 |
16,5 (12—20) |
12,5 (6—15) |
24 |
<0,001 |
|
|
Òî æå + α-ËK |
12 |
68,4 |
14,5 (12—21) |
7,5 (5—10) |
48 |
<0,001 |
|
|
|
|
|
|
|
|
|
|
Примечание. В скобках верхние и нижние квартили. Данные проанализированы по критерию Уилкоксона для разностей пар.
С патобиохимических позиций увеличенное функционирование системы глутатиона противостоит оксидативному стрессу, играющему важную роль в развитии инсульта [3]. Наиболее частый биохимический сдвиг — увеличение активности основных антиоксидантных ферментов ГПО и ГТ — защищает от активных форм О2 и продуктов пероксидации, позволяет в определенной степени восстановить равновесие и улучшить редокс-регуляцию. В пользу такой интерпретации свидетельствуют наши данные об активации при ИИ средней степени ГПО и ГТ в эритроцитах и плазме при относительно ранней, но не поздней госпитализации. Хорошо известно, что при первой состояние и прогноз больных намного лучше благодаря более раннему началу лечения. При тяжелой степени ИИ также можно интерпретировать зна- чительную активацию ряда показателей у выживших и полную ареактивность у умерших пациентов. Вероятно, без защитных реакций системы глутатиона выживание при тяжелом инсульте невозможно. В этом плане самый резкий сдвиг в обмене глутатиона при ИИ — увеличение в плазме в 4,2 раза активности ГПО у тяжелых, но выживших больных может рассматриваться как максимальная защитная реакция. При ИИ средней степени этот показатель увеличивался только в 1,6 раза.
Стандартная терапия ИИ средней степени вернула к уровню контроля два из четырех измененных показателей — активность ГПО и ГТ плазмы (см. рисунок). Добавление к лечению курсового введения α-ЛК нормализовало все показатели. При тяжелой степени ИИ стандартное лечение также повлияло на концентрацию GSH и активность ГПО в эритроцитах и снизило активность ГПО в плазме, увеличило GSH в плазме. Добавление к лечению α-ЛК дополнительно нормализовало еще GSH и ГПО плазмы и снизило активность ГР в эритроцитах. Следователь-
но, и при тяжелом течении заболевания произошли положительные сдвиги, особенно при добавлении α-ЛК, при котором нормализовалось четыре увели- ченных показателей из пяти. Этому мог способствовать новый эффект α-ЛК — стабилизация гематоэнцефалического барьера [22]. Обнаружение при инсульте влияния α-ЛК на активность ферментов метаболизма глутатиона представляет большой интерес. Под- черкнем принципиальное различие значения активности антиоксидантных ферментов в остром периоде и при улучшении состояния: 1) защита от опасного оксидативного стресса (полезная реакция — активация ферментов), 2) результат восстановления баланса оксидантов и антиоксидантов (полезная реакция
— нормализация). Если α-ЛК прямо ингибирует оксидативный стресс, то дальнейшая активация системы глутатиона становится нецелесообразной.
Состояние больных и клиническая эффективность проведенного лечения оценивали по шкале NIHSS, по которой чем выше балл, тем больше степень тяжести состояния больного [12]. При более раннем (до 3 сут) начале лечения средней степени тяжести ИИ медиана баллов NIHSS уменьшилась на 67% (р=0,032), при позднем — изменения отсутствовали (табл. 2). При ИИ средней степени курс стандартной терапии снижал медиану баллов на 38%, такое же лечение с добавлением α-ЛК — на 67%; при тяжелой степени — соответственно на 24 и 48%. Следовательно, все четыре варианта лечения влияли положительно и высокозначимо. Так как тяжесть ИИ значимо не влияла на соотношение лечебных эффектов (р>0,22—0,36), для каждого из двух вариантов терапии мы объединили группы со средней и тяжелой степенью. Это привело к увеличению коли- чества пациентов в группах и в результате к статистической значимости различий между двумя видами терапии: при использовании одностороннего кри-
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 9, 2008 |
39 |

ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
терия U дополнительное лечебное действие α-ЛК |
совпадают с более низкими баллами по шкале NIHSS. |
доказано — медиана увеличилась с 30 до 55% |
Это свидетельствует в пользу значения системы глу- |
(р=0,030). Следовательно, как улучшение состояния |
татиона для толерантности к инсульту. |
системы глутатиона при лечении с добавлением |
Лечебное применение α-ЛК при инсульте заслу- |
α-ЛК, так и увеличенная активность ГПО и ГТ в эрит- |
живает проверки в контролируемых рандомизирован- |
роцитах и плазме при более раннем начале лечения |
ных клинических испытаниях. |
ЛИТЕРАТУРА
1.Болдырев А.А. Окислительный стресс и мозг. Сорос 2001; 7: 4: 16. Hayes J.D., Flanagan J.U., Jowsey I.R. Glutathione transferase. Ann
21—28.
2.Гехт А.Б., Белоусов Ю.Б., Павлов Н.А. и др. Фармакоэкономиче- ское исследование применения метаболически активных препаратов в восстановительном лечении ишемического инсульта. Труды конгресса «Человек и лекарство». М 2005; 347.
3.Гусев Е.И., Скворцова В.И. Ишемия головного мозга. М 2001; 328.
4.Закс Л. Статистическое оценивание. М 1976; 598.
5.Колесниченко Л.С., Кулинский В.И., Сотникова Г.В., Ковтун В.Ю.
Влияние направленного изменения концентрации глутатиона на температуру тела и толерантность к ишемии головного мозга. Биохимия 2003; 68: 5: 656—663.
6.Кулинский В.И., Колесниченко Л.С. Структура, свойства, биологическая роль и регуляция глутатионпероксидазы. Успехи соврем биол 1993; 113: 1: 107—123.
7.Кулинский В.И., Колесниченко Л.С., Ковтун В.Ю., Сотникова Г.В.
Взаимосвязь толерантности к ишемии головного мозга и температуры тела с концентрацией глутатиона. Биомед химия 2003;
49:5: 424—433.
8.Холопова Е.А. Берлитион в коррекции оксидантного стресса при неврологических заболеваниях. Атмосфера. Нервные болезни 2003; 3: 1—3.
9.Чуканова Е.И., Соколова Н.А. Эффективность тиоктацида при лечении больных дисциркуляторной энцефалопатией. Журн неврол и психиат 2001; 101: 11: 31—34.
10.Anderson M.F., Nilsson M., Eriksson P.S., Sims N.R. Glutathione monoethyl ester provides neuroprotection in a rat model of stroke. Neurosci Lett 2004; 354: 2: 163—165.
11.Aydin M., Gencer M., Cetinkaya Y. et al. PON1 55/192 polymorphism, oxidative stress, prognosis and severity of stroke. IUBMB life 2006; 58: 3: 165—172.
12.Biller J., Love B.B., Marsh E.E. et al. Spontaneous improvement after acute ischemic stroke. A pilot study. Stroke 1990; 21: 7: 1008—1012.
13.Bilska A., Wlodek L. Lipoic acid — the drug of future? Pharmacol Repots 2005; 57: 5: 570—577.
Rev Pharmacol Toxicol 2005; 45: 51—88.
17.Hoehn Â., Yenari N.A., Sapolsky R.M., Steinberg G.K. Glutathione peroxidase overexpression inhibits cytochrome Ñ release and proapoptotic mediators to protect neurons from experimental stroke. Stroke 2003; 34: 10: 2489—2494.
18.Kenet G., Freedman J., Shenkman B. et al. Plasma glutathione peroxidase deficiency and platelet insensitivity to nitric oxide in children with familial stroke. Arteroscler Thromb Vasc Biol 1999; 19: 8: 2017— 2023.
19.Khan M., Sekhon Â., Jatana M. et al. Administration of N-acetyl- cystein after focal cerebral ischemia protects brain and reduced inflammation in a rat model of experimental stroke. J Neurosci Res 2004; 76: 4: 519—527.
20.Packer L., Tritschler H.J., Wessel K. Neuroprotection by the metabolic antioxidant alpha-lipoic acid.Free Radic Biol Med 1997; 22: 1—
2:359—378.
21.Puisieux F., Deplanque D., Bulckaen H. et al. Brain ischemic preconditioning is abolished by antioxidant drugs but not upregulate superoxide dismutase and glutathione peroxidase. Brain Res 2004; 1027: 1—2: 30—37.
22.Schreibelt G., Musters R.J., Reijerkerk A. et al. Lipoic acid affects migration into central nervous system and stabilized blood-brain barrier integrity. J Immunol 2006; 177: 4: 2630—2637.
23.Shimizu H.,Kiyohara Y.,Kato I. et al. Relationship between plasma glutathione levels and cardiovascular disease in defined population: the Hisayama study. Stroke 2004; 35: 9: 2072—2077.
24.Sims N.R., Nilsson M., Muyderman H. Mitochondrial glutathione: a modulator of brain cell death. J Bioenerg Biomembr 2004; 36: 4: 329—333.
25.Weisbrot-Lefkowitz M., Reuhl K., Perry B. et al. Overexpression of human glutathione peroxidase protects transgenic mice against focal cerebral ischemia/reperfusion damage. Brain Res Mol Brain Res 1998; 53: 1—2: 333—338.
26.Yano Ò., Ushijima K., Terasaki H. Failure of glutathione peroxidase to reduce transient ischemic injury in the rat hippocampal subfield. Resuscitation 1998; 39: 1—2: 91—98.
14.Crack P.G., Taylor J.M., Ali U. et al. Potential contribution of NF27. Zimmermann C., Winnefeld K., Streck S. et al. Antioxidant status in
kappaB in neuronal cell death in the glutathione peroxidase-1 knockout mouse in response to ischemia-reperfusion injury. Stroke 2006;
37:6: 1533—1538.
15.Dringen R. Metabolism and function of glutathione in brain. Progress in Neurobiol 2000; 62: 649—671.
acute stroke patients and patients at stroke risk. Eur Neurol 2004; 51: 3: 157—161.
40 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 9, 2008 |
