
01.Лечебное дело / Биоорганическая химия / 06.Дополнительно / Всякое / Органическая химия
.pdf
Тема 2. Изомерия органических соединений
Контрольные вопросы
1.Что понимают под структурной изомерией?
2.Что понимают под пространственной изомерией (стереоизомерией)?
3.В чём отличие конформационной изомерии от конфигурационной?
4.Проведите классификацию следующих видов изомерии; изомерия углеродного скелета, оптическая изомерия, изомерия положения кратной связи, изомерия положения функциональной группы, цис-, транс- изомерия, конформации шестичленных циклов, кольчато-цепная изомерия, конформационная изомерия алканов и их замещённых, кето-енольная таутомерия. Приведите примеры названных видов изомерии.
5.Сколько видов изомерии возможно для бутенола, гидроксибутановой кислоты?
Задачи
1. Напишите структурные формулы: а) пяти изомерных гексанов; б) девяти изомерных гептанов; в) восьми изомерных монохлорпентанов; г) девяти изомерных дибромбутанов. Назовите соединения по номенклатуре IUPAC.
2. Сформулируйте правила R,S-номенклатуры для обозначения конфигурации энантиомеров. Расположите заместители в порядке уменьшения их старшинства: а) -H, -D, -CH3, -NO2, -Cl, -OH; б) -CH2OH, -C2H5, -CH3, н-C3H7, -CH2Br, изо-C3H7; в) -CHO, -COOH, -CH2OH, -SH, -SO3H; г) -C≡CH, -CH=CH2, -CH2CH3, -CH2CH2Br, -CH2CH2OH, -CH2CH2OCH3; д) -NO2, -NH2, -CH2OH, -CH3, -COOH, -NHCH3; е) -CH3, -CH2CH2CH3, -CH(CH3)2, -CH2CH2SH, -CH2CH2OCH3, -CH2-CH3; ж) -NH2, -N(CH3)2, -CH2NH2, -NHCH3, -NO2, -ONO; з) -CHO, -C(O)CH3, -C(O)NH2, -C(O)Cl, -C(O)SCH3, -COOH; и) -NO2, -NHCH2CH3, -NHCl, -ONO, -NH-CHO, -NH-NH2; к) -OH, -OCH3, -OOH, -OOCH3, -I, -OI; л) -NH2, -N≡N, -NH-NH2, -NH-NHCH3, -NO2, м) -C≡N, -CH2NH2, -CH2N(CH3)2, -CH=NH, -CH2NHCH(CH3)2, -CH=NCH3.
3. Укажите число и характер возможных стереоизомеров, отвечающих следующим формулам:
а) СН3-СН2-СН(ОН)-СHCl-CH3; б) (CH3)2CH-CH2-CH(CH3)-COOH;
в) С6H5-CHBr-CH2-CH2-CH(OH)-CH2COOH; г) CH2(OH)-CH(OH)-CH(OH)-CH(OH)-CHO;
д) (СH3)2CH-CH(NH2)-CH2-CH(CH3)2; е) CH3-CH2-CH(SH)-CH(CH3)2;
ж) CH2=CH-CH2-CH(OH)-COOH;
20
з) CH3-CHCl-CHBr-CH3;
и) C6H5-CH(OH)-CH(OH)-C(O)-C6H5; к) CH3-CH(NH2)-C(O)OCH3;
л) CH3-S-CH2-CH2-CH(NH2)-COOH; м) HOOC-CH(OH)-CH2-COOH.
Напишите проекционные клиновидные и фишеровские формулы для всех оптических изомеров. Определите конфигурацию асимметрических центров по Кану– Прелогу– Ингольду.
4. Определите абсолютную конфигурацию (R или S) каждого асимметрического атома:
|
CHO |
|
OH |
|
COOH |
|
CH3 |
|
|
|
|
|
|||
H3C |
OH |
H |
D |
H2N |
H |
Br |
H |
|
|
||||||
|
CH2OH |
|
CH3 |
|
CH3 |
H |
OH |
|
|
|
|
|
|||
|
|
|
|
|
|
|
CH2CH3 |
|
а |
|
б |
|
в |
|
г |
|
CH3 |
|
CH3 |
|
CH2CH3 |
|
|
|
|
|
|
|
|
|
CHO |
Br |
H |
H |
SCH3 |
H |
D |
|
|
|
|
|
|
|
|
H |
|
HO |
H |
I |
H |
H |
NHCH3 |
|
|
|
|
|
|
|
|
|
CH2OH |
|
CH2CH3 |
|
CH2Cl |
|
OCH2CH3 |
|
|
|
д |
|
е |
|
ж |
|
з |
|
CH2OH |
|
CH2OH |
|
COOH |
|
SO3H |
H |
OH |
H |
OCH2CH3 |
H |
NH2 |
H |
NH2 |
H |
OH |
H |
OH |
H |
NH2 |
I |
H |
|
CH2Br |
|
CH2OH |
|
CHO |
|
CH3 |
|
и |
|
к |
|
л |
|
м |
5.Напишите формулы всех изомеров (в т.ч. циклоалканов) пентена и гексена.
6.Объясните понятия конформации и конфигурации на примере 1-хлор-1-бромэтана. Поясните свой ответ, используя структурные формулы.
7.Изобразите все стереоизомеры для 2,3-дибромпентана. Определите абсолютную конфигурацию хиральных центров.
8.Изобразите пространственные формулы (клиновидные проекции и проекции Фишера) для: а) (R)-2-хлорбутана; б) (S)-гексанола-3; в) (S)-1,2- дибромпропана; г) (3R, 4S)-3,4-диметилоктана; д) (S)-2-хлор-2-бром- бутана; е) (R)-3-метилгексана; ж) (S)-2-оксипропановой кислоты; з) (2S, 3R)-2-амино-3-метилпентановой кислоты; и) (S)-втор-бутилбензола;
21
к) (3R, 4R)-3,4-диметилгексана; л) (S)-2-метил-3-оксобутановой кислоты; |
С4Н6О2. Назовите их по номенклатуре IUPAC. |
|||||||
м) (2R, 3R)-2-метилбутандиола-1,3. |
|
|
|
24. |
Какие из перечисленных ниже соединений существуют в виде гео- |
|||
9. Сколько оптически активных изомеров существует для алкана |
метрических изомеров, напишите их проекционные формулы: пентен-3- |
|||||||
состава С7Н16? Изобразите их структурные формулы. Определите |
овая кислота, бутен-3-овая кислота, 2,3-диметилбутен-2-овая кислота, |
|||||||
абсолютную конфигурацию для всех хиральных центров и назовите |
пентен-2-овая кислота, 2-метилбутен-2-диовая кислота? |
|||||||
вещества. |
|
|
|
|
|
25. |
Напишите формулы изомерных двуосновных кислот состава |
|
10. |
Напишите формулы изомерных октанов. Назовите их по номенкла- |
С4Н8(СООН)2. Назовите их по номенклатуре IUPAC. |
||||||
туре IUPAC. Укажите первичные, вторичные, третичные и четвертичные |
26. |
Составьте формулы изомерных оксикислот состава С4Н8О3. Назо- |
||||||
атомы углерода. |
|
|
|
|
|
вите их по номенклатуре IUPAC. |
||
11. |
Напишите формулы изомерных октанов, содержащих в главной це- |
27. |
Приведите формулы предельных углеводородов, их галогенозаме- |
|||||
пи пять атомов углерода. Назовите. |
|
|
|
щенных и одноатомных спиртов, содержащих пять атомов углерода и |
||||
12. |
Напишите |
все возможные |
проекционные формулы Ньюмена: |
имеющих асимметрический (хиральный) атом углерода. Назовите их по |
||||
а) этана; б) хлорэтана; в) пропана; г) бутана (вокруг С2-С3); д) этаноламина |
номенклатуре IUPAC. |
|||||||
(2-аминоэтанола-1); е) 2,3-диметилбутана (вокруг С2-С3); ж) 2,2,3,3- |
28. |
Сколько асимметрических атомов углерода содержится в следую- |
||||||
тетраметилбутана |
(вокруг С2-С3); |
з) 2-метилбутана |
(вокруг С2-С3); |
щих соединениях: 3-метилбутанол-2; глицериновый альдегид; 2-метил- |
||||
и) 1-хлор-2-бромэтана; к) уксусной кислоты; л) этаналя; м) этанола. |
бутандиовая кислота; СН2OH-СНОН-СНОН-СНОН-СНОН-СНО? |
|||||||
13. |
Напишите формулы всех возможных изомерных радикалов и назо- |
29. |
Напишите все возможные оптические изомеры для 3-бром- |
|||||
вите: СН3-, С2Н5-, С3Н7-, С4Н9-, С5Н11-. |
|
|
пропанола-1; 2-бром-3-метилгексановой кислоты. Определите их абсо- |
|||||
14. |
Какие из перечисленных ниже соединений существуют в виде гео- |
лютную конфигурацию и изобразите в виде клиновидных проекций. |
||||||
метрических изомеров, напишите их проекционные формулы: бутен-1: |
30. |
Сколько пространственных изомеров соответствуют винной кисло- |
||||||
бутен-2; 2-метилбутен-2; 2,4-диметилгексен-3? |
|
|
те? Все ли они оптически активны? |
|||||
15. |
Какие из перечисленных ниже соединений существуют в виде гео- |
31. |
Какие из ниже перечисленных соединений имеют оптически неак- |
|||||
метрических изомеров, напишите их проекционные формулы: пентен-1; |
тивные изомеры вследствие внутренней компенсации: 2,2-дибром- |
|||||||
2-метилпентен-2; 3,6-диметилоктен-4; 2-метилгексен-3; 3,7-диметилокта- |
бутандиовая кислота; 4-хлоргексанол-3; 1,2,3,4-тетрахлорбутан? |
|||||||
диен-2,6-ол-4? |
|
|
|
|
|
32. |
Напишите формулы оптических изомеров для соединений: 1,2,3,4- |
|
16. |
Какие виды изомерии характерны для алкенов? Приведите форму- |
тетрагидроксибутан; 2,3-дихлорбутановая кислота. Есть ли среди них оп- |
||||||
лы всех возможных изомеров для соединений состава С4Н8; С5Н10. Назо- |
тически неактивные? |
|||||||
вите. |
|
|
|
|
|
|
33. |
Напишите формулы изомерных кетокислот состава С5Н8О3 и дайте |
17. |
Напишите формулы изомерных ацетиленовых углеводородов со- |
им названия по систематической номенклатуре. |
||||||
става С6Н10. Назовите их по номенклатуре IUPAC. |
|
|
34. |
Напишите формулы нитросоединений, изомерных: а) пропиловому; |
||||
18. |
Напишите все возможные изомеры для диеновых углеводородов, |
б) амиловому эфирам азотистой кислоты. Назовите их по номенклатуре |
||||||
отвечающих брутто-формуле C8H14, содержащих прямую углеводородную |
IUPAC. |
|||||||
цепь. Назовите их по номенклатуре IUPAC. |
|
|
35. |
Составьте проекционные формулы изомеров 1,2,3-триоксибутана; |
||||
19. |
Какие виды изомерии возможны у галогеноалканов? Напишите все |
2-метил-3-бромпентановой кислоты; 2,3-дихлорбутана. |
||||||
возможные изомеры для соединения состава С4Н9Br и назовите их по но- |
36. |
Напишите формулы изомерных аминов состава: С3Н9N, С4Н11N. |
||||||
менклатуре IUPAC. |
|
|
|
|
Назовите их по номенклатуре IUPAC. Какие виды изомерии характерны |
|||
20. |
Напишите формулы всех изомеров для спиртов состава С3Н7ОН, |
для аминов? |
||||||
С4Н9ОН. Назовите их по номенклатуре IUPAC. |
|
|
37. |
Напишите формулы всех возможных изомеров для аминокислот |
||||
21. |
Приведите |
формулы |
всех |
изомеров простых |
эфиров |
состава |
состава С3Н7О2N и С4Н9О2N. Назовите их по номенклатуре IUPAC. |
|
С5Н12О. Назовите их по номенклатуре IUPAC. |
|
|
38. |
На примере тетроз объясните, почему среди моносахаридов нет оп- |
||||
22. |
Составьте формулы изомеров валериановой кислоты. Назовите. |
тически недеятельных изомеров. |
||||||
23. |
Напишите |
формулы |
изомеров непредельных |
кислот |
состава |
39. |
На примере пентоз покажите виды изомерии, характерные для уг- |
|
|
|
|
|
22 |
|
|
|
23 |

леводов.
40.Напишите формулы всех возможных изомеров циклоалканов состава С5Н10. Назовите их по номенклатуре IUPAC.
41.Напишите формулы всех возможных изомеров циклоалканов состава С6Н12. Назовите их по номенклатуре IUPAC.
42.Сколько пространственных изомеров имеет циклопропан-1,2- дикарбоновая кислота? Напишите формулы.
43.Имеет ли 1,2-диметилциклобутан асимметрические атомы углерода? Сколько для этого соединения возможно изомеров?
44.Напишите формулы всех возможных изомеров ароматических углеводородов состава С9Н12. Назовите их по номенклатуре IUPAC.
45.Напишите формулы всех возможных изомеров ароматических соединений состава С7Н7Br. Назовите их по номенклатуре IUPAC.
46.Напишите формулы всех возможных изомеров ароматических соединений состава С6Н4Cl2. Назовите их по номенклатуре IUPAC.
47.Напишите формулы всех возможных изомеров ароматических соединений состава С7Н8О. Назовите их по номенклатуре IUPAC.
48.Напишите формулы всех возможных изомеров дигидроксибензола, тригидроксибензола. Назовите их по номенклатуре IUPAC.
49.Напишите структурные формулы изомеров карбонильных соединений ароматического ряда состава С8Н8О и назовите их по номенклатуре
IUPAC.
50.Напишите структурные формулы изомеров ароматических кислот состава C9H10О2. Назовите их по номенклатуре IUPAC.
51.Напишите структурные формулы изомеров нитросоединений ароматического ряда С7Н7NО2. Назовите их по номенклатуре IUPAC.
52.Напишите структурные формулы изомерных аминов ароматического ряда состава С7Н9N. Назовите их по номенклатуре IUPAC.
53.Напишите все возможные изомеры этилциклогексана. Назовите их по номенклатуре IUPAC.
Тема 3. Электронное строение молекул и теория электронных смещений
Контрольные вопросы
1.Какой принцип лежит в основе классификации видов влияния атомов в молекуле?
2.Дайте понятие об индуктивном влиянии (индукционный или индуктивный эффект). Что понимают под положительным и отрицательным эффектом? Почему индуктивный эффект является угасающим?
3.Дайте понятие об эффекте сопряжения, типах сопряжения (π,π-, π,p-, n,π-, σ,π-сопряжение). Приведите примеры. Дайте понятие о мезомерном эффекте, на приведённых примерах рассмотрите смещение элек-
24
тронной плотности в сопряжённых системах. Почему мезомерный эффект является неугасающим?
4.Что понимают под эффектом поля?
5.Как влияют положительные и отрицательные эффекты на:
-кислотные и основные свойства;
-введение электрофильных реагентов;
-введение нуклеофильных реагентов;
-введение радикальных реагентов?
6.Приведите примеры проявления стерического эффекта.
Задачи
I. Электронное строение молекул
1.Каким образом происходит образование ионных и ковалентных связей? В каких случаях образуются ионные связи, а в каких ковалентные? Укажите, какие из химических связей в нижеприведённых молекулах являются ковалентными, а какие ионными (или близки к ионным): NaOH,
CH3OH, HCl, KCl, CH3CH2ONa, CH3F, HOCl, NaOCl, NaNO2, CHCl3, CH3Na, СH3COOK, BF3, LiF, HNO3, NaHSO4, K2SeO4, HClO4, LiHSO3, KSH, H2S, CH2=CHLi, NaNH2, ClNH2, Na2S2O3. Ответы поясните.
2.Напишите структурные и электронные формулы Льюиса для соеди-
нений состава: а) С3Н4; б) С2Н3N; в) CH3NO2; г) C2H3NO; |
д) CH2N2; |
е) C2H2O; ж) С2Н6О; з) HNO2; и) SO2; к) HCN; л) HN3; м) HNO3. |
|
3.Укажите гибридизацию атомов углерода в следующих соединениях
иионах: CO2, CO, C3O2, CH3CH2 , CH3 , пропине, аллене (пропадиене- 1,2), HCN, HCHO, HCOOH, H2CO3, бутене-2, бензоле, пропен-2-овой ки-
слоте, СН2=СН , СН2=СН , СН3СН=NCH3, метилацетате, трихлорметане, цианид-анионе, тиоцианат-анионе (NCS ), бутадиене-1,3, бутен-1-ине-3, винилметилкетоне, бензальдегиде, ацетоне, пентадиене-1,4, пентен-1-ине- 4, СS2, винилэтиловом эфире. Изобразите геометрию указанных соединений и ионов. Дайте сравнительную характеристику длин связей и валентных углов.
4.Расположите указанные ниже соединения в порядке увеличения полярности связей. Ответ поясните. Для каждой из связей покажите направ-
ление электронных смещений: а) Cl-Cl, H-Cl, O-Cl, B-Cl, S-Cl, Cl-Br, C-Cl;
б) C-Cl, C-F, C-Br, C-Na, C-O, C-N, C-B, C-C, C-H; в) C-Mg, C-Cu, C-Li, C-Na, C-B, C-Zn, C-H; г) С(sp3)-H, С(sp)-H, С(sp2)-H, С(sp3)-С(sp2), С(sp2)-
С(sp3), С(sp3)-С(sp3), С(sp3)-Cl; д) N(sp3)-C(sp2), N(sp3)-C(sp3), N(sp2)-O, N(sp)-O, N(sp2)-N(sp3), N(sp3)-O, N(sp3)-H; е) C-OH, C-OH2Å, C-O , C-NH2; ж) С-СF3, С-СCl3, С-СBr3, С-СH2Br, С-СH2Cl; з) C-S(O)R, С-SR, C-S(O)2R, N-SR; и) С=O, C-O, C-N, C-S, C-F, C-C, C-P.
25

II. Электронные смещения в органических молекулах
5. Дайте определение понятию «индуктивный эффект заместителя». Что является причиной возникновения индуктивного эффекта? Что такое «положительный индуктивный эффект»? «Oтрицательный индуктивный эффект»? Сравните по силе и направлению индуктивного эффекта следующие группы заместителей: а) NH2, N(CH3)2, ÅN(CH3)3; б) этильная группа, винильная группа, этинильная группа; в) O , OH2Å, OH ; г) гидроксильная группа, аминогруппа, меркаптогруппа (SH); д) карбоксильная группа, карбоксилат-анион, карбонильная группа; е) Se , O , S ;
ж) ÅO(CH3)2, ÅN(CH3)3, SCH3, ÅS(CH3)2; ж) =O, =N(CH3); з) =NH2Å, -NO2, -NH3Å, -NH2; л) S(O)2-CH3, SCH3, S(O)-CH3, SO2O ; и) =O, -OCH3. Ответы объясните.
6.Стрелками обозначьте электронные смещения по индуктивному механизму под действием заместителей в следующих соединениях: метанол, пентен-1-ин-4, пропаналь, хлороформ, СH3-CH=N-CH3, этилфторид, этаннитрил, этиллитий, триметилбор, пентандион-2,4, изопропилмагнийхлорид, бутен-1, толуол, пропин, этилат натрия, ацетат калия, диметилсульфид, изопропиламин, метансульфонат натрия. Приведите распределение электронной плотности для указанных молекул.
7.Что такое «делокализованные» химические связи и в чём их отличие от «локализованных»? В каких случаях возникают делокализованные химические связи? Что такое «сопряжение»? Какие условия необходимы для возникновения сопряжения? Какие бывают типы сопряжения? Напишите граничные структуры для следующих соединений: а) 1,3-бутадиена, бензола; б) винилхлорида, уксусной кислоты; в) нитрат-аниона, аллильного катиона; г) СH3-CH=CH-CN, мочевины; д) азотистой кислоты, нитрометана; е) пропеналя, хлорбензола; ж) винилметилового эфира, диметилсуль-
фоксида; з) этенолят-аниона (O=CH-CH2 ), озона; и) нитрат-аниона, бензальдегида; к) пропин-2-оат-аниона, фенола; л) бензильного радикала, циклогексадиена-1,3; м) виниламина, анилина.
III. Теория кислот и оснований
8. Дайте определение кислоты и основания по Брёнстеду. Какие из перечисленных ниже соединений и ионов можно отнести к кислотам, а какие к основаниям Брёнстеда: HCl, F , H2O, CH4, CH2=CH2, OH , NH4Cl, C6H6, NH3, CH3NH2, H2S, Na2O, CH3C(O)NH2, Na2S, H2SO4, CH3NO2, CH3C(O)CH3, C2H5-OH, (CH3)3P, CH3COOH, KCl, Na2CO3, CH3COOLi, ацетилен, толуол, CO, N2, Na2SO4, NH4Å, CO2, NH2-C(O)-NH2, CCl4, пропен, BaO, бутин-1, LiF, диметиловый эфир, формальдегид, СH3 , CH3Li, C2H6, CF2=CF2, H , KNH2, PH3, (CH3)4NÅ, HOCl. Какие из указанных выше со-
единений и ионов могут проявлять свойства и кислот и оснований (амфо-
26
терные свойства)? Ответ поясните.
9. Что является основанием, сопряжённым какой-либо кислоте, а что − кислотой, сопряжённой какому-либо основанию? Напишите для следующих кислот сопряжённые им основания: NH3, CH4, H2SO4, H3OÅ, HF, CH3OH, NH4Å, HCO3 , HCOOH, ацетилен, трихлорметан, бензол, ацетон, NH2-C(O)-NH2, CH3NO2, OH , [CH3-C(=OH)NH2]Å, SH , [O2N-OH2]Å, HO-SO2-F, [C2H5-OH2]Å, HCN, HPO4  . Напишите для следующих основа- ний сопряжённые им кислоты: NH3, CH3OH, HCO3 , NH2-C(O)-NH2, OH ,
. Напишите для следующих основа- ний сопряжённые им кислоты: NH3, CH3OH, HCO3 , NH2-C(O)-NH2, OH ,
HPO4 , ацетон, SH , HCOOH, HF, F , HCOO , CH3CH2O , H2O, CH3C≡N, HC≡C , CH3
, CH3 ,
,  CH2C(O)CH3, HNO3, NH2
CH2C(O)CH3, HNO3, NH2 , S
, S
 , CH3NO2,
, CH3NO2,
C2H5-NH2.
10. Какие факторы влияют на основность и кислотность по Брёнстеду? Расположите перечисленные ниже частицы в порядке усиления их основ-
ных свойств в апротонных растворителях: а) F , I , Cl , Br ; б) NH3, HF,
H2O; в) LiCH3, LiF, LiNH2, LiOH; г) CH3OH, CH3SeH, CH3SH; д) H2O, KOH, K2O; е) HC≡C , CH3CH2
, CH3CH2 , CH2=CH
, CH2=CH ; ж) CH3CH=NH, CH3CH2NH2, CH3C≡N; з) CH3COO
; ж) CH3CH=NH, CH3CH2NH2, CH3C≡N; з) CH3COO , HCOOH, HCOO
, HCOOH, HCOO , CH3COOH; и) CH3CH2O
, CH3COOH; и) CH3CH2O ,
,
CH3COO , Cl-CH2COO , CCl3COO ; к) NH3, CH3-C(O)-NH-C(O)-CH3, CH3-C(O)-NH2, C6H5-NH2; л) аммиак, диметиламин, метиламин, анилин;
м) СН2=СН-N(CH3)2, С2H5N(CH3)2, СН2=СН-N(CH3)-CH=CH2.
11. Определите место протонирования (в условиях термодинамического контроля в апротонных растворителях) под действием подходящей кислоты Брёнстеда на следующие основания, имеющие несколько основных центров. Напишите химические формулы сопряжённых кислот: HO-CH2-CH2-SH, С6H5-NH-NH2, NH2OH, HO-CH2-CH2-NH2, NH2CH2CH2N(CH3)2, NH2-CH2-CH2-O , NH2-CH2-CH2-NH-C(O)-CH3,
CH2-COO , HO-CH2-CH2-O , аллиламин, HO-CH2-CH=O, пропен, С6H5-NH-CH2-CH2-NH-C(O)-CH3, 2-хлорэтанол, CH3O-CH2-CH2-OH,
CH3-C(O)-NH-C(O)-CH3, HO-CH2COO , CH3-C(O)-СH -C(O)-CH2 ,
O-CH2COO , NH2-CH2-C≡N, CH3-Mg-Cl, аллильный анион, пропен-2-
аль. Ответы обоснуйте.
12. Расположите перечисленные ниже частицы в порядке усиления их кислотных свойств в апротонных растворителях: а) ацетон, пропан, пен- тандион-2,4; б) ацетилен, этан, этен; в) метан, дихлорметан, хлороформ; г) 2-хлоруксусная кислота, 2-нитроуксусная кислота, муравьиная кислота, уксусная кислота; д) фенол, 4-нитрофенол, 4-метилфенол, этанол, 4-бром- фенол, уксусная кислота; е) С2H5SH, С2H5OH, С2H5SeH; ж) метанол, мети-
ламин, метан; з) HO-NO, HO-NO2, HO-NH2; и) H2O, H2S, CH3OH, NH3, HF,
CH4; к) CH3-C(O)-NH-C(O)-CH3, CH3-C(O)-NH2, NH3, C6H5-NH2; л) HC≡CH, HC≡CNa, HC≡N, H2O; м) N≡C-CH2-C≡N, CH3C≡N, CH(C≡N)3.
13. Укажите, в какую сторону будут смещены кислотно-основные рав27

новесия для следующих реакций. Ответы обоснуйте:
а) CH3NH2 + CH3 Li |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3NH |
Li |
+ CH4; |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
б) CH3SH + CH3O |
Na |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3S |
Na |
+ CH3OH; |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
в) HC≡CH + CH3CH2MgBr |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HC≡C |
MgBr |
+ CH3CH3; |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
г) NH3 + H2O |
|
|
|
|
|
|
NH4 OH ; |
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
д) CH3OH + CH3COO K |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3O |
K |
+ CH3COOH; |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
е) CH3NH2 + CH3O |
|
Na |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3NH |
Na |
+ CH3OH; |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
ж) CH3CH2OH + Na OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3CH3O Na |
+ H2O; |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
з) CH3OH + HF |
|
|
|
|
[CH3OH2] F ; |
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
и) Na OH + Na |
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2O + Na2O; |
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
к) CH3C(O)NH2 + Na NH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3C(O)NH |
Na + NH3; |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
л) CH3CH2OH + Na |
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3CH2O |
Na |
+ H2; |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
м) HCOOH + K OH |
|
|
|
|
|
|
|
|
HCOO |
K |
+ H2O. |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
14. Закончите уравнения следующих кислотно-основных взаимодейст-
вий по Брёнстеду: |
|
а) CH2=CH2 + H2SO4; |
ж) CH3CH3ONa + NaSH; |
б) CH3COOH + NaH; |
з) CH3-C(O)-CH3 + NaNH2; |
в) HC≡CH + NaNH2; |
и) CH3NH2 + CH3COOH; |
г) CH3-C≡N + HCl; |
к) H2O + CH3-C(O)-CH2Li; |
д) HI + CH3OH; |
л) Na2CO3 + NH4Cl; |
е) CH3Li + CH3NH2; |
м) CH2=CHMgCl + CH3OH. |
Модуль 2. УГЛЕВОДОРОДЫ
Тема 4. Алканы (предельные углеводороды, парафины)
Контрольные вопросы
1.По каким признакам определяют принадлежность органических соединений к предельным углеводородам? Почему их назвали парафинами?
2.На примере пропана дайте характеристику углерод-углеродных и водород-углеродных связей в сравнении: форма гибридных орбиталей и вид перекрывания, длина связи, полярность, энергия, пространственная доступность для реагентов, способ разрыва. Сделайте выводы о типах и механизмах реакций для алканов.
3.Покажите механизм реакций радикального замещения при: хлорировании, сульфохлорировании, сульфоокислении, нитровании, окислении алканов.
4.Чем обусловлен широкий спектр применения алканов?
5.Обозначьте экологические проблемы в химии алканов.
28
Задачи
I. Способы получения и химические свойства
1-12.Запишите уравнения реакций, укажите условия их протекания и названия конечных продуктов. Назовите исходные вещества и реакции, если названия отсутствуют в заданиях:
1.
а) CH3-CH(CH3)-CH2-COO Na + NaOH |
|
; |
|
||
б) CH3-CH(CH3)-CH3 + Br2 →; |
|
|
в) (CH3)2CH-I + CH3I + Na → (три реакции); |
|
|
г) сульфохлорирование бутана; |
|
|
д) рекомбинация радикалов (CH3)2CH-ĊH2 |
|
|
е) С2H5-MgBr + iPr-Br →. |
|
|
2. |
|
|
а) 2sBu-Br + 2Na →; |
|
|
б) гидрирование бутена-1; |
|
|
в) монохлорирование 2,2-диметилпропана; |
|
|
г) нитрование 2-метилбутана по Коновалову; |
|
|
д) СH3-CH2-ĊH2  ; е) (CH3)2CH-I + HI →.
; е) (CH3)2CH-I + HI →.
3.
а) CH3-CH(CH3)-CH2-MgBr + H2O →; б) CH3-CH(I)-CH2-CH3 + HI →;
в) получение 2,5-диметилгексана по Вюрцу (без побочных продуктов);
г) бутан + SO2 + Cl2 →;
д) β-распад радикала СН3-СН2-СН2-СН2-ĊН2;
е) СH3-MgBr + tBu-Br →. 4.
а) 2 CH3-CH(CH3)-CH2-I + 2 Na →; б) СН3-СН=СН-СН3 + Н2 →; в) монохлорирование диэтилметана;
г) сульфохлорирование 2-метилбутана; д) диспропорционирование радикала СН3-СН2-СН2-ĊН2;
е) C2H5-MgBr + H2O →. 5.
а) (CH3)2C=CH2 + H2 →;
б) получение 3,4-диметилгексана по Вюрцу (без побочных продуктов); в) монобромирование изобутана;
г) СH3-CH2-CH2-CH3 + HNO3(конц.), 400оС →;
д) диспропорционирование радикала СH3-CH2-ĊH2;
29
е) гидрирование диизопропилметилэтилена. 6.
а) CH3-CH2-CH2-I + HI →;
б) СH3-CH2-COO Na + NaOH →;
в) монобромирование неопентана; г) пентан + SO2 + Cl2 →
д) изомеризация радикала СН3-СН2-СН2-ĊН2;
е) СH3-CH2 Li + H2O →. 7.
а) гидрирование триметилэтилена;
б) CH3-C(CH3)2-COO Na + NaOH |
|
; |
|
||
в) 2,2-диметилпропан + Cl2 →; |
|
|
г) пентан + SO2 + Cl2 →; |
|
|
д) рекомбинация радикала (CH3)3Ċ; |
|
|
е) (CH3)2CH Li + H2O →. |
|
|
8.
а) CH3-CH2-Br + CH3-CH2-CH2-Br + 2Na → (три реакции);
б) метан + Cl2 (избыток) →;
в) 2,2,3-триметилбутан + HNO3(разб.), 140оС →; г) изомеризация радикала СH3-CH2-ĊH2;
д) диспропорционирование радикала СН3-СН2-СН2-ĊН2;
е) СH3-MgBr + C2H5-Br →. 9.
а) CH3-CH(CH3)-COO Na  ; б) CH3-CH(CH3)-CH3 + Cl2 →;
; б) CH3-CH(CH3)-CH3 + Cl2 →;
в) пропан + SO2 + O2 →;
г) гидрирование изопропилэтилена;
д) β-распад радикала СH3-CH2-CH2-CH2-ĊH-CH3;
е) CH3-CH(MgCl)-CH3 + H2O →. 10.
а) СH3-CH2-CH2-I + HI →
б) нитрование по Коновалову изобутана;
в) CH3-CH(CH3)-CH2-CH3 + SO2 + Cl2 →;
г) CH3-CH(CH3)-ĊH2  ;
;
д) рекомбинация радикалов СH3-CH2-ĊH2;
е) Li(C2H5)2Cu + CH3-I →.
30
11.
а) нитрование тетраметилметана по Коновалову; б) бромирование 2-метилбутана; в) нитрование пентана в газовой фазе;
г) CH3-CH2-CH3 + SO2 + O2 →;
д) диспропорционирование радикала CH3-ĊH-CH3;
е) Li(CH3)2Cu + (CH3)2CH-I →. 12.
а) получение по реакции Кольбе 2,3-диметилбутана;
б) CH3-CH2-Br + CH3-CH2-CH2-Br + Na → (три реакции);
в) монохлорирование 2-метилбутана;
г) пропан + HNO3(разб.) → (реакция Коновалова);
д) β-распад радикала СH3-CH(CH3)-CH2-CH2-ĊH2;
е) Li(C2H5)2Cu + (CH3)2CH-I →.
13. Назовите алканы, являющиеся продуктами следующих реакций: а) СН3-СН2-СН2-I + НI →;
б) (CH3)2CH-CH2-Br + Na, t° →;
в) CH3CH2Br + CH3CH2CH2Br + Na, t° →;
г) CH3CH2CH2CH2Br + Mg (эфир) → … + HOH →;
д) CH3-CH=CH-CH2-CH3 + H2, Ni, p →;
е) (CH3)2CH-CH2-COONa, электролиз водного раствора →;
ж) CH3COONa + NaOH (сплавление) →.
14. Назовите соединения, образующиеся в следующих реакциях:
15. Как можно получить н-бутан из указанных соединений: н-бутил- бромида; втор-бутилбромида; хлористого этила; бутена-2; валериановой кислоты; пропионовой кислоты? Приведите схемы реакций.
Как можно получить н-бутан из указанных соединений: н-бутил- бромида; втор-бутилбромида; хлористого этила; бутена-2; валериановой кислоты; пропионовой кислоты? Приведите схемы реакций.
16.Приведите схемы реакций, лежащих в основе промышленных методов получения из метана следующих веществ: метанола; формальдегида; ацетилена; четырёххлористого углерода.
17.Предложите методы синтеза 2,3-диметилбутана из соединений, содержащих в молекуле 3; 4; 6; 7 атомов углерода.
18.Какие продукты могут образоваться при низкотемпературном окислении а) пропана; б) бутана; в) 2-метилпентана?
19.Какие продукты могут образоваться при ароматизации гептана, ок-
тана?
20.Приведите реакции промышленного синтеза на основе а) метана; б) этана; в) пропана.
31
21.Какие углеводороды получатся при действии натрия на смесь 1-иодбутана и 2-иодпропана? Напишите уравнения реакций и дайте названия соединениям по систематической номенклатуре.
22.Какие соединения могут образоваться при термическом крекинге октана?
23.Приведите уравнения реакций получения пентана всеми возможными способами.
24.Каким образом из бутана можно получить 3,4-диметил-3-нит- рогексан. Напишите уравнения реакций.
25.Для опыта взрывания а) метана, б) этана, в) пропана, г) бутана смешивают углеводород с кислородом. Какое оптимальное количество кислорода надо взять для взрыва 100 мл соответствующего газа при стандартных условиях. Рассчитайте, какое количество природного газа достаточно для взрыва в кухне объемом 27 м3 (стандарнтные условия).
26.Исходя из пропена, путем последовательных реакций получите 2,3-диметилбутан.
27.Имея изобутен и неорганические вещества, синтезируйте 2,2,3,3- тетраметилбутан.
28.Напишите уравнения реакций получения пропана и бутана декарбоксилированием соответствующих натриевых солей карбоновых кислот.
II. Механизм SR-реакций и реакционная способность алканов
29–40. Для приведённых ниже соединений приведите механизм реакций а) монохлорирования; б) монобромирования; в) нитрования по Коновалову; г) сульфохлорирования. Запишите формулы всех возможных свободных радикалов, образующихся на скоростьопределяющей стадии. Расположите эти интермедиаты в порядке возрастания стабильности, укажите причины их различной стабильности:
29. н-бутан; 30. 2-метилбутан; 31. 3-метилпентан; 32. 3,4-диметил- гексан; 33. 2-метилпентан; 34. н-пентан; 35. 2,2-диметилбутан; 36. 3-метилгексан; 37. изобутан; 38. пропан; 39. 2,4-диметилпентан;
40.2-бромпропан.
41.Охарактеризуйте влияние алкильных групп на относительную устойчивость свободных углеводородных радикалов. Назовите приведённые радикалы и расположите их в порядке возрастания термодинамической устойчивости: а) СН3ĊНСН2СН3; б) (СН3)2ĊСН3; в) СН3-СН2-СН2-ĊН2;
г) (СН3)2СН-ĊН2.
42.Напишите реакцию монохлорирования 2-метилбутана. Опишите отдельные стадии свободнорадикального цепного механизма. Какие углеводородные радикалы образуются в медленной стадии? Сравните устойчивость. В каком направлении скорость реакции будет наибольшей?
43.Напишите реакции монохлорирования метана и этана. Объясните,
32
почему скорость хлорирования этана в 400 раз больше таковой для метана.
44.С какими из приведённых соединений реагирует н-бутан при заданных условиях? Напишите эти реакции. Для реакций д) и ж) приведите механизмы реакций: а) серная кислота (конц.), комн. температура; б) азотная кислота (конц.), комн. температура; в) металлический натрий, комн. температура; г) бром, в темноте, об. усл.; д) бром, свет, 20° С; е) перманганат калия, вода, 20° С; ж) азотная кислота (разб.), 140° С, давление; з) ки-
слород, пламя; и) бромоводород; к) SО2 + Cl2, освещение, 20° С; л) I2 , освещение, 20° С.
45.При хлорировании н-бутана на свету при 25° С образуется 28% хлористого н-бутила и 72% хлористого втор-бутила. Рассмотрите механизмы протекающих реакций. Оцените относительную реакционную способность первичного и вторичного атомов водорода. Объясните малую селективность реакции хлорирования.
46.Относительные скорости замещения третичного, вторичного и первичного атомов водорода при бромировании алканов составляют 1600:82:1. Определите содержание мономерных бромалканов изобутана. Объясните высокую селективность реакции бромирования.
47.Объясните, почему пропан не одинаково реагирует с различными галогенами:
48.Напишите уравнение реакции Коновалова для этана, н-пентана, 2-метилбутана. В каких условиях протекает реакция? Какой углеводород наиболее легко будет подвергаться превращению? Дайте объяснение.
49.Напишите схему монобромирования метилциклогексана. Назовите продукт реакции. Приведите механизм реакции.
50.Свободнорадикальное хлорирование пропилили изопропилбромида приводит к 1-бром-2-хлорпропану, а изобутилили трет- бутилбромида – к 1-бром-2-хлор-2-метилпропану. Объясните эти результаты, ползуясь вашими знаниями о механизме свободнорадикального замещения?
51.Запишите уравнение и механизм реакции сульфохлорирования углеводородов: а) 2,3-диметилпентана и б) 2-метилпентана. Сравните скорость данной реакции и реакции сульфохлорирования этана. Предложите объяснение выявленного различия с точки зрения строения интермедиатов, образующихся на скоростьопределяющей стадии процесса. Используя механизм превращения, объясните: 1) почему при сульфохлорировании
33
алканов в качестве побочных продуктов образуются хлоралканы? 2) каков стереохимический результат реакции?
III. Определение строения алканов
52.При хлорировании пропана были выделены четыре продукта (А, Б,
Ви Г), имеющих общую брутто-формулу C3H6Cl2. Напишите их структуры. Каждый из изомеров хлорировали дальше и количество трихлорпро-
изводных (C3H5Cl3), полученных из каждого изомера, определяли методом газожидкостной хроматографии. Из А образовалось одно трихлорпроизводное, из Б – два, из В и Г – по три. Напишите уравнения всех реакций и определите структуры А, Б, В и Г.
53.Углеводород С5Н12 при хлорировании образует только одно монохлорзамещённое соединение. Какое строение имеет исходный углеводород?
54.Какое строение имеет углеводород С10Н22, если известно, что он был получен электролизом водного раствора соли карбоновой кислоты, которая при сплавлении со щёлочью образует тетраметилметан? Напишите уравнения реакций.
55.Углеводород С5Н12 в условиях реакции Коновалова превращается в третичное нитропроизводное. Какое строение имеет исходное соединение?
56.Установите строение соединения С4Н10, которое легко бромируется на свету, а при хлорирования даёт смесь монохлорпроизводных. Углеводород С4Н10 нельзя получить по реакции Вюрца без побочных продуктов.
57.Определите строение углеводорода С6Н14, который в условиях реакции Коновалова превращается в третичное нитросоединение. Этот углеводород может быть получен из вторичного галогеналкана по реакции Вюрца без побочных продуктов.
58.Определите строение соединения С7Н16, которое при нитровании не даёт третичных нитропроизводных, а при хлорировании образует четыре изомера, среди которых только один представляет собой первичное монохлорпроизводное. Предложите реакцию получения этого углеводорода с использованием диалкилкупрата лития.
59.Определите строение углеводорода С7Н16, которое легко бромируется на свету с образованием двух третичных бромпроизводных, а при хлорировании образует смесь монохлорпроизводных, среди которых три первичных хлоралкана.
60.Установите строение соединения С8Н18, если известно, что: а) при его хлорировании получается только одно монохлорзамещённое соединение; б) углеводород может быть получен по реакции Вюрца и Кольбе без побочных продуктов.
61.Определите строение соединения С8Н18, при нитровании которого
34
образуется преимущественно третичное нитросоединение. Углеводород может быть получен электролизом натриевой соли 3-метилбутановой кислоты и по реакции Вюрца без побочных продуктов.
62. Углеводород С6Н14 при бромировании не даёт третичных бромпроизводных, а при хлорировании образует три монохлорпроизводных. Углеводород С6Н14 нельзя получить по реакции Кольбе. Предложите его структурную формулу.
63. Установите строение карбоновой кислоты, если известно, что: а) при электролизе её натриевой соли образуется углеводород С6Н14, бромирование которого приводит к образованию третичного монобромпроизводного; б) при сплавлении соли этой кислоты со щёлочью выделяется диметилметан.
Тема 5. Алкены (этиленовые углеводороды, олефины) и диены
Контрольные вопросы
1.Почему этиленовые углеводороды относят к непредельным углеводородам? Как это связано с валентным состоянием атома углерода? Чем объясняется реакционная способность кратной связи? Охарактеризуйте её длину, энергию, поляризуемость.
2.Какие виды изомерии возможны для алкенов?
3.Объясните, почему алканы склонны к реакциям свободнорадикального замещения, а алкены – ионного присоединения.
4.Охарактеризуйте реагенты, вступающие в реакции с алкенами. В чём заключается суть правила Марковникова? Что понимают под эффектом Караша?
5.Дайте определение понятиям «полимеризация», «полимер», «мономер», «степень полимеризации». Рассмотрите механизмы ионной и свободнорадикальной полимеризации.
6.Чем объясняется практическое значение алкенов?
7.Приведите основные промышленные и лабораторные способы получения алкенов.
Задачи
I. Получение и реакционная способность
1. Предложите схемы синтеза соединений, используя только неорганические реагенты: а) бутена-2 из бутена-1; б) бутандиола-2,3 из этанола; в) 2,3-диметилбутена-2 из пропилена; г) 3-бромоктена-1 из октанола-1; д) 3-хлорпентена-1 из пентанола-1; е) 2-метилпентена-2 из 2-метил- пентана; ж) 4-метилпентена-2 из 4-метилпентена-1; з) 3,4-диметилгексена- 3 из 2-бром-3,4-диметилгексана; и) 3,4-диметилгексана из бутена-1; к) триметилэтилена из 3-метилбутанола-1; л) 1,2-дибромпропана из про-
35
пана; м) пентена-2 из пентанола-1.
2. Запишите уравнения реакций и укажите условия их протекания. Назовите все вещества по систематической номенклатуре (если эти названия отсутствуют в задании):
а) СН2=СН-СН2-СН3 + ICl →; СН2=СН2 + О2 / Ag →; гидратация пен- тена-1; полимеризация пропилена в присутствии ортофосфорной кислоты; озонолиз изопрена; СН2=СН-СН=СН2 + СН2=СН-CN →; СН2=СН-СН=СН2
+ HBr →;
б) СН2=СН-СН2-СН3 + НОН →; димеризация изобутилена; пропен + HNO3 (разб.), 140оС, р →; изопропилэтилен + Br2/CCl4 →; изопрен + HBr (1 моль) →; озонолиз гексадиена-2,4; гидроборирование– окисление буте-
на-1;
в) СН2=СН-СН2-СН3 + H2SO4/tкомн. →; СН2=СНСН2СН3 + HBr/ROOR
→; метилциклогексадиен-1,3 + HCl (1 моль), t~40oC →; качественная реакция на двойную связь; присоединение 1 моля брома к бутадиену-1,3 при t -80oC; поведение изопрена в присутствии катализатора Циглера− Натта;
СН2=СН-СН3 + СО + Н2 →;
г) изобутилен + HCl →; СН2=СН-СН3 + R-C(O)-O-O-H →; гидратация 4-метилпентена-2; бутен-2 в реакции Вагнера; жёсткое окисление 2,5-ди- метилгексадиена-2,4; 1,4-полимеризация бутадиена-1,3; циклоприсоединение дихлоркарбена (СCl2) к этилэтилену;
д) 2,3-диметилбутен-1 + HOCl →; полимеризация пропилена; гидратация пентена-2; коричный альдегид + HBr/ROOR →; гидрирование изопрена на катализаторе Ренея; озонолиз пентадиена-1,4; СН3-СН=СН-СН=СН-СН3
+ СН2=СН-СООН →;
е) изобутилен + ICl →; гексен-3 + K2Cr2O7/HÅ →; гидратация пентена- 2; присоединение 2 моль HBr к винилциклогексену-2; гидрохлорирование (1 моль) гексадиена-1,3; 1,4-полимеризация 2-метилбутадиена-1,3;
ж) гипохлорирование пентена-1; изобутилен + HBr/ROOR →; гидрирование бутена-1; озонолиз циклопентена; 2-метилбутадиен-1,3 + HBr (1 моль) →; 1,4-полимеризация 4-метилпентадиена-1,3; СН2=СН-СН=СН2 +
СН2=СН-CN →;
з) 2,3-диметилбутен-1 + HI →; высокотемпературное хлорирование пропилена; транс-присоединение брома к циклогексену; тримеризация изопрена; СН2=СН-СН=СН-СН3 + Br2 (-80oC) →; 4,5-диметилгексадиен- 1,4 + реактив Вагнера; гидрирование малеиновой кислоты;
и) изобутилен + H2SO4 (холод) →; СН3-СН=СН-СН3 + Н2 →; CCl3-CH=CH2 + HBr →; изопрен + Br2/H2O →; гидрохлорирование (1 моль) гексадиена-1,3; жёсткое окисление 2,5-диметилгептадиена-2,5; сопряжённое присоединение брома к бутену-2 в присутствии LiCl;
к) СН2=СН-СН3 + HBr →; полимеризация бутена-1; триметилэтилен + KMnO4/Na2CO3, H2O, tкомн. →; тримеризация симм-диметилэтилена; моно-
36
бромирование 2,3-диметилбутадиена-1,3; СН3-СН=СН-СН2-СН=СН2 + реактив Вагнера →; циклоприсоединение бутадиена-1,3 к пропеновой кислоте;
л) гидробромирование бутена-1 в присутствии перекиси бензоила; изобутилен + KMnO4/H2O, 0-20oC →; жёсткое окисление 2,3-диметил- октадиена-2,6; гидрирование децена-2; СН3-СН=СН-СН=СН-СН3 + Br2 (-80oC) →; озонолиз 2-метилпентадиена-1,4; гидроборирование– восстановление изобутилэтилена;
м) СН2=СН-СН3 + ICl →; гидрокислирование пентена-2; качественная реакция с бромной водой на двойную связь; 1,2-полимеризация изопрена; 2-метилбутадиен-1,3 + HI (1 моль) →; бутадиен-1,3 + Н2/Pt →; 2,5-ди- метилгексадиен-1,4 + KMnO4/HÅ →.
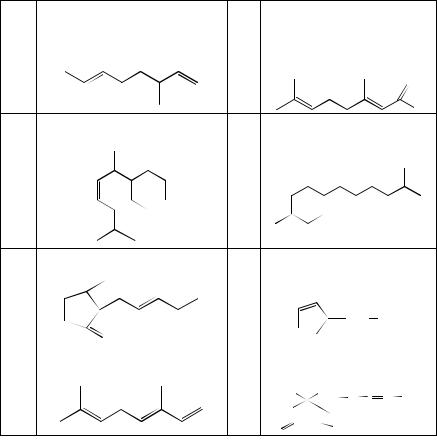
3. Напишите уравнения реакций озонолиза следующих соединений:
а |
2-метилгептадиен-2,5 |
е |
2,3- |
|
диметилциклогексадиен-1,3 |
||||
|
|
|
||
|
Мерцен (выделен из листьев |
|
Цитраль (составная часть |
|
|
|
эфирных масел цитрусо- |
||
|
лавра) |
|
||
б |
ж |
вых) |
||
|
Цингиберен (главный компонент эфирного масла имбиря) Бисаболен (компонент ли-
монного масла)
в |
з |
|
Жасмон (душистое вещество |
Хаульмугровая кислота |
|
|
жасмина) |
||
|
(средство для лечения про- |
||
|
|
||
г |
и |
казы) |
|
|
|
|
|
|
Оцимен (составная часть |
Абсцизовая кислота (при- |
|
|
родный ингибитор роста |
||
|
эфирного масла хмеля) |
||
|
растений) |
||
д |
к |
||
|
37
|
Сквален (метаболит биосинте- |
|
|
|
|
за холистерола) |
|
|
Линоленовая кислота (ком- |
л |
|
|
м |
понет липидов) |
CH2 |
|
|
||
|
|
|
|
|
|
H3C |
|
|
CH3(CH2CH=CH)3(CH2)7COOH |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
4. Напишите уравнения реакций диеновой конденсации (реакции Дильса– Альдера): а) 2-метилбутадиена-1,3 (изопрена) с малеиновым ангидридом; б) 1-винилциклогексена с малеиновым ангидридом; в) 1-винил- циклопентена с дицианоацетиленом; г) бутадиена-1,3 с дицианоацетиленом; д) 2-метилбутадиена-1,3 с гексафторбутином CF3-C≡C-CF3; е) 2-метилпентадиена-2,4 с малеиновым ангидридом; ж) 1-фенилбута- диена-1,3 с малеиновым ангидридом; з) циклопентадиена с малеинимидом
O
CH2
NH
O ; и) 1,2-диметиленциклогексана 
 CH2 с акролеином; к) гекса- диена-2,4 с малеиновым ангидридом; л) бутадиена-1,3 с цитраконовым
CH2 с акролеином; к) гекса- диена-2,4 с малеиновым ангидридом; л) бутадиена-1,3 с цитраконовым
ангидридом  ; м) циклопентадиена с кротоновой кислотой СН3-СН=СН-СООН.
; м) циклопентадиена с кротоновой кислотой СН3-СН=СН-СООН.
5. Назовите по систематической номенклатуре приведённые ниже алкены. Отметьте среди них: 1) идентичные; 2) структурные изомеры, отличающиеся положением двойной связи; 3) структурные изомеры с разным строением цепи; 4) у каких алкенов возможна Z-, E-изомерия:
а) CH3СН=СНСН2СН3, б) СН2(СН3)СН2СН=СН2,
в) СН3С(СН3)=СН2СН3, г) СН3С(СН3)=СН-СН3, д) СН2С(СН3)СН2СН3,
е) СН3СН=С(СН3)СН3, ж) Н2С=СН-СН2СН2СН3, з) СН(СН3)=СН-СН2СН3.
6. Напишите формулы изомерных алкенов с углеродным скелетом указанного строения. Назовите их по рациональной и международной номенклатурам:
38
7. Напишите структурные формулы соединений и назовите их по международной номенклатуре: а) трет-бутилэтилен; б) тетраэтилэтилен; в) симм-диизопропилэтилен; г) несимм-пропил-втор-бутилэтилен; д) триметилэтилен. Для которых из них характерна геометрическая изомерия, напишите их формулы.
8.Напишите структурные формулы соединений и назовите их по рациональной номенклатуре: а) 3,4-диметилгексен-3; б) 2,3,5-триметил- гексен-2; в) 2,2,5,5-тетраметилгексен-3; г) 2-метил-3,4-диэтилгексен-3.
9.Какие из приведённых алкенов могут существовать в виде цис-, транс-изомеров: а) пентен-2; б) 2-метилпентен-2; в) гексен-3; г) 3,4-ди- метилгексен-3; д) 3,4-диэтилгексен-3; е) 3,4-диэтилгексен-2? Изобразите формулы изомеров.
10.Напишите формулы следующих изомеров; а) (Е)-бутена-2; б) (Z)- пентена-2; в) (Е)-гексена-3; г) (Z)-3-метилпентена-2.
11.В каждой паре приведённых ниже соединений укажите термодинамически наиболее устойчивое: а) бутен-1 и бутен-2; б) 2,3-диметилбутен-2
и2-метилпентен-2. Ответ обоснуйте.
12.Охарактеризуйте химические свойства алкенов. Назовите реакции, которые для них характерны. Дайте определения понятиям: а) гетеролиз
π-связи; б) электрофил; в) карбокатион; г) реакции электрофильного присоединения: д) реакции радикального присоединения.
13. Напишите реакции пропена с хлором в следующих условиях: а) в полярном растворителе, 20°C; б) в газовой фазе на свету при температуре ниже 200° С; в) в газовой фазе при температуре 500° С. Почему пропен в зависимости от условий по-разному реагирует с хлором? Приведите механизмы реакций.
14. Как химическим путем можно:
–отличить пары соединений: а) н-гексан и гексен-2; б) гексен-2 и гексен-3; в) 2-метилпентен-2 и 3-метилпентен-2;
–разделить смеси: г) н-пентана и пентена-2; д) н-пентана и пентена-1? 15. Напишите уравнения реакций и назовите все вещества;
а) СН3СН(СН3)СН(ОН)СН3, Al2O3, 300oC →;
б) СН3-СН(ОН)-СН2-СН3, H2SO4, toC →; в) СН3-СНBr-СН3, КОН (спирт), toC →;
д) СН3СН2СН2СН3 + Pd, 4500C →;
е) СН3С≡ССН3 + H2, [Pd, PbO] →.
16. Предложите схемы превращений: а) 2-метилпентан → 2-метил- пентен-2; б) пропен → 2,3-диметилбутен-2; в) бутен-1 → бутен-2; г) пентанол-1 → пентен-2; д) 1-бром-3-метилбутан → 2-метилбутен-2.
17. Заполните схемы превращений. Назовите все вещества по систематической номенклатуре.
39
