
01.Лечебное дело / Биоорганическая химия / 06.Дополнительно / Всякое / Органическая химия
.pdf5. В каких реакциях анилин проявляет: а) основные свойства; б) кислотные свойства? Как изменяются основные свойства ароматических аминов при введении электронодонорных и электроноакцепторных заместителей?
6.В чём особенности SЕ2-реакций анилина при проведении: а) алкилирования и ацилирования; б) нитрования и сульфирования; г) галоидирования?
7.В каких условиях можно получить о-, м-, п-нитроанилины?
8.Какие реакции являются качественными на амины ароматического
ряда?
9.Почему продукты реакции взаимодействия первичных аминов алифатического и ароматического рядов с HNО2 отличаются?
10.В чём проявляется сходство и отличие в реакциях окисления первичных аминов алифатического и ароматического рядов?
11.Почему анилин имеет большое практическое значение? Приведите примеры.
12.Какие реакции лежат в основе промышленного получения анилина?
13.Почему анилин является токсичным веществом? Распространяется ли это на продукты его реакций (медикаменты, красители и др.)?
Задачи
I. Строение, изомерия и номенклатура
1. Напишите структурные формулы соединений. Отметьте первичные, вторичные и третичные амины: а) анилин, дифениламин; б) N,N-диметил- анилин, бензиламин; в) фенилбензиламин, ди-о-толиламин; г) о-фенилен- диамин, N,N-диэтил-п-толуидин; д) β-фенилэтиламин, м-толуидин; е) м-фенилендиамин, п-бромацетанилид; ж) о-анизидин, п-нитрозо-N,N- диметиланилин; з) м-нитро-N-метиланилин, ди-п-толиламин; и) N-бензил- N-этиланилин, симм-N,N-диметил-п-фенилендиамин; к) о-хлор-п-фенилен- диамин, дифенилметиламин; л) фенилди-(п-толил)амин, N-этил-м-бром- анилин; м) N,N-дибензил-п-изопропиланилин; β-нафтиламин.
2. Приведите структурные формулы веществ, изомерных: а) N-метил- анилину; б) N-этиланилину; в) N-пропиланилину; г) N,N-диметиланилину; д) N,N-диэтиланилину; е) ацетанилиду; ж) N-втор-бутиланилину; з) метилдифениламину; и) амиду фенилуксусной кислоты; к) бензиламину; л) метилбензиламину; м) N-формиланилину.
II. Химические свойства и способы получения
3. Расположите в ряд по убыванию кислотных свойств следующие амины: о-толуидин, о-анизидин, 2,4,6-триброманилин, п-фенилендиамин, п-фенетидин, 2,4-динитроанилин, N-этиланилин, трифениламин.
140
4.Расположите соединения в каждой группе по возрастанию основности. Ответ аргументируйте: а) анилин, бензиламин, N,N-диметиланилин; б) п-хлоранилин, анилин, п-толуидин, п-нитроанилин; в) N-метиланилин, дифениламин, фенилбензиламин; г) N,N-диметиланилин, метилдифениламин, трифениламин; д) анилин, п-нитроанилин, N,N-диметиланилин, п-метиланилин; е) п-толуидин, анилин, аммиак, п-нитроанилин; ж) 2,4,6- тринитроанилин, пиперидин, п-аминобензойная кислота; з) циклогексиламин, бензиламин, анилин; и) п-толуидин, бензиламин, дифениламин; к) аммиак, п-нитрозоанилин, N-метил-N-нитрозоанилин.
5.Расположите следующие соединения в порядке ослабления основных свойств: п-толуидин, п-нитроанилин, анилин, дифениламин, бензиламин.
6.Рассмотрите строение хлорида анилиния. Охарактеризуйте влияние аммониевой группы на распределение π-электронной плотности в бензольном кольце. Почему нитрогруппа обладает отрицательным мезомерным эффектом, а у аммониевой группы мезомерный эффект отсутствует вообще?
7.Напишите схемы реакций: а) анилина с бромоводородной кислотой; б) п-толуидина с серной кислотой; в) N-метиланилина с соляной кислотой. Назовите продукты. Как из солей снова получить амины? Приведите уравнения реакций.
8.Как реагируют с азотистой кислотой: а) п-толуидин; б) бензиламин;
в) |
N-метиланилин; |
в) N,N-диметиланилин г) анилин; д) |
бензидин; |
е) |
м-толуидин; ж) |
N-изопропиланилин; з) п-фенилендиамин. |
Приведите |
механизмы реакций. Назовите все вещества.
9.Напишите уравнения реакций п-броманилина со следующими реагентами: а) НВr; б) СН3Вr; в) HNO2; г) (СН3СО)2O; д) С6Н5СНО; е) СНСl3,
вприсутствии щёлочи и при нагревании. Назовите продукты реакций.
10.Напишите уравнения реакций и назовите продукты: а) N,N-ди- метиланилин + серная кислота на холоду; п-хлоранилин + нитрит натрия + соляная кислота; анилин + 3 моль брома (НОН);
б) N-этиланилин + иодметан при нагревании; п-толуидин + этаноилхлорид; бензиламин + нитрит натрия (HCl);
в) анилин + хлороформ + щёлочь; п-метоксианилин + СН2=СН-CH2Cl; фенилендиамин + 2 моль уксусного ангидрида;
г) бензиламин + NaNO2, HCl; анилин + хлорангидрид уксусной кислоты, а затем гидролиз водной H2SO4; п-толуидин + H2SO4 (холод);
д) ацетанилид + HNO3 + H2SO4; м-толуидин + Br2 / H2O; метилирование анилина (по аминогруппе);
е) бромирование ацетанилида; нитробензол + Sn + HCl; п-толуидин + уксусный ангидрид; фенилендиамин + 2 моль HCl (р-р);
141
ж) бромирование анилина; 1-нафтиламина с хлористым бензоилом; о-толуидина с уксусным альдегидом;
з) п-нитроанилина с соляной кислотой (холод); α-фенилэтиламина с азотистой кислотой; бензонитрила с алюмогидридом лития;
и) дифениламина с HCl (холод); восстановление п-нитрозо-N,N-ди- метиланилина; бензидина с избытком соляной кислоты;
к) восстановление п-нитроэтилбензола цинком в гидроксиде натрия; бензидина с избытоком уксусного ангидрида; N-метиланилина с соляной кислотой (холод);
л) N-этиланилина с азотистой кислотой; метилирование (по кольцу) ацетанилида; дифениламина с амидом натрия (в жидком аммиаке);
м) м-толуидина с бензальдегидом; N,N-диэтиланилина с иодистым метилом; п-бромацетанилид + фенилмагнийиодид, затем обработка водой.
11. Опишите химические свойства анестезирующего вещества дикаина, имеющего строение:
СH3CH2CH2CH2-HN-C6H4-C(O)-OCH2CH2-N(CH3)2.HCl.
12.Напишите схемы получения анилина из следующих соединений: а) нитробензола; б) хлорбензола; в) бензамида; г) фенилгидроксиламина. Укажите условия протекания реакций.
13.Составьте схемы получения: а) бензиламина из толуола; б) N,N-ди-
метиланилина из анилина; в) п-толуидина из п-толуиловой кислоты; г) м-нитроанилина из нитробензола; д) 2,4-динитроанилина из хлорбензо-
ла; е) иодида триметилфениламмония из бензола. |
|
|||
14. Напишите |
схемы получения |
из |
анилина: |
а) п-броманилина; |
б) п-нитроанилина; |
в) сульфаниловой кислоты; г) |
2,6-диброманилина; |
||
д) п-нитрозо-N,N-диметиланилина; |
е) |
м-нитро-N,N-диметиланилина; |
||
ж) дифениламина. |
|
|
|
|
15.Напишите схемы получения всех изомерных фенилендиаминов из бензола.
16.Из бензола получите иодид триэтилфениламмония. Какое вещество образуется при действии на него гидроксида диамминсеребра?
17. Используя в качестве исходного вещества бензол, получите: а) 3-броманилин; б) 2,6-диброманилин.
18.Из бензола получите м- и п-толуидины и напишите для них уравнения реакций взаимодействия с хлористым ацетилом без катализатора и в присутствии катализатора, щавелевой кислотой, хлороформом в присутствии спиртового раствора щёлочи.
19.Используя бензальдегид и малоновый эфир, получите β-фенилэтил-
амин.
20.Объясните, почему бромирование анилина даёт 2,4,6-трибром- анилин, в то время как нитрование анилина смесью кислот приводит к образованию м-нитроанилина?
142
21.Сравните условия бромирования анилина, ацетанилида, бензола. Объясните наблюдаемые различия. Запишите уравнения всех реакций и подробно рассмотрите механизм для ацетанилида.
22.Расположите бензол, анилин и ацетанилид в порядке увеличения их
активности в реакциях в SE2-реакциях. Ответ аргументируйте на основании статического и динамического факторов. Сравните условия нитрования этих соединений. Рассмотрите механизм нитрования ацетанилида.
23.Ориентантом какого рода является аминогруппа в нейтральной и кислой средах? Приведите примеры реакций электрофильного замещения для о-толуидина. Как влияет ацилирование аминогруппы на направленность и скорость реакций электрофильного замещения?
24.Приведите уравнения реакций, с помощью которых можно разделить следующие смеси: а) анилин и нитробензол; б) п-толуидин и N-метиланилин; в) анилин и бензиламин.
25.Приведите уравнения реакций, с помощью которых можно различить: а) анилин и нитробензол; б) анилин и бензиламин; в) п-толуидин и N-метиланилин; г) анилин и ацетанилид; д) N-метиланилин и N,N-ди- метиланилин; е) N-этиланилин, п-толуидин, бензиламин, диэтиланилин?
26.Почему при бромировании диметиланилина в уксусной кислоте получается 4-бром-N,N-диметиланилин, а в присутствии бромида железа
(III)– 3- бромдиметиланилин? Приведите уравнения реакций.
27.Осуществите превращения, назовите все вещества по номенклатуре
IUPAC:
143
III. Задания по синтезу веществ
28.Из толуидина получите п-ацетаминобензойную кислоту.
29.Из бензола и неорганических реагентов получите сульфаниловую кислоту, а из неё белый стрептоцид (амид сульфаниловой кислоты).
30. Осуществите превращения: а) толуол → 2,4-диаминотолуол; б) хлорбензол → 2,4-динитроанилин; в) нитробензол → п-аминофенол; г) нитробензол → п-фенилендиамин; д) толуол → п-аминобензойная кислота; е) бензолсульфокислота → м-аминофенол; ж) анилин → фенилбензиламин; з) бензол → 4-амино-3-бромтолуол; и) бензол → п-нитробензил- амин; к) бензол → п-аминоизопропилбензол.
IV. Определение строения соединений
31.Определите строение вещества состава C7H9N, образующего с азотистой кислотой соединение состава C7H8ON2, которое под воздействием минеральной кислоты претерпевает изомеризацию.
32.Определите строение вещества состава C8H11N, которое с азотистой кислотой образует спирт C8H10O, при окислении последнего образуется о-фталевая кислота.
33.Определите строение вещества состава C10H15N, образующего при действии азотистой кислотой соединение C10H14N2O, которое при взаимодействии с КОН даёт диэтиламин.
34.Определите строение вещества C7H9N, которое растворяется в кислотах и образует в соответствующих условиях диазосоединение. Замена в последнем диазогруппы на нитрильную группу и последующий гидролиз приводит к образованию о-толуиловой кислоты.
35.Вещество C8H11N растворяется в кислотах, реагирует с HNO2 c образованием продукта С8H10N2O, который при нагревании со щелочами разлагается с образованием диметиламина и п-нитрозофенола. Установите строение вещества C8H11N.
36.Установите строение вещества состава С8H11N, обладающего ярко выраженным основным характером и дающего при действии HNO2 нейтральное соединение С8Н10О. Окисление последнего приводит к м-фталевой кислоте.
144
37.Установите строение вещества С9Н11NO, которое не реагирует с разбавленными минеральными кислотами, но окисляется кислым раство-
ром перманганата калия до вещества состава C9H9NO3; последнее после щелочного гидролиза и подкисления уксусной кислотой даёт п-амино- бензойную кислоту.
38.Установите строение вещества состава С6H7NO, если оно: а) реагирует с соляной кислотой; б) реагирует со щёлочью; в) при окислении даёт хинонмоноимин.
39.Определите строение вещества состава C6H8N2, которое при взаимодействии с глиоксалем образует хиноксалин, а при взаимодействии с уксусной кислотой даёт производные бензимидазола.
40.Установите структурную формулу ароматического соединения
C7H9N, которое образует соли с минеральными кислотами и даёт изонитрильную реакцию. Продукт его взаимодействия с азотистой кислотой при добавлении щелочного раствора β-нафтола образует красный осадок. Искомое соединение бромируется бромной водой с образованием трибромпроизводного.
41.Установите строение ароматического соединения состава C8H9NО, которое под наванием «антифебрин» применялось как жаропонижающее средство. Это соединение обладает следующими свойствами: а) не образует солей с минеральными кислотами; б) гидролизуется в щелочной среде с
образованием ацетата натрия и соединения C6H7N. Последнее малорастворимо в воде, но растворяется в соляной кислоте; при действии азотистой кислоты образует соль диазония.
42.Определите строение оптически активного соединения состава
C9H13N, которое обладает следующими свойствами: а) горит коптящим пламенем; б) растворяется в соляной кислоте; в) ацилируется уксусным ангидридом; г) даёт изонитрильную реакцию; д) при действии азотистой
кислоты превращается в соединение С9Н12О. Окисление последнего приводит к образованию бензолдикарбоновой кислоты с согласованной ориентацией заместителей в SE2-реакциях.
Тема 22. Азо- и диазосоединения
Контрольные вопросы
1.В чём сходство и различие в строении диазо- и азосоединений?
2.Какие диазотирующие агенты участвуют в процессе диазотирования аминов? Сравните их реакционную способность.
3.Чем отличаются промежуточные продукты реакций диазотирования анилина различными диазотирующими частицами?
4.Чем обусловлена стереоизомерия диазо- и азосоединений? Приведите примеры.
145
5.Какие условия необходимы для перехода диазогруппы в ониевый ион? Какие предельные структуры возможны для диазониевого иона?
6.Почему диазосоединения ароматического ряда стабильнее диазосоединений жирного ряда?
7.Какие вещества можно получить из солей диазония в реакциях, протекающих: а) с выделением азота; б) без выделения азота? Приведите уравнения реакций.
8.Какие продукты образуются: а) при окислении; б) при восстановлении солей диазония?
9.Какие реакции используются для получения азокрасителей? Что называют диазо- и азосоставляющими? Как можно по формуле красителя предложить схему его синтеза?
10.Чем обусловлено возникновение цвета вещества? Какие частицы называют хромофорными группами? Какую роль играют ауксохромные группы? Что понимают под хромогеном?
11.Почему химия красителей в промышленности имела название «анилинокрасочная промышленность»?
12.Почему производство красителей является вредным для здоровья человека? Какие меры защиты необходимы в технологическом процессе получения красителей?
13.Почему красители, по сравнению с исходными веществами, используемыми для их получения, являются практически инертными веществами и могут быть использованы в красильной промышленности?
14.Все ли красители безвредны для человека?
Задачи
I.Строение, получение и реакционная способность. Реакции диазосоединений
свыделением азота
1.Сопоставьте строение фенилдиазонийхлорида с циклогексилдиазонийхлоридом и объясните причину относительной устойчивости первой соли в водных растворах при низкой температуре и быстрое разложение с выделением азота второй в этих же условиях.
2.Опишите строение катиона фенилдиазоний методом резонанса. Предскажите влияние заместителей в бензольном кольце на термодинамическую стабильность этого катиона.
3.Напишите структурные формулы соединений: а) п-толилдиазоний- хлорида; б) о-бромфенилдиазонийбромида; в) гидросульфата п-метокси- фенилдиазония. Расположите катионы этих солей в порядке возрастания их термодинамической стабильности.
4.Напишите структурные формулы соединений: а) син-фенил- диазотата натрия; б) борфторида о-хлорфенилдиазония; в) N-нитрозо-п-
146
броманилина; г) анти-п-метоксифенилдиазотата калия; д) гидроксида м- нитрофенилдиазония; е) п-фторфенилдиазокислоты; ж) п-бромфенил- диазоацетата; з) м-толилдиазосульфоната натрия.
5.Какую реакцию называют диазотированием? В каких условиях она проводится? Напишите структурные формулы диазотирующих агентов, образующихся при взаимодействии азотистой кислоты с соляной, бромоводородной и серной кислотами. Расположите эти агенты в порядке возрастания их реакционной способности.
6.Охарактеризуйте влияние заместителей в кольце первичного ароматического амина на константу скорости диазотирования. Расположите амины в порядке возрастания их реакционной способности: анилин; п- броманилин; п-толуидин; м-метоксианилин; 2,4,6-тринитроанилин.
7.Напишите уравнения реакций п-толилдиазонийхлорида с указанными ниже реагентами (при 0° С). Назовите соединения. Реагенты: a) NaOH,
визбытке; б) CH3COONa; в) NaCN; г) Na2SО3; д) NaBF4.
8.Как протекает разложение п-нитрофенилдиазонийхлорида в присутствии следующих соединений: a) CuCl; б) CuBr; в) CuCN; г) KI?
9.Назовите соединения, образующиеся при нагревании водного раствора о-толилдиазонийхлорида в присутствии следующих соединений:
а) CH3OH; б) KI; в) Cu2Cl2; г) Cu2Br2; д) Cu2(CN)2; е) Н3РO2; ж) CH3COOH, C2H5OH; з) нагревание.
10. На примере п-бромфенилдиазонийхлорида покажите, как можно осуществить замену диазониевой группы на следующие группы: а) Н;
б) ОН; в) ОС2Н5; г) Cl; д) Вr; е) I; ж) F; з) СN; и) SH; к) N3; л) NO2;
м) HgCl. Напишите уравнения реакций.
11.Назовите соединения, образующиеся при восстановлении солей диазония в указанных условиях: а) фенилдиазонийхлорид + хлорид олова
(II)+ HCl; б) гидросульфат п-толилдиазония + сульфит натрия + вода; в) м-бромфенилдиазонийхлорид + цинк + уксусная кислота. Напишите уравнения реакций.
12.Дайте определение понятия «реакция диазотирования». Какие из указанных соединений могут диазотироваться и почему? При какой температуре и почему проводится эта реакция? Напишите уравнения реакций. а) п-Толуидин; бензиламин; м-динитробензол; м-нитроанилин; б) N- метиланилин; п-хлоранилин; п-нитрофенол; п-нитроанилин; в) п-бром- анилин; N,N-диметиланилин; бензойная кислота; п-этиланилин; г) о- толуидин; пропиламин; п-аминофенол; фенилнитрометан; д) п-амино- бензиламин; м-хлорбензойная кислота; бензолсульфокислота; сульфани-
ловая кислота; е) анилин; бензиламин; пропиламин; п-броманилин; ж) бензолсульфокислота; п-толуидин; м-нитроанилин; метиламин.
13. Приведите схемы получения и механизм реакции получения солей диазония: а) п-толилдиазонийхлорида; б) п-сульфофенилдиазонийхлорида;
147

в) гидросульфата 2,4,6-трихлорфенилдиазония; г) иодида фенилдиазония; д) 3,5-динитрофенилдиазонийбромида; е) перхлората п-оксифенил- диазония; ж) дихлорида п-фенилиендиазония; з) β-нафтилдиазоний- бромида; и) α-нафтилдиазонийиодида; к) гидросульфата дифенил-4-ди- азония; л) п-хлорфенилдиазонийхлорида; л) м-толилдиазонийбромида; м) хлорид м-изопропилфенилдиазония.
14.Сравните особенности взаимодействия азотистой кислоты с анилином и бензиламином при 0–5 ° С. Представьте механизм обоих превращений. Почему результат реакций различен?
15.Сопоставьте условия и механизмы взаимодействия первичных алифатических и ароматических аминов с азотистой кислотой. Почему только
вслучае первичных ароматических аминов продуктами реакции являются более стабильные соли диазония? Ответ поясните на примерах реакций с изобутиламином и анилином.
16.На примере реакции диазотирования п-броманилина в соляной кислоте поясните, почему для протекания этой реакции необходим избыток минеральной кислоты. Представьте механизм реакции. Какие нитрозирующие реагенты может образовать азотистая кислота в соляной кислоте?
17.На примере реакции диазотирования о-толуидина поясните роль минеральной кислоты в этом процессе. Какая ошибка была допущена при проведении диазотирования о-толуидина, если вместо прозрачного раствора соли диазония был получен осадок жёлтого цвета? Укажите структурную формулу этого соединения.
18.Запишите уравнение и подробно рассмотрите механизм диазотирования о-толуидина в разбавленной соляной кислоте при 0–5° С. Объясните, почему 2,4-динитроанилин в этих условиях диазотируется очень медленно. Предложите условия реакции, в которых 2,4-динитро- анилин диазотируется с достаточно высокой скоростью. Выбор условий обоснуйте.
19.При какой температуре и почему проводят реакцию диазотирования? Что может произойти с фенилдиазонийхлоридом, если к его раствору добавить иодид калия и смесь оставить на несколько часов при комнатной температуре?
20.Запишите уравнение и подробно рассмотрите механизм взаимодействия м-нитрофенилдиазонийхлорида с иодидом калия. Образование какого побочного продукта не удаётся предотвратить при осуществлении этой реакции? Почему?
21.Осуществите превращения. Назовите конечные продукты по номенклатуре IUPAC:
148
22.Вещество C7H9N при диазотировании, последующем нагревании в присутствии CuCN и гидролизе даёт карбоновую кислоту, которая при мононитровании образует один изомер. Установите строение вещества.
23.Установите строение соединения C7H10N2, которое при действии HNO2 и последующем нагревании с CuBr дает п-бромбензиловый спирт.
24.Вещество состава C12H9BrN2O обладает ярко-жёлтым цветом, растворяется в щелочах, а при восстановлении (SnCl2 + HCl) превращается в п-броманилин и п-аминофенол. Установите его строение.
25.Установите структуру дихлоранилина C6H3Cl2NH2, при дезаминировании которого получается п-дихлорбензол. При диазотировании исходного соединения и последующем нагревании водного раствора полученного диазосоединения образуется 2,5-дихлорфенол.
26.Напишите структурную формулу бромхлорнитробензола, при восстановлении которого и последующем дезаминировании получается п-хлорбромбензол. При нагревании исходного соединения со спиртовым раствором КОН образуется 2-нитро-4-хлорфенол.
27.Установите структуру соединения С6Н5N2Cl, если известно, что при взаимодействии с этанолом оно даёт вещество С8Н10О и выделяет молекулярный азот.
28.Определите структуру соединения состава C6H6N2O2, если оно реагирует с иодом в присутствии Н2О2 с образованием соединения C6H4I2N2O2, последнее при обработке NaNO2 (HCl), а затем КI даёт 1,2,3- трииод-5-нитробензол.
29.Установите структуру соединения C6H3O4N2Br3S, если оно может быть получено из 2,4,6-триброманилина, а при взаимодействии с Н3РО2 оно даёт 1,3,5-трибромбензол.
30.Установите структурную формулу бензедрина C9H13N, относящегося к важному классу лекарственных веществ, возбуждающих нервную систему, снимающих усталость и повышающих работоспособность. Это соединение обладает следующими свойствами: а) образует соли при взаимодействии с минеральными кислотами; б) существует в виде энантиомеров; в) даёт изонитрильную реакцию; г) при окислении превращается в бензойную кислоту; д) при взаимодействии с азотистой кислотой образу-
ют соединение С9Н12О, не содержащее функциональную группу в бензильном положении.
149
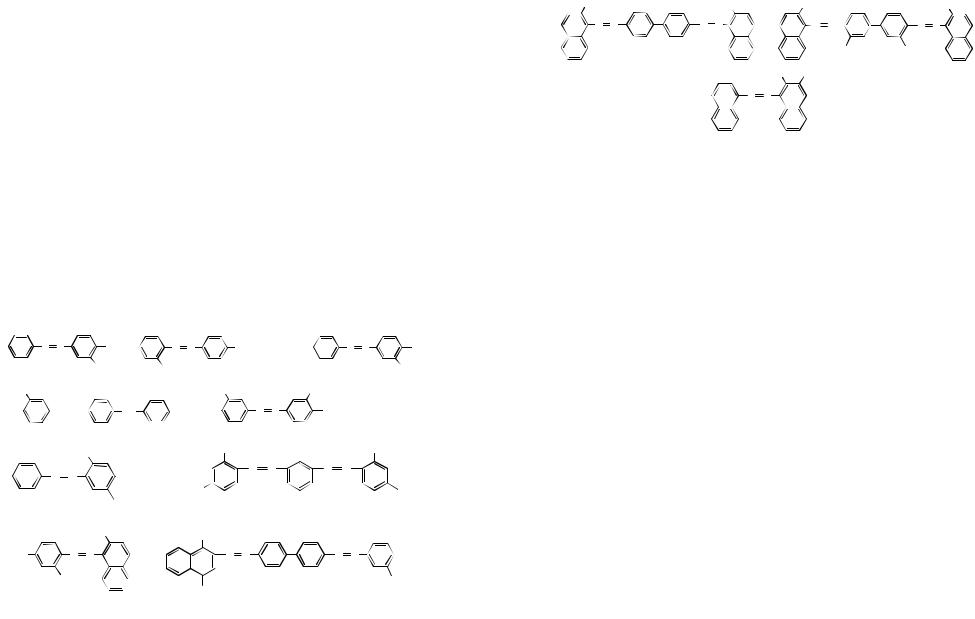
II. Реакции азосочетания (реакции диазосоединений без выделения азота)
31. Напишите уравнения реакций азосочетания и назовите образущиеся продукты. Подробно рассмотрите механизм реакции:
|
Диазосоставляющая |
Азосоставляющая |
а |
п-нитроанилин |
фенол |
б |
анилин |
N,N-диметиланилин |
в |
анилин |
п-крезол |
г |
о-толуидин |
анилин |
д |
анилин |
п-толуидин |
е |
сульфаниловая кислота |
диметиланилин |
ж |
антраниловая кислота |
салициловая кислота |
з |
о-толуидин |
резорцин |
и |
п-нитроанилин |
салициловая кислота |
к |
о-толуидин |
п-крезол |
л |
м-хлоранилин |
N,N-диметиланилин |
м |
м-фенилендиамин |
α-амино-β-нафтол |
32. Из каких соединений в результате диазотирования и азосочетания были получены следующие азокрасители? Назовите их, напишите уравнения реакций:
150
33.При взаимодействии фенилдиазонийхлорида в слабощелочной среде с анилином образуется диазоаминобензол. Какие соединения образуются, если анилин заменить: а) N-метиланилином; б) н-бутиламином; в) N,N- диметиланилином.
34.Охарактеризуйте влияние заместителей в бензольном кольце диазосоединения на скорость азосочетания. Расположите приведённые катионы
впорядке возрастания их реакционной способности при взаимодействии с фенолом: а) п-метоксифенилдиазоний; б) п-сульфодиазоний; в) п-нитро- фенилдиазоний; г) м-толилдиазоний; д) фенилдиазоний. Приведите механизм реакции азосочетания.
35.Запишите структурные формулы диазоний-катионов, образующихся при диазотировании следующих аминов: анилина, о-толуидина, п-нитроанилина. Расположите эти катионы в порядке уменьшения их активности в реакции с о-бромфенолом. Представьте на примере одного из диазоний-катионов уравнение и механизм взаимодействия.
36.Приведите структурные формулы следующих диазоний-катионов: фенилдиазоний, п-хлорфенилдиазоний, м-нитрофенилдиазоний, 2,4-ди- нитрофенилдиазоний. Какой из них и почему будет реагировать с наибольшей скоростью с o-бром-N,N-диметиланилином? Запишите уравнение и подробно рассмотрите механизм этой реакции.
37.Составьте схему синтеза азокрасителя исходя из п-толуидина и о-нитрофенола. Какое из этих веществ называется соответственно диазо- и азосоставляющей? Представьте механизм последней стадии синтеза. Укажите, при какой температуре и в какой среде следует проводить эту реакцию. Почему?
38.Составьте схему синтеза азокрасителя исходя из 2,4-динитро- анилина и п-метилфенола. Какое из этих веществ называется соответственно диазо- и азосоставляющей? Представьте механизм последней стадии синтеза. Укажите, при какой температуре и в какой среде следует проводить эту реакцию. Почему?
39.Установите, какую диазо- и азосоставляющую необходимо использовать для получения п-гидрокси-п'-хлоразобензола. Представьте уравне-
151
ния реакций его получения и рассмотрите механизм стадии азосочетания. Поясните значение рН среды для этой стадии.
40. Установите, какую диазо- и азосоставляющую необходимо использовать для получения 4-N,N-диметиламино-4'-сульфоазобензола, широко используемого в аналитической практике в качестве индикатора под названием «метилоранж». Составьте уравнения реакций. Представьте механизм стадии азосочетания. Поясните значение рН среды для этой стадии.
41. Какие из следующих соединений: а) N,N-диметиланилин; б) о-нитротолуол; в) п-хлорфенол – будут вступать в реакцию с диазотированным п-броманилином? Почему? Запишите уравнения реакций, представьте их механизм, укажите рН среды. Осуществите восстановительное расщепление полученных азокрасителей.
42.Запишите уравнения реакций взаимодействия о-гидрокси- бензойной кислоты: а) с диазотированным п-нитроанилином; б) с диазотированным п-аминофенолом. Скорость какой реакции будет выше? Почему? В какой среде и при какой температуре следует проводить реакции (а) и (б)? Почему?
43.Если относительная скорость азосочетания диазотированного анилина с фенолом принять равной 1, то скорость азосочетания диазотированных п-нитро-, п-сульфо-, п-бром-, п-метил- и п-метоксианилинов равны соответственно 1300, 13, 13, 0,4 и 0,1. Объясните эти экспериментальные факты. Приведите уравнение и рассмотрите механизм одной из этих реакций, укажите температуру и рН среды.
44.В каких условиях и почему необходимо проводить реакцию азосочетания фенилдиазонийгидросульфата с аминофенолом, чтобы получить: а) 5-амино-2-гидроксиазобензол; б) 2-амино-5-гидроксиазобензол? Запишите уравнения реакций.
III. Задания по синтезу веществ
45. Приведите схемы синтеза из п-нитроанилина: а) п-нитрофенола; б) п-нитрохлорбензола; в) п-нитробензойной кислоты; г) п-фторанилина; д) п-метоксифенола.
46. |
Получите |
из бензола, используя реакцию |
диазотирования: |
а) м-бромхлорбензол; б) 1,3,4-трихлорбензол; в) м-толуидин. |
|||
47. |
Приведите |
схемы синтеза: а) о-крезола из |
о-нитротолуола; |
б) м-нитроанизола из м-нитроанилина; в) о-хлорбензойной кислоты из о-толуидина; г) м-хлориодбензола из нитробензола; д) 1,2,4-трихлор- бензола из п-нитрохлорбензола; е) терефталевой кислоты из п-толуидина.
48. Получите из анилина: а) м-бромфенол, б) бензойную кислоту, в) салициловую кислоту, г) п-метоксииодбензол.
152
49.Получите из п-толуидина: а) о-фталевую кислоту, б) 3-бром- бензойную кислоту, в) 4-гидроксибензойную кислоту, г) 4-иодбензойную кислоту.
50.Получите из 4-хлор-3-нитроанилина: а) 3-амино-4-хлорбензойную кислоту, б) п-хлорбензойную кислоту, в) 3-амино-6-хлорбензойную кислоту.
51. Получите следующие азосоединения: а) 2,2΄-дихлоразобензол; б) 4-(п-бромфенилазо)-2-нитробензенол; в) 5-(п-нитрофенилазо)-2-ди- метиламинобензолсульфокислоту; г) метиловый оранжевый; д) п-нитро- анилиновый красный; е) β-нафтолоранж.
52. Используя реакцию диазотирования, осуществите следующие синтезы: а) из м-нитроанилина м-броманилин и м-нитробензойую кислоту, из бензола м-нитрофенол; б) из п-толуидина п-фтортолуол и п-метилфенол, из бензола п-иодбензойную кислоту; в) из о-толуидина о-хлортолуол и о-метокситолуол, из бензола о-фторфенол; г) из о-толуидина о-иодтолуол и бензойную кислоту, из бензола п-метоксианилин; д) из м-нитроанилина нитробензол и м-динитробензойную кислоту, из бензола п-иодфенол.
МОДУЛЬ 5. ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
Тема 23. Пятичленные гетероциклы
Контрольные вопросы
1.Какие соединения называют гетероциклическими? Приведите схему классификации гетероциклов. Какие гетероатомы могут входить в состав циклов?
2.Почему фуран, пиррол и тиофен можно отнести к ароматическим соединениям?
3.В чём сходство и отличие в строении названных гетероциклов с бензолом?
4.Почему можно сравнивать пиррол, фуран и тиофен с анилином, фенолом и другими производными бензола, содержащими электронодонорные заместители?
5.Почему в реакциях SE2 ориентация реагентов в пятичленных гетероциклах происходит в α-положение, а для тиофена возможна также β-положение?
6.Почему пиррол и фуран проявляют ацидофобные свойства? В каких реакциях следует учитывать ацидофобность?
7.Почему тиофен устойчив к разрушению цикла?
8.У каких гетероциклов ярко выражен диеновый характер? Как это можно объяснить?
9.Сравните реакционную способность в реакциях SE2 пиррола, фурана, тиофена, бензола и нафталина.
153
10.Почему пиррол обладает кислотными свойствами? Сравните кислотные и основные свойства пиррола, аммиака и анилина.
11.В состав каких природных соединений входят пятичленные гетероциклы? Какова их биологическая роль?
12.Назовите основные области применения пятичленных гетероциклов. Какие методы получения гетероциклов вы знаете? Составьте схемы реакций.
Задачи
I. Строение, изомерия и номенклатура
1. Напишите структурные формулы: а) α-метилфурана, β,β-диметил- фурана; б) 2-бром-4-метилфурана, тетрагидрофурана (THF); в) фурфурола, тетрагидропиррола (пирролидина); г) 5-нитрофурфурола, N-метил-α,β-ди- этилпиррола; е) 2-карбоксипиррола, хлорида N-метилпирролидиния; ж) α-тиофенсульфокислоты, 3,5-диметилфуран-2-карбоновой кислоты; з) α-ацетилтиофена, фуран-2-карбоновая кислота (пирослизевой кислоты); и) бензофурана, тетрагидротиофена; к) бензотиофена, 3-фурилакриловой кислоты; л) индола, 2-(4-имидазолил)этиламина; м) 2,5-диметилтиофена, оксима фурфурола.
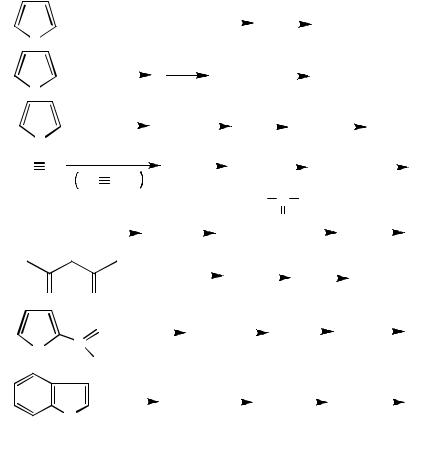
2. Назовите следующие соединения:
 N
N
ж) N |
; з) |
N |
; и) O ; к) N |
; л) |
O ; м) |
S . |
H |
|
H |
H |
|
|
|
3. Составьте структурные формулы всех возможных изомеров перечисленных ниже соединений, назовите их: а) метилфуран, б) диметилтиофен, в) метоксифуран, г) метилпиррол, д) диметилфуран, е) диметилпиррол, ж) метилимидазол, з) этилимидазол, и) этоксиимидазол, к) ацетилпиррол, л) диметилпирролин, м) диметилпирролидин.
II. Химические свойства и способы получения. Механизм SE-реакций
4.Охарактеризуйте отношение: а) фурана, б) тиофена и в) пиррола к электрофильным реагентам. Приведите механизмы реакций, доказывающие ориентацию реагента.
5.Какими структурными особенностями обусловлен ароматический характер: а) фурана, б) тиофена, в) пиррола? Сопоставьте ароматичность пятичленных гетероциклов и бензола.
154
6.Фуран, пиррол и тиофен в реакцию электрофильного замещения вступают легче, чем бензол, но фуран и пиррол требуют использования мягких реагентов (но не тиофен). Объясните эти факты.
7.Напишите реакции: а) нитрования фурана; б) сульфирования пиррола; в) ацетилирования тиофена. Действием каких реагентов и в каких условиях можно провести эти реакции?
8.Как очистить технический бензол от тиофена?
9.Используя предельные структуры, предскажите ориентацию в реак-
циях SE2 для приведённых ниже гетероциклических соединений. а) α- Метилпиррола, б) α-метилфурана, в) β-метилпиррола, г) β-метилфурана; д) α-нитропиррола, е) α-нитрофурана, ж) фуран-β-карбоновой кислоты,
з) пиррол-α-карбоновой кислоты, и) α-бромпиррола, к) β-бромфурана, л) фурфурола. На основании полученных вами выводов, напишите уравнения реакций взаимодействия со следующими веществами: 1) бромом, 2) хлором, 3) иодом (в избытке, в присутствии иодида калия), 4) ацетилнитратом, 5) пиридинсульфотриоксидом, 6) уксусным ангидридом (в присутствии BF3 в эфире), 7) бензоилхлоридом (в присутствии четырёххлористого олова), 8) п-нитрофенилдиазонийхлоридом, 9) хлоридом ртути (II), затем бромом, 10) хлороформом в щелочной среде (реакция Реймера– Тимана).
10.Напишите уравнения реакций взаимодействия α-метилтиофена со следующими веществами: а) бромом и хлором, б) азотной кислотой (конц.), в) серной кислотой (конц.), г) перманганатом калия в кислой среде. Для реакций а), б), в) рассмотрите механизм.
11.У какого соединения ярче выражен диеновый характер: фурана, пиррола или тиофена? Напишите для него уравнения реакций присоединения брома и хлора, уравнение реакции Дильса– Альдера с малеиновым ангидридом.
12.2,5-Диметилфуран по некоторым свойствам имеет сходство с эфирами винилового спирта. Так, например, при нагревании с разбавленной соляной кислотой он гидролизуется с образованием гександиона-2,5. Напишите уравнение названной реакции.
13.Приведите реакции пиррола: а) с иодидом метилмагния; б) с амидом натрия, затем с иодметаном, затем нагревание; в) с иодидом этилмагния, затем с диоксидом углерода; г) с иодидом метилмагния, затем с хлорангидридом уксусной кислоты, затем нагревание. Назовите промежуточные и конечные продукты превращений.
14.Сравните отношение пиррола и индола к электрофильным реагентам. Объясните причину имеющихся различий. Напишите реакции индола со следующими реагентами: а) пиридинсульфотриоксидом, б) уксусным ангидридом, в) НСНО + NН(СН3)2.
155
15. |
Напишите для индола уравнения реакций хлорирования, сульфиро- |
29. Установите структуру вещества С5H5SCl, если известно, что оно |
||||||||||||||||||||||||||||||||||||||||||||||||
вания, нитрования. Укажите условия протекания реакций. |
|
может быть получено при взаимодействии тиофена с формальдегидом в |
||||||||||||||||||||||||||||||||||||||||||||||||
16. |
Напишите уравнения реакций, необходимых для получения индок- |
присутствии НСl. |
||||||||||||||||||||||||||||||||||||||||||||||||
сила из анилина и окиси этилена. Укажите его применение. |
30. Установите структуру вещества С4Н8О, которое может быть полу- |
|||||||||||||||||||||||||||||||||||||||||||||||||
17. |
Для фурфурола напишите реакции: а) окисления; б) восстановле- |
чено из фурана. Дегидратация вещества С4Н8О в присутствии катализато- |
||||||||||||||||||||||||||||||||||||||||||||||||
ния; |
в) нитрования; г) фуроиновой конденсации; |
д) Канниццаро; |
ра приводит к образованию 1,3-бутадиена. |
|||||||||||||||||||||||||||||||||||||||||||||||
е) Перкина. |
|
31. Вещество С5Н4О2 дает реакцию «серебряного зеркала», при этом |
||||||||||||||||||||||||||||||||||||||||||||||||
18. |
Для 5-метил-2-фуранкарбальдегида напишите уравнения реакций |
образуется вещество С5Н4О3. Последнее используется для получения фу- |
||||||||||||||||||||||||||||||||||||||||||||||||
(для каждого случая выберите конкретный реагент): а) окисления, б) вос- |
рана. С5Н4О2 восстанавливается в присутствии CuO, Cr2O3 водородом с |
|||||||||||||||||||||||||||||||||||||||||||||||||
становления, в) конденсации – с анилином, – с концентрированным рас- |
образованием фурфурилового спирта. |
|||||||||||||||||||||||||||||||||||||||||||||||||
твором КОН, – со спиртовым раствором KCN, – с уксусным ангидридом в |
32. Осуществите следующие превращения, назовите полученные со- |
|||||||||||||||||||||||||||||||||||||||||||||||||
присутствии CH3COONa. |
|
единения: |
||||||||||||||||||||||||||||||||||||||||||||||||
19. |
Напишите схему реакции поликонденсации фурфурилового спирта. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20. |
Из тиофена получите хлорид тиенилртути, а затем последовательно |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
подействуйте бромом, магнием, диоксидом углерода, соляной кислотой. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Напишите уравнения перечисленных реакций. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
21. |
Тиофен последовательно обработали серной кислотой, водным рас- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
твором КОН, твёрдым KCN при нагревании, водой, этанолом в кислой |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
среде, азотной кислотой, цинковой пылью в уксусной кислоте, азотистой |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
кислотой и, наконец, β-нафтолом. Напишите уравнения перечисленных |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
реакций. Какими свойствами обладает полученный продукт? |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
22. |
Получите из пиррола следующие соединения: |
2-ацетилпиррол, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2-пирролкарбальдегид, 2-пиррилазобензол, β-хлорпиридин. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
23. |
На пиррол последовательно подействуйте хлорангидридом уксус- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ной кислоты в присутствии хлорида цинка, гидразином, КОН. Напишите |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
уравнения указанных реакций. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
24. |
Пиррол обработали CH3MgI. Из полученного продукта синтезиро- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
вали пирролкарбоновую кислоту. Приведите уравнения реакций, необхо- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
димых для получения названного соединения. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
25. |
Приведите: схемы получения а) фурана, б) пиррола и в) тиофена: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1) из янтарного диальдегида; 2) по Юрьеву; 3) из углеводов. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
26. |
При нагревании аммонийной соли янтарной кислоты происходит |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
замыкание цикла и образование сукцинимида, который при восстановле- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
нии цинковой пылью в уксуснокислой среде даёт пиррол. Запишите урав- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
нения реакций. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
27. |
Какое строение может иметь соединение C5H3ClO2, которое даёт |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
реакцию «серебряного зеркала», образуя С5H3ClO3. Последнее при нагре- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
вании отщепляет СО2 и даёт 2-хлорфуран. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
28. |
При сжигании образца азотсодержащего гетероциклического со- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
единения, не содержащего заместителей в кольце, образовалось 0,8 л па- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
ров воды и 0,4 л азота (н.у.). Установите возможную структуру соедине- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
ния. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
156 |
|
157 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||

 33. Приведите примеры реакций, характерных для фурана и нехарактерных для тиофена.
33. Приведите примеры реакций, характерных для фурана и нехарактерных для тиофена.
34.Фуран реагирует с бромом в метаноле с образованием 2,5-дигидро- 2,5-диметоксифурана. Для связывания выделяющегося бромистого водорода используют соду. Предложите механизм этой реакции.
35.Напишите уравнения реакций между веществами: а) 5-метил- фурфуролом и гидроксидом калия (конц. раствор) (реакция Канниццаро), б) фурфуролом и цианидом калия (бензоиновая конденсация), в) 5- метилфурфуролом и анилином; г) фурфуролом и уксусным ангидридом (в присутствии ацетата калия), д) фурфуролом и ацетоном (в присутствии метилата натрия). Рассмотрите механизм каждой реакции.
III. Задания по синтезу веществ
36.С помощью каких реакций можно фуран превратить в: а) дивинил, б) адипиновую кислоту, в) 1,4-дихлорбутан?
37.Получите индол из анилина и ацетилена.
38.Предложите схемы получения: а) фуран → 5-нитро-2-ацетилфуран; б) пиррол → метиловый эфир пиррол-2-карбоновой кислоты; в) тиофен → 5-нитротиофен-2-карбоновая кислота; г) индол → 1-метилиндол-3-сульфо- кислота; д) фурфурол → фурилакриловая кислота; е) фуран → 5-метил- фуранкарбальдегид; ж) фуран → 2-бензилфуран; з) тиофен → 2-нитро-5- бромтиофен; и) пиррол → 2-ацетилпиррол; к) пиррол → 5-метилпиррол-2- сульфокислота; л) фуран → 3-(фуран-2-ил)акриловая кислота.
39.Получите 2,5-диметилфуран из этилацетата и других необходимых реагентов.
40.Предложите метод синтеза фурилового спирта из фурана и других необходимых реагентов.
41.Исходя из тиофена получите 5-этилтиофен-2-карбоновую кислоту.
42.Предложите метод синтеза 1-(фуран-2-ил)-3-фенилпропандиона-1,3 из фурана, этанола, уксусной и бензойной кислот и любых других неорганических реагентов.
43.Из тиофена получите 2,5-диизопропилтиофен.
44.Исходя из фурфурола и других необходимых реагентов получите, используя синтез Юрьева, 1,2-диметилпиррол. Обработайте его диоксандибромидом (мягкий бромирующий агент, использующийся для реакций с ацидофобными соединениями). Какой монобромид при этом получится?
45.Предложите схему синтеза α-фурил-α-тиенилкетона:
158
используя необходимые производные фурана и тиофена.
46.Получите 1-метил-2,5-дифенилпиррол из любых необходимых реагентов.
47.Предложите метод синтеза 2-хлорметилфурана, используя любые необходимые реагенты. Подействуйте на полученное вещество магнием в абсолютном эфире, а затем ацетоном. Какой спирт получается после обработки реакционной массы водой?
Тема 24. Шестичленные гетероциклы
Контрольные вопросы
1.Почему шестичленные гетероциклы, обладающие ароматическими свойствами, не могут в качестве гетероатомов содержать атомы кислорода
исеры, как в пятичленных гетероциклах?
2.Чем обусловлены ароматические свойства шестичленных гетероциклов, содержащих один, два, три атома азота?
3.Чем отличаются предельные структуры пятичленных гетероциклов и пиридина?
4.Сравните реакционную способность пиррола, пиридина, бензола и нитробензола в реакциях электрофильного и нуклеофильного замещения.
5.Сопоставьте основные свойства пиридина, аммиака, пиррола и анилина. Дайте характеристику пиридинового атома азота в сравнении с пиррольным, аминогруппы, нитрогруппы и атомом азота молекулы азота.
6.Почему реакции SE2-типа у пиридина протекают в более жёстких условиях, чем у нитробензола?
7.Почему пиридин обнаруживает большое сходство с нитробензолом?
8.Почему шестичленные гетероциклы более устойчивы, чем пятичленные?
9.В какие биологически активные соединения входят шестичленные гетероциклы?
10.Какими свойствами могут обладать пиримидиновые и пуриновые основания?
11.Чем обусловлена высокая инертность пуриновых и пиримидиновых оснований в составе нуклеиновых кислот?
12.Какие свойства пуриновых и пиримидиновых оснований реализуются при формировании вторичной структуры нуклеиновых кислот?
159
