
А Е Щеголев Органическая химия 2016 / 09 Бензол. Ароматичность. Углеводороды ряда бензола
.pdf
и фульвен. Все эти углеводороды очень неустойчивы и легко переходят обратно в бензол.
Бензвален (или бензол Хюккеля) образуется с выходом 1% при длительном облучении жидкого бензола светом длиной волны 254 нм:
h
бензвален
Бензол Дьюара получают при быстром облучении бензола светом длиной волны 206 нм:
h
бензол Дьюара
Призман (бензол Ладенбурга*) — продукт внутримолекулярного циклоприсоединения бензола Дьюара:
h
призман
Образование фульвена можно представить следующим образом:
H |
|
h |
CH2 |
|
|
|
фульвен |
9.5.1.4. Реакции окисления
Бензол устойчив к окислителям при комнатной температуре. При действии на бензол кислорода воздуха в присутствии оксида ванадия (V) при температуре 400 С происходит разрушение бензольного кольца с образованием малеинового ангидрида. В этой реакции бензол проявляет свойства непредельных углеводородов:
|
|
|
|
|
|
|
O |
|
|
|
|
= |
|
||||
|
|
V2O5 |
CH |
|
|
C |
O + 2 CO |
|
|
|
|
|
|
||||
+ 4,5 O2 |
|
= |
|
|
|
+ 2 H O |
||
|
|
|
|
|
||||
|
|
|
CH |
C |
2 |
2 |
||
|
|
|
= |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
431

Это промышленный способ получения малеинового ангидрида.
Под действием ферментов (например, в печени кролика) бензол может окисляться в муконовую кислоту. В этой реакции происходит разрыв С=С- связи:
|
|
[O] |
COOH |
|
|
||
|
|
|
|
COOH
муконовая кислота
Озонолиз
Действие озона на бензол аналогично действию на непредельные углеводороды и приводит к образованию триозонида, который затем гидролизуется до глиоксаля:
|
|
|
|
O- |
|
|
||
|
|
|
+ 3 |
|
O |
|
|
|
|
|
|
|
|
|
|||
|
|
|
O |
+ |
|
|
||
|
|
|
|
|
|
|
||
|
|
|
H |
|
|
|
O |
|
|
|
|
|
|
= |
|
||
+ 3 H2O |
|
C |
|
|
||||
3 |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
- 3 H2O2 |
|
C |
|
|
||||
|
|
|
= |
H |
||||
|
|
|
O |
|
|
|
||
глиоксаль
O
O
H H
H
O
O
O H
O H
H
 O
O
O
 O
O
H
O
H
H
O
O H

 OO O
OO O
O H
H
O
O
H
Расщепление озонида с образованием глиоксаля может происходить также, если вместо гидролиза использовать восстановление молекулярным водородом в присутствии катализатора:
O
H
H
O
O H

 OO O
OO O
O H
H |
|
H |
C |
O |
||
O |
|
|
|
|||
|
|
H2; Pd/CaCO3 |
|
= |
||
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
C |
|
||
|
|
|
= |
H |
||
H |
|
O |
|
|
||
|
|
|
|
|
||
432

9.5.2. ХИМИЧЕСКИЕ СВОЙСТВА АРЕНОВ
Для углеводородов, содержащих в бензольном цикле алкильные заместители, химическое поведение определяется наличием как одного, так и другого структурного фрагмента. Как показано в химических свойствах бензола, для ароматического цикла характерны реакции электрофильного замещения (SE). С другой стороны, предельные или непредельные алифатические заместители проявляют свойства соответствующих предельных и непредельных углеводородов.
9.5.2.1. Реакции электрофильного замещения
Для алкилбензолов характерны те же электрофильные реакции, что и для незамещѐнного бензола. Это, прежде всего нитрование, сульфирование, галогенирование, алкилирование и ацилирование. Продуктами этих реакций могут быть различные функциональные производные аренов, в связи с чем такие реакции могут использоваться как способы получения разнообразных ароматических соединений.
Однако при рассмотрении реакций электрофильного замещения необходимо иметь в виду, что, так как алкильные группы обладают электронодонорными эффектами по отношению к бензольному кольцу, то взаимодействие таких соединений с электрофилами будет протекать легче, чем незамещѐнного бензола. Это выражается в возрастании скорости реакции и замещении, как правило, не одного, а нескольких водородных атомов кольца. Кроме того, следует иметь в виду, что в молекулах алкилбензолов электронная плотность распределена неравномерно по бензольному кольцу. Поэтому подвергаться электрофильной атаке будут атомы углерода кольца с повышенной электронной плотностью.
|
R |
|
|
|
|
|
R |
|
|
|
|
|
|
R |
H |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
E |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
+ E |
|
|
|
|
|
|
|
|
|
E |
|
|
|
|
|
|
+ |
|
|
. . . |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
-комплекс |
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. . . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
E |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-комплекс |
|
|
|
|
|
|
|||||||
433

Если в реакцию вступает моноалкилзамещѐнный бензол, то в результате электрофильного замещения образуются о- и п-дизамещѐнные бензолы, а при протекании реакции до конца — продукт исчерпывающего замещения:
R
E
+ E+
R
+ E+
E
. . . |
|
R |
|
E |
E |
||
|
|||
|
|
E
. . .
С другой стороны, в реакциях замещения ориентирующее направление алкильной группы в орто- и пара-положениях бензольного кольца может быть объяснено и динамическим подходом, то есть сравнением устойчивости образующихся -комплексов. Например, при взаимодействии толуола с электрофилом образуются три изомерных -комплекса (орто-, мета- и па- ра-), строение которых описывается следующими граничными структурами:
CH3 |
CH3H |
CH3H |
CH3H |
H |
+ |
|||
|
|
CH2 H |
||||||
+ |
|
E |
E |
+ |
E |
|
|
E |
+ E |
|
|
|
|
||||
|
+ |
|
+ |
|
|
|
|
|
|
CH3 |
|
CH3 |
CH3 |
|
|
|
|
|
|
|
+ |
+ |
|
|
|
|
|
+ |
H |
H |
|
H |
|
|
|
|
|
E |
E |
|
E |
|
|
|
|
CH3 |
|
CH3 |
CH3 |
|
H |
+ |
|
|
|
|
|
|
CH2 |
|||
|
|
|
|
+ |
|
|
|
|
|
+ |
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
E |
|
H E |
H E |
|
|
H E |
|
Как видно, в случаях вступления электрофила в о- и п-положения число граничных структур данных -комплексов больше, чем при вступлении
434
электрофила в м-положение бензольного кольца (четыре против трѐх). К тому же среди о- и п-изомеров присутствуют такие структуры, в которых подчѐркивается участие электронодонорной (метильной) группы в делокализации положительного заряда -комплекса, — это последние из изображѐнных
всоответствующих рядах структур. Всѐ это подтверждает, что направление электрофильной атаки в о- и п-положения бензольного кольца энергетически выгоднее атаки в м-положение.
Однако необходимо иметь в виду, что о- и п-ориентация определяет лишь преимущественное направление реакции электрофильного замещения
валкилбензолах, то есть замещение идѐт в эти положения бензольного кольца преобладающим образом, но не исключительно. Обычно образуется смесь всех трѐх изомеров (орто-, мета-, пара-), но они находятся в разных соотношениях. Доля м-изомера определяется, главным образом, силой ориентирующего влияния алкильной группы R в бензольном кольце. Чем больше
атомов водорода при -углеродном атоме, тем выше значение электронной плотности на кольце (эффект Натана–Бейкера*). Это может быть объяснено величиной эффекта сверхсопряжения данной алкильной группы с ароматическим кольцом. По мере уменьшения проявляемого эффекта - - сопряжения алкильные группы располагаются в следующем порядке:
-CH3 > -CН2СН3 > -CH(CH3)2 > -C(CH3)3 ,
так как число -водородных атомов в этом ряду уменьшается от 3 до 0. При этом уменьшается реакционная способность соединений с такими заместителями (от толуола до трет-бутилбензола). Но кроме того, сила о-п- ориентирующего влияния тоже ослабевает, то есть доля о- и п-изомеров несколько уменьшается и увеличивается относительное количество продукта м-замещения. Но даже для реакций с участием толуола доля образующегося м-изомера может достигать 10%. Поэтому метильную и другие алкильные группы называют слабыми ориентантами.
Нитрование — один из примеров реакций электрофильного замещения в ароматическом кольце.
Так, при мононитровании толуола образуется 58% о-изомера и 38% п-изомера. При дальнейшем нитровании смеси нитротолуолов при 80 С получается смесь изомеров с преобладанием 2,4-динитротолуола. В смеси содержится также заметное количество 2,6-динитротолуола. Для нитрования динитротолуолов в 2,4,6-тринитротолуол (тротил) применяют безводную смесь серной и азотной кислот с двойным избытком азотной кислоты по сравнению с теоретически необходимым. Нитрование проводят при температуре около 100 С.
435
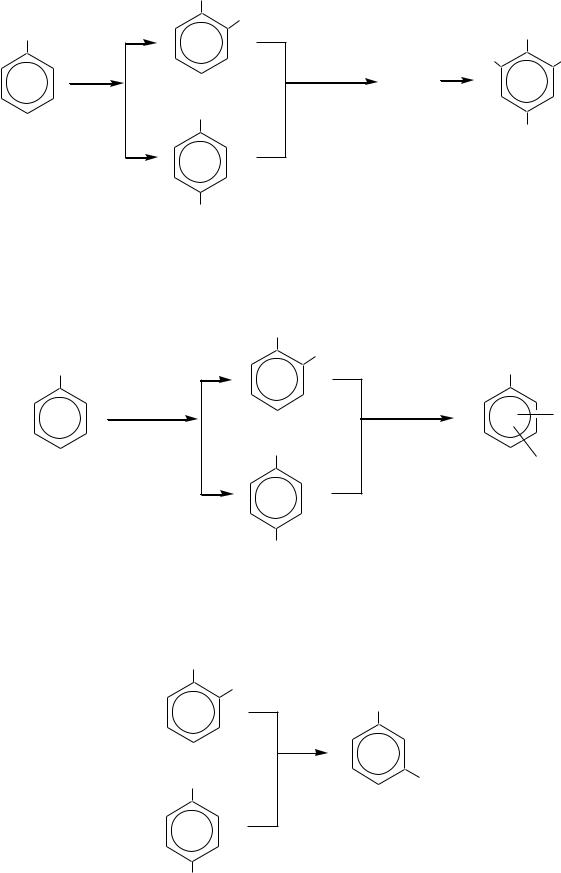
|
CH3 |
|
|
CH3 |
NO2 |
|
CH3 |
|
|
||
+ |
+ |
NO2 |
NO2 |
+ NO2 |
+ 2 NO |
|
|
|
2 |
. . . |
|
|
|
|
|
|
CH3 |
|
|
|
|
|
NO2 |
NO2
Другой пример SE-реакций алкилбензолов — алкилирование по Фри- делю–Крафтсу. Реакция неселективна: кроме моноалкилированного, образуются ди- и полиалкилзамещѐнные соединения.
|
R |
|
R |
R |
R |
|
||
+ RCl / AlCl3 |
RCl / AlCl3 |
R |
|
|
R
R
R
Реакция Фриделя–Крафтса обратима, поэтому при нагревании протекает перегруппировка о- и п-диалкилбензолов в термодинамически более устойчивый м-диалкилбензол:
R
R
R
t o
R |
R |
R
436

Углеводороды с непредельными связями в боковой цепи взаимодействуют с электрофилами прежде всего по этим связям, а не по бензольному кольцу. Такое направление обусловлено тем, что электрофильное присоединение с сохранением ароматичности протекает значительно легче, чем замещение в бензольном кольце:
CH=CH - R |
|
+ E+ |
|
|
. . . |
||
|
|
||
9.5.2.2. Восстановление бензольного кольца по Бѐрчу
Как сам бензол, так и алкилбензолы могут быть восстановлены до циклогексадиенов действием щелочных металлов и спирта в среде жидкого аммиака. При этом селективно образуются 1-алкилциклогекс-1,4-диены, как это следует из механизма реакции, протекающей через образование наиболее стабильной структуры анион-радикала:
|
|
|
|
|
|
|
|
|
|
H - |
|
|
|||
R |
|
|
|
|
|
+ . Na |
|
|
R |
|
|
|
|
ROH |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
+ |
|
|
|
|
|
- |
|||
|
|
|
|
|
|
|
|
-Na |
|
|
|
|
|
-RO |
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
H |
|
|
|
|
H |
|
|
|
H |
||||||
|
H |
|
|
|
|
|
H |
|
|
|
|
H |
|
|
|||
R |
|
|
|
|
|
|
. Na |
R |
ROH |
R |
|
|
|
|
|||
|
|
|
|
+ |
- |
|
|
||||||||||
|
|
|
|
|
|
|
-Na |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- |
-RO |
|
|
|
|
|
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
|
H |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1-алкилциклогекс-1,4-диены |
||||
9.5.2.3. Реакции боковых цепей
Протекание химических реакций с участием углеводородных заместителей определяется прежде всего природой этих заместителей (предельные или непредельные), а также влиянием на них -электронного секстета ароматического кольца.
Радикальное замещение
В алифатическом ряду SR-реакции характерны главным образом для алканов. Поэтому аналогично алканам для аренов, содержащих насыщенные углеводородные заместители, в условиях свободнорадикальных реакций (облучение, нагревание) наблюдаются реакции замещения в боковой цепи. Общий механизм радикального замещения включает те же стадии, что и в слу-
437

чае радикального замещения в алканах: инициирование, рост цепи, обрыв цепи (гл. 2.4.1). Однако влияние бензольного кольца на алкильный радикал приводит к одной особенности: всегда замещается -водородный атом (если он имеется). Такая селективность — существенное отличие от реакции радикального замещения алканов.
Так, например, галогенирование любого алкилбензола приводит к образованию -галогенозамещѐнного и является распространѐнным способом получения галогенозамещѐнных аренов с атомом галогена у -углеродного атома боковой цепи:
CH2 - CH3 + Cl2 |
- HCl |
CH - CH3 |
|
|
|
|
|
Cl |
Причина такого направления реакции кроется во влиянии бензольного кольца на стабильность промежуточного алкильного радикала.
CH2 - CH3 |
|
+ |
Cl |
- HCl |
CH - CH3 |
|
|
|
|
|
|
CH -CH-CH |
|
.Cl |
|
. |
|
+ |
|
CH-CH-CH |
|||
2 |
3 |
|
|
- HCl |
3 |
|
|
|
|
|
|
CH3 |
|
|
|
|
CH3 |
Образующиеся таким образом радикалы бензильного типа значительно устойчивее третичного, вторичного и тем более первичного радикалов, не сопряжѐнных с бензольным кольцом. В результате р- -сопряжения происходит делокализация спиновой плотности радикала бензильного типа. Истинное строение радикала можно представить как промежуточное между пятью граничными структурами:
|
CH CH3 |
|
CH CH3 HC CH3 |
|
|
|
HC |
|
|
|
CH3 |
|
|
HC CH3 |
|||||||||||||
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Электрофильное и радикальное присоединение
Реакции электрофильного присоединения (АЕ) характерны для углеводородов, содержащих кратные связи в боковой цепи. При этом наиболее существенно влияние бензольного кольца на химическое поведение таких соединений, молекулы которых содержат двойную связь в -положении к аро-
438

матическому кольцу. Например, гидрогалогенирование таких соединений протекает селективно и приводит только к одному продукту — -гало- генопроизводному:
CH=CH-R |
+ HBr |
CH-CH2-R |
|
||
|
|
Br |
Именно такое направление присоединения объясняется устойчивостью промежуточного карбокатиона ( -комплекса) при присоединении электрофильной частицы к молекуле субстрата.
|
+ H |
+ |
+ |
|
|
||
CH=CH-R |
|
CH-CH-R |
|
|
|
||
|
|
|
H |
|
|
|
+ |
|
|
|
CH-CH-R |
|
|
|
H |
Только катион бензильного типа будет стабилизирован р- -сопряжением, и положительный заряд этого катиона делокализован с участием -элек- тронной системы бензольного кольца. Истинное строение такого катиона является промежуточным между пятью граничными структурами:
+ |
|
|
|
|
|
+ |
|
|
|
|
|
|
HC |
CH R |
|
|
|
CH R |
|
|
|
|
CH R |
||||||||||||
CH CH R |
CH CH R |
|
HC |
|
HC |
||||||||||||||||||||||||||||||
|
|
2 |
|
|
|
|
2 |
|
|
2 |
|||||||||||||||||||||||||
2 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+
Присоединение в присутствии пероксидов (по механизму АR) протекает, как это следует из рассмотрения механизма реакции, с образованием-галогенопроизводного (гл. 4.1.2).
Дегидрирование, окисление
Дегидрирование характерно для насыщенных боковых цепей, протекает при повышенной температуре (500 600 С) на поверхности катализаторов; для этих целей используются оксиды магния, кальция, алюминия. При этом образование -связи в -положении к бензольному кольцу термодинамически выгодно, так как в этом случае возникает - -сопряжѐнная система.
CH2-CH2-R |
CH=CH-R + H2 |
439

Окислению перманганатом или дихроматом калия могут подвергаться углеводороды с любыми алкильными заместителями в бензольном кольце, хотя ни алканы, ни бензол не окисляются подобным образом. Так, алкилбензолы, имеющие -водородный атом, окисляются до бензойной кислоты при кипячении в течение нескольких часов. Независимо от длины и строения алкильного радикала образуются карбоновые кислоты с карбоксильной группой, связанной с бензольным кольцом. Например:
CH2-CH3 |
[O] |
COOH |
|
||
CH3 |
|
COOH |
[O]
CH-CH3 
 COOH CH3
COOH CH3
Каталитическое окисление кислородом воздуха приводит к тем же продуктам, и в данном случае механизм реакции — радикальный и связан с участием образующегося радикала бензильного типа, из которого в качестве промежуточного продукта образуется -гидропероксид:
CH3-CH2 |
|
|
CH3-CH |
|
|
CH3-CH-O-O |
||||||
|
|
+ O2 |
|
+ O2 |
|
|
+ Ar-CH2CH3 |
|||||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
- Ar-CH-CH3 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
- HOO |
|
|||||||||
CH3-CH-O-OH |
HC=O |
COOH |
|
|
+ O2 |
. . .
Данный процесс катализируется солями некоторых металлов переменной валентности (в частности Co3+).
Арены с кратными связями в боковых цепях подвергаются окислению аналогично этиленовым и ацетиленовым углеводородам (гл. 4.1.4.3). При действии озона на такие углеводороды реакция протекает одновременно как по кратной связи боковой цепи, так и по бензольному кольцу. Окисление озоном гомологов бензола протекает так же, как и для бензола (гл. 9.5.1.4).
440
