
- •Методические указания к лабораторным занятиям по дисциплине органическая химия
- •Введение
- •1 Техника безопасности при работе в лаборатории органической химии
- •1.1 Общие правила работы
- •1.2 Работа со взрывоопасными и горючими веществами
- •1.3 Общие методические советы
- •2 Методы очистки органических соединений
- •2.1 Очистка твердых органических соединений методом перекристаллизации
- •2.2 Очистка твердых органических соединений методом возгонки
- •2.3 Определение температуры плавлении
- •2.4 Очистка жидких органических соединений
- •2.5 Определение показателя преломления
- •3 Получение алкилгалогенидов
- •4 Реакции ацилирования
- •5 Реакции этерификации
- •6 Реакции конденсации карбонильных соединений
- •7 Нитрование ароматических соединений
- •8 Сульфирование ароматических соединений
- •9 Галогенирование ароматических соединений
- •10 Диазотирование ароматических соединений
- •11 Азосочетание ароматических соединений
- •12 Качественный функциональный анализ органических соединений
12 Качественный функциональный анализ органических соединений
Предварительные исследования образца.Анализ начинают с описания внешнего вида вещества. При этом отмечают его однородность и цвет. Для твердых веществ определяют температуру плавления. Если интервал составляет более 30С, то необходимо вещество перекристаллизовать. Для жидких веществ – определить показатель преломления.
Проба на сожжение(ТЯГА!). На крышку фарфорового тигля помещают 2–3 капли (0,5 г) исследуемого вещества. Крышку тигля постепенно вносят в верхнюю часть бесцветного пламени и следят за сжиганием вещества на небольшом огне, а затем крышку тигля сильно прокаливают. На основании наблюдений за характером горения вещества делают предположительное заключение о принадлежности его к какому–то классу соединений.
Если вещество сгорает коптящим пламенем с выделением сажи, то это указывает на присутствие ароматических или ацетиленовых соединений. Алифатические углеводороды горят светящим пламенем с небольшим образованием сажи. Вещества, содержащие кислород, горят голубоватым слабо светящимся пламенем. Несгораемый остаток, оставшийся на крышке тигля, свидетельствует о присутствии в веществе металла.
Определение растворимости.Исследование растворимости вещества в растворителях помогает определить наличие функциональных групп в образце. В пробирку помещают 2–3 капли жидкости или 0,1–0,5 г твердого вещества и постепенно прибавляют по каплям 0,3 мл растворителя, энергично взбалтывая. Растворение должно продолжаться не более 2–3 минут. Если вещество плохо растворяется при комнатной температуре, смесь осторожно нагревают до кипения.
В разбавленной соляной кислоте растворяются вещества основного характера (например, амины), в растворе гидрокарбоната – вещества сильнокислотные (карбоновые и сульфокислоты); а в щелочах – вещества кислого характера (кислоты, фенолы, меркаптаны).
В концентрированной серной кислоте растворение часто сопровождается разогреванием, изменением цвета раствора, что связано с химической реакцией между кислотой и веществом. Так реагируют многие кислородсодержащие вещества (эфиры, спирты). Серную кислоту наливают в пробирку (2-3 мл), а затем постепенно прибавляют исследуемое вещество, наблюдая за происходящими изменениями. Все наблюдения по растворимости вещества вносят в таблицу:
|
Т 0С |
Вода |
Растворы 5%-ные |
H2SO4 (конц.) |
Бензол |
Диэтил. эфир | ||
|
|
|
NaOH |
HCI |
NaHСО3 |
|
|
|
|
|
|
|
|
|
|
|
|
Проба Бейльштейна на галогены
Медную проволоку длиной 10 см с петлей на конце прокаливают на пламени горелки до прекращения окрашивания пламени. Остывшую петлю, покрывшуюся черным налетом оксида меди(II), опускают в пробирку с 1-2 каплями испытуемого вещества, например хлороформа, и вновь вносят в пламя горелки. Немедленно появляется характерная ярко–зеленая окраска пламени.
При прокаливании оксид меди(II) окисляет углерод и водород органического вещества в СО2и Н2О, медь же образует с галогеном летучие соединения, которые и окрашивают пламя горелки в зеленый цвет.
Химизм процесса:
2 СНСI3+ 5CuO=CuCI2+ 4CuCI+ 2CO2+H2O
Этот способ качественного обнаружения галогена в органическом веществе был предложен в 1872 г. русским академиком Ф.Ф. Бейльштейном. Эта проба очень чувствительная, и положительный ее результат может быть обусловлен наличием в исследуемом веществе лишь следов примесей, содержащих галоген. Этим путем легко обнаруживается, например, хлор в слюне.
Фтор пробой Бейльштейна не обнаруживается, так как фторид меди не летуч.
Насыщенные углеводороды
Главной аналитической характеристикой этого класса органических соединений является их химическая инертность - отсутствие положительных реакций с такими реагентами как раствор брома, раствор перманганата калия и др.
Ненасыщенные углеводороды
Взаимодействие с бромом.Углеводороды, содержащие двойные или тройные связи, легко присоединяют бром, в результате чего наблюдается обесцвечивание реакционной смеси.
К раствору 0,2 г (или 1 мл) вещества в 2–3 мл хлороформа добавляют по каплям при встряхивании 5%-ный раствор брома в хлороформа. Мгновенное исчезновение окраски свидетельствует о наличии кратной связи в веществе. Но раствор брома также обесцвечивается соединениями, содержащими подвижный водород (фенолы, ароматические амины). Однако при этом происходит реакция замещения с выделением бромоводорода, присутствие которого легко можно обнаружить с помощью влажной индикаторной бумажки. Кроме того, бром является активным окислителем илегко окисляющиеся органические соединения (например, альдегиды) также дают положительную пробу.
Проба с перманганатом калия.В слабо щелочной среде при действии перманганата калия происходит окисление вещества с разрывом кратной связи, раствор при этом обесцвечивается, и образуется хлопьевидный осадок оксида марганца(IV).
К 0,2 г (или 1 мл) вещества, растворенного в воде или ацетоне, добавляют по каплям при встряхивании 1%-ный раствор перманганата калия. Происходит быстрое исчезновение малиновой окраски и появляется бурный осадок. Однако перманганат калия окисляет вещества других классов – альдегиды, многоатомные спирты, ароматические амины. При этом также обеспечиваются растворы, но окисление протекает большей частью значительно медленнее.
Ароматических соединения
Ароматические соединения в отличие от алифатических способны вступать в реакции замещения, образуя часто окрашенные соединения. Обычно для этого используют реакции нитрования и алкилирования.
Нитрование ароматических соединений.(ТЯГА!). Нитрование проводят азотной кислотой или нитрующей смесью. В пробирку помещают 0,2 г (или 2 мл) вещества и при непрерывном встряхивании постепенно прибавляют 3 мл нитрующей смеси (кон. серная и азотная кислоты в соотношении 1:1). Пробирку закрывают пробкой с длинной стеклянной трубкой, которая служит обратным холодильником, и нагревают на водяной бане 5 мин при 500С. Смесь выливают в стакан с 10 г измельченного льда. Если при этом выпадает твердый продукт или масло, не растворимые в воде и отличающиеся от исходного вещества, то можно предположить присутствие ароматической системы.
Алкилирование ароматических соединений. Ароматические углеводороды и их галогенпроизводные дают при взаимодействии с хлороформом в присутствии хлорида алюминия продукты, окрашенные в яркие цвета (оранжевый, пурпурный, синий, зеленый).
В пробирку к 1–2 мл обезвоженного хлороформа прибавляют 0,2 г (или 2 мл) исследуемого вещества и смесь перемешивают. Затем осторожно вносят 0,5 г порошка безводного хлорида алюминия так, чтобы большая его часть осталась на стенках пробирки выше уровня жидкости. Наклоняя пробирку, слегка смачивают порошок хлорида алюминия. Появление яркой окраски на стенке пробирки, а также окрашивание всего раствора указывает на присутствие ароматической системы.
Алифатические спирты
При анализе спиртов используют реакции замещения как подвижного водорода в гидроксильной группе, так и всей гидроксильной группы.
Реакция с металлическим натрием.Спирты легко реагируют с натрием, образуя при этом алкоголяты, растворимые в воде:
2
ROH+ 2Na![]() 2RONa+H2
2RONa+H2
В пробирку помещают 2–3 мл безводного исследуемого вещества и осторожно добавляют маленький кусочек металлического натрия. Выделение газа при растворении натрия указывает на присутствие активного водорода. Однако эту реакцию могут давать и другие органические соединения, проявляющие кислотный характер.
Реакция с солянокислым раствором хлорида цинка (Проба Лукаса).
Концентрированные галогенводородные кислоты способны замещать гидроксильную группу в спиртах на галоген, образуя нерастворимые в воде галогенпроизводные. Но замещение происходит с различной скоростью в зависимости от природы спирта. Первичные, вторичные и третичные спирты различаются по реакции их с соляной кислотой в присутствии хлорида цинка и без него. Так, третичные спирты реагируют с конц. соляной кислотой без хлорида цинка при комнатной температуре уже в течение 5 минут, а вторичные и первичные спирты при этом не реагируют.
В присутствии хлорида цинка третичные спирты взаимодействуют с соляной кислотой в течение 3–5 минут, при этом получаются нерастворимые в воде капли галоидного алкила. Вторичные спирты сначала растворяются с образованием прозрачного раствора, а затем раствор мутнеет и выпадают капли галогенпроизводного. Реакция для них возможна лишь при длительном нагревании или стоянии.
![]()
К 1 мл исследуемого вещества прибавляют 5 мл реактива Лукаса.Пробирку закрывают пробкой, энергично встряхивают и оставляют стоять на 5мин. Третичные спирты при этом через 2–3 минуты образуют хлористый алкил, оседающий в виде нерастворимых в воде капель. Вторичные спирты дают помутнение раствора, а выделение галогенпроизводного наступает лишь 10 минут. Первичные спирты образуют гомогенный раствор, выделения хлоропроизводного не наблюдается.
К 1 мл исследуемого вещества приливают 3 мл конц. соляной кислоты. Смесь сильно встряхивают и оставляют стоять на 3–5мин. Третичные спирты при этом образуют нерастворимый в кислоте галоидный алкил. Первичные и вторичные спирты в этих условиях заметно не реагирует. Эта реакция позволяет отличить третичные спирты от вторичных.
Многоатомные спирты. Реакция с гидроксидом меди(II). В двух-, трех– и многоатомных спиртах, содержащих 1,2-диольный фрагмент, в отличие от одноатомных спиртов растворяется свежеприготовленный гидроксид меди (II), с образованием темно–синего раствора комплексных солей соответствующих производных (гликолятов, глицератов).
В пробирку наливают несколько капель (0,3–0,5 мл) 3%-ного раствора сульфата меди, а затем 1 мл 10%-ного раствора NaOH. Выпадает студенистый голубой осадок гидроксида меди(II). Растворение осадка при добавлении 1 мл исследуемого вещества и изменение цвета раствора до темно – синего подтверждает присутствие многоатомного спирта с гидроксильными группами, расположенными у соседних атомов углерода.
Фенолы
Реакция с хлоридом железа(III).Фенолы дают с хлоридом железа(III) интенсивно окрашенные комплексные соли. Обычно появляется глубокая синяя или фиолетовая окраска, некоторые фенолы дают зеленое или красное окрашивание, оно ярче проявляется в воде или хлороформе и хуже в спирте.
В пробирку помещают несколько кристаллов исследуемого вещества в 2 мл воды или хлороформа, затем добавляют при встряхивании 1–3 капли 3%-ного раствора хлорида железа(III). В присутствии фенола появляется интенсивная фиолетовая или синяя окраска.
Реакция с бромной водой. Фенолы со свободными орто– и пара– положениями в бензольном ядре легко обесцвечивают бромную воду, при этом получается осадок 2,4,6–трибромфенола.
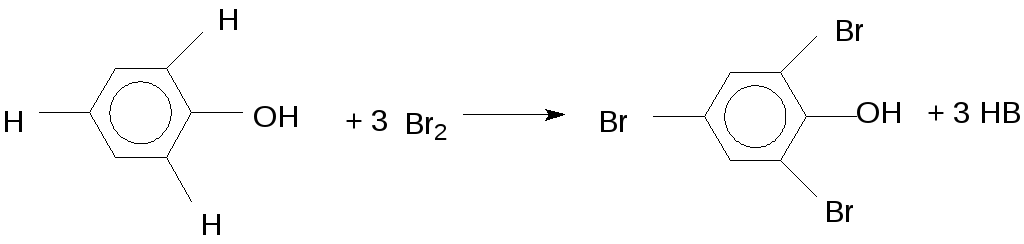
Небольшое количество исследуемого вещества встряхивают с 1 мл воды, затем прибавляют по каплям бромную воду. Происходит быстрое обесцвечивание раствора и выпадение белого осадка.
Карбонильные соединения
В отличие от кетонов альдегиды легко окисляются. На этом свойстве основано открытие альдегидов.
Реакция серебряного зеркала.Все альдегиды легко восстанавливают аммиачный раствор оксида серебра. Кетоны этой реакции не дают.
R–CHO+ 2Ag(NH3)2OH![]() R–COONH4+ 2Ag+ 3NH4OH
R–COONH4+ 2Ag+ 3NH4OH
В хорошо вымытой пробирке смешивают 1 мл раствора нитрата серебра с 1 мл 25-%-ного раствора аммиака. Выпавший первоначально осадок гидроксида серебра быстро растворяется в избытке аммиака. К полученному раствору прибавляют несколько капель спиртового раствора анализируемого вещества. Пробирку помещают на водяную баню и нагревают при 50-600С 10-15 минут. Если на стенках пробирки выделяется блестящий налет металлического серебра, то это свидетельствует о наличии альдегидной группы в исследуемом образце.
Следует отметить, что эту реакцию могут давать также и другие легко окисляющиеся соединения: многоатомные фенолы, 1,3-дикетоны и др.
Реакция с гидросульфитом натрия.Альдегиды, алифатические метилкетоны и алициклические кетоны при взаимодействии с гидросульфитом натрия образуют хорошо кристаллизующиеся сульфитные соединения:
R2C
= O + NaHSO4 ![]() R2C
(OH)SO3Na
R2C
(OH)SO3Na
В пробирку помещают 0,2 г (или 2 мл) исследуемого вещества, приливают 1 мл этилового спирта и 1 мл насыщенного раствора гидросульфита натрия. Пробирку закрывают пробкой и сильно встряхивают. Выпадение кристаллического осадка свидетельствует о наличии карбонильного соединения.
При отрицательных пробах на специфические реакции альдегидов, выпавший кристаллический осадок гидросульфитного соединения указывает на присутствие метилкетона или циклического кетона.
Восстановление альдегидами соединений двухвалентной меди.
К 1 мл раствора исследуемого альдегида добавляют 0,5 мл 10%-ного раствора щелочи и затем по каплям 10%-ный раствор сульфата меди до образования осадка. Полученную смесь нагревают до начала кипения, при этом осадок изменяет свою окраску.
Сульфат меди при взаимодействии со щелочью образует голубой осадок гидроксида меди(II). При нагревании этот гидроксид теряет воду и дает черного цвета оксид меди СuО.
Альдегиды легко окисляются до соответствующих карбоновых кислот, т.е. являются сильными восстановителями. При нагревании в щелочном растворе они восстанавливают соединения двухвалентной меди до соединений одновалентной меди и далее до металлической меди по схеме:
Сu(ОН)2 СuОН
голубого цвета
желтого цвета
![]()
![]() Сu
Сu
коричневато – красного цвета
СuО
Сu2О![]()
черного цвета
![]() красного цвета
красного цвета
Ход реакции легко можно проследить по изменению цвета осадка. Эта реакция была предложена Троммером. Избыток свободной щелочи резко ускоряет окисление альдегидов.
В условиях данного опыта уксусный альдегид восстанавливает соединения двухвалентной меди до соединений Сu(I):
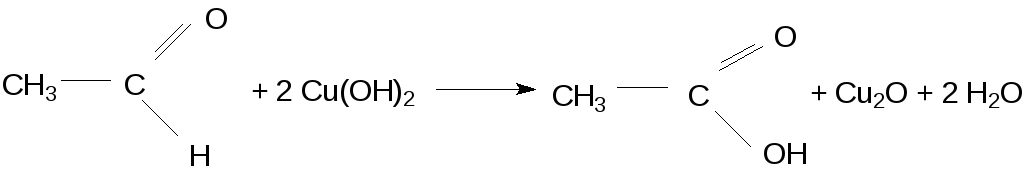
Формальдегид же не только непосредственно окисляется, но в присутствии Сu2О взаимодействует со щелочью:
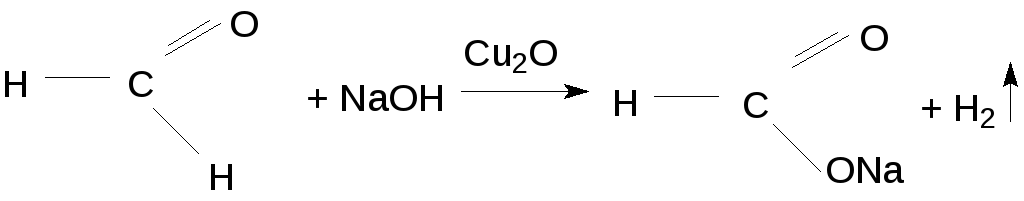
Образующийся при этом водород восстанавливает соединения меди до металла.
Образование йодоформа из альдегидов и кетонов
Йодоформ СНJ3образуется в щелочной среде при взаимодействии йода с альдегидами или кетонами в молекуле которых уже имеется группировка СН3–СО-. Данная проба является положительной и для вторичных спиртов, содержащих группировку СН3СН(ОН)-. В этом случае первой стадией является образование альдегида (или кетона) в результате окисления спирта.
К 1–2 мл разбавленного водного раствора исследуемого вещества добавляют 1 мл раствора йода КIи затем несколько капель раствора щелочи до исчезновения окраски. В некоторых случаях немедленно и без нагревания образуется желтый осадок йодоформа.
Вследствие ничтожной растворимости йодоформа в воде реакция эта очень чувствительная и позволяет, например, обнаружить содержание в воде 0,04% ацетона.
Химизм процесса получения йодоформа из ацетона следующий:
J2
+ 2 NaOH ![]() NaOJ + NaJ + H2O
NaOJ + NaJ + H2O
O O
![]()
![]()
CH3
– C – CH3
+ 3 NaOJ ![]() CH3
– C – CJ3
+ 3 NaOH
CH3
– C – CJ3
+ 3 NaOH
O O
![]()
![]()
CH3
– C – CJ3
+ NaOH ![]() CH3
– C – ONa + CHJ3
CH3
– C – ONa + CHJ3
Формальдегид не содержит в молекуле необходимой для образования йодоформа группировки атомов и в условиях опыта окисляется до муравьиной кислоты.
Реакция с 2,4–динитрофенилгидразином.Альдегиды и кетоны можно обнаружить по образованию 2,4 – динитрофенилгидразонов, выделяющихся в виде ярко – желтых или красных осадков, мало растворимых в воде:
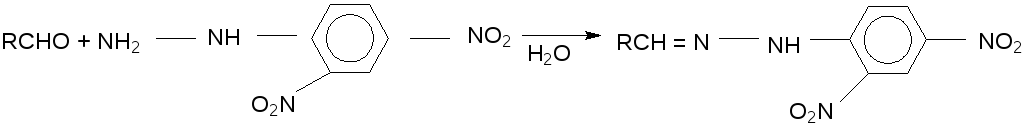
В пробирку к 1 мл гидрохлорида или сульфата 2,4–динитрофенилгидразина добавляют раствор 0,1 г (или 1 мл) анализируемого вещества в спирте. Смесь нагревают на водяной бане. При охлаждении выделяется желтый или красный осадок 2,4–динитрофенилгидразона карбонильного соединения.
Карбоновые кислоты
Определение кислотности.Водно–спиртовые растворы карбоновых кислот показывают кислую реакцию на лакмус.
Каплю водно-спиртового раствора исследуемого вещества наносят на синюю влажную бумажку лакмуса или универсального индикатора. При наличии кислоты индикатор меняет свой цвет: лакмус становится розовым, а универсальный индикатор в зависимости от кислотности от желтого до оранжевого.
Следует иметь в виду, что сульфокислоты, нитрофенолы и некоторые другие соединения с подвижным «кислым» водородом, не содержащие карбоксильной группы, могут давать также изменение цвета индикатора.
Реакция с гидрокарбонатом натрия.При взаимодействии карбоновых кислот с гидрокарбонатом натрия происходит выделение оксида углерода:
R COOH+NaHСО3RCOONa+H2O+CO2
COOH+NaHСО3RCOONa+H2O+CO2
В пробирку наливают 1–2 мл насыщенного раствора гидрокарбоната натрия и добавляют 1–2 мл водно–спиртового раствора исследуемого вещества. Пробирку закрывают газоотводной пробкой, конец трубки которой опущен в пробирку с баритовой или известковой водой. При выделении углекислого газа в пробирке с баритовой водой образуется белый осадок, что указывает на наличие кислоты в исходном соединении.
Образование нерастворимых солей.Для обнаружения карбоновых кислот используют также способность их образовывать нерастворимые свинцовые, серебренные и бариевые соли.
К 1 мл исследуемого раствора прибавляют раствор гидроксида натрия до рН 7 – 8 (по универсальному индикатору). К раствору полученной натриевой соли добавляют по каплям концентрированный раствор нитрата свинца, серебра или хлорида бария. Выпадение осадка указывает на наличие карбоновой кислоты.
Свойства муравьиной кислоты
Реакция серебряного зеркала.Готовят в пробирке аммиачный раствор оксида серебра. Для этого к 1–2 мл водного раствора нитрата серебра добавляют по каплям разбавленный раствор аммиака до растворения образовавшегося осадка. К полученному раствору приливают 0,5 мл муравьиной кислоты или формиата натрия. Пробирку с реакционной смесью нагревают несколько минут на водяной бане при 60–700С. Металлическое серебро выделяется в виде зеркального налета на стенках пробирки или в виде темного осадка.
Окисления перманганатом калия.В пробирку с газоотводной трубкой наливают 0,5–1 мл муравьиной кислоты или ее соли, 1 мл разбавленной серной кислоты и 1–2 мл раствора перманганата калия. Конец газоотводной трубки погружают в другую пробирку (почти до дна), содержащую 1–2 мл известковой воды, и осторожно нагревают смесь до начала кипения. Какие изменения в пробирке вы наблюдаете? Напишите уравнения реакций.
Разложение муравьиной кислоты (тяга!).В пробирке с гибкой газоотводной трубкой осторожно смешивают 1 мл концентрированной серной кислоты и 1 мл муравьиной кислоты или 1 г ее соли. Пробирку осторожно нагревают. Муравьиная кислота разлагается с образованием оксида углерода(II) и воды. Оксид углерода(II) поджигают у отверстия газоотводной трубки. Обратите внимание на характер пламени. После окончания работы пробирку с реакционной смесью необходимо охладить, чтобы прекратить выделение ядовитого СО. Напишите уравнение реакции разложения муравьиной кислоты в условиях описанного опыта.
Сложные эфиры
При анализе сложных эфиров используют их способность омыляться под действием щелочей:
RCOOR”
+NaOH![]() RCOONa+R”OH
RCOONa+R”OH
В пробирке растворяют 0,5 г анализируемого вещества в 5 мл спирта. Прибавляют несколько капель фенолфталеина, 0,1М раствор гидроксида натрия в этаноле до появления малинового окрашивание смеси. Пробирку нагревают на водяной бане при 40–500С. Исчезновение окрашивания указывает на связывание щелочи кислотой, образовавшейся в результате гидролиза сложного эфира. Эта реакция является положительной пробой на присутствие в исследуемом образце сложноэфирной группы.
Амины
Бромирование анилина
К 5 мл воды приливают 2–3 капли анилина и смесь сильно встряхивают. К полученной эмульсии по каплям прибавляют бромную воду. Смесь обесцвечивается, и выпадает белый осадок триброманилина.
Введение в ароматическое кольцо аминогруппы резко повышает подвижность атомов водорода при атомах углерода бензольного кольца, поэтому анилин очень легко бромируется даже в разбавленном водном растворе с образованием малорастворимого в воде 2,4,6–триброманилина:
2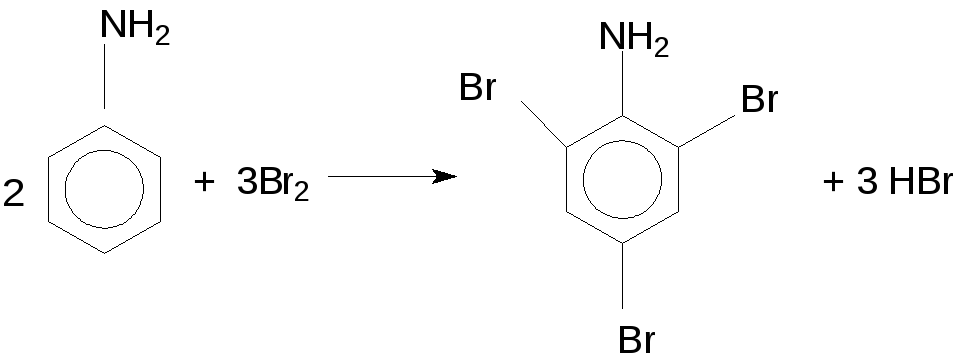
В результате бромирования основность анилина понижается, и триброманилин почти нерастворим в разбавленных кислотах.
Окисление анилина
К 1мл анилиновой воды добавляют 2–3 капли раствора бихромата калия и 0,5 мл разбавленной серной кислоты. Жидкость окрашивается в интенсивный темно – зеленый цвет, переходящий в синий, а затем в черный.
Окисление анилина протекает очень легко, и в зависимости от условий и характера окислителя образуются различные соединения: азобензол, азоксибензол, нитробензол, бензохинон и т.д. В условиях описанного опыта анилин при окислении дает различные сложные окрашенные соединения, содержащие хиноидную группу.
Продукт окисления «черный анилин» очень стоек к кислотам и щелочам, его применяют в качестве красителя.
Рекомендуемая литература к лабораторным работам
Органикум. М.: Мир. - 1992. - Т. 1,2.
Титце Л., Айхер Т. Препаративная органическая химия. М.Мир. 1999.
Гордон А., Форд Р. Спутник химика. М.: Мир. 1976.
Составитель —
доцент кафедры химии СыктГУ, к.х.н. Залевская О.А.
