
- •Методические указания к лабораторным занятиям по дисциплине «Химия»
- •Сыктывкар, 2016
- •1 Техника безопасности при работе в лаборатории органической
- •1.1 Общие правила работы
- •1.2 Работа с взрывоопасными и горючими веществами
- •1.3 Общие методические советы
- •2 Методы очистки органических соединений
- •2.1 Очистка твердых органических соединений методом перекристаллизации
- •2.2 Очистка твердых органических соединений методом возгонки
- •2.3 Определение температуры плавления
- •2.4 Очистка жидких органических соединений
- •2.4.1. Простая перегонка
- •2.4.2. Дробная (фракционная) перегонка
- •2.4.3. Определение показателя преломления
- •3. Синтез органических соединений Иодоформ
- •Бромэтан
- •Уксусноэтиловый эфир
- •Углеводороды
- •Контрольные вопросы по теме «Углеводороды»
- •Галогенпроизводные углеводородов
- •Контрольные вопросы по теме «Галогенпроизводные углеводородов»
- •Оксисоединения: спирты, фенолы
- •Контрольные вопросы по теме «Оксисоединения: спирты, фенолы»
- •Карбонильные соединения: альдегиды, кетоны
- •Контрольные вопросы по теме «Карбонильные соединения»
- •Углеводы
- •Контрольные вопросы по теме
- •Карбоновые кислоты и их производные
- •Контрольные вопросы по теме «Карбоновые кислоты и их производные»
- •Ароматические амины
- •Контрольные вопросы по теме «Ароматические амины»
- •Рекомендуемая литература
Контрольные вопросы по теме «Галогенпроизводные углеводородов»
Напишите реакцию образования йодоформа из этилового спирта. В чем практическое значение галоформной реакции?
Объясните подвижность атомов галогена в галогенпроизводных различного типа.
Рассмотрите механизм реакции мономолекулярного нуклеофильного замещения на примере реакции гидролиза хлористого бензила. Раскройте стереохимию и кинетику реакции.
Рассмотрите механизм реакции бимолекулярного нуклеофильного замещения на примере реакции гидролиза хлористого пропила. Раскройте стереохимию и кинетику реакции.
Оксисоединения: спирты, фенолы
Опыт № 1. Проба Лукаса
В три сухие пробирки приливают по 0,5 мл спиртов: пропилового (первичного спирта), изопропилового (вторичного спирта) и третичного бутилового. Затем в каждую пробирку добавляют по 1,5 мл реактива Лукаса. Перемешивают содержимое пробирок и оставляют стоять на 1-3 мин.
Какие изменения происходят в пробирках с первичным, вторичным и третичным спиртами? Какие свойства спиртов (основные или кислотные) проявляются в этой реакции?
Для того чтобы различить первичные, вторичные и третичные спирты, используется различная подвижность гидроксогруппы в реакции спиртов с хлоридом цинка в концентрированной соляной кислоте:
ZnCl2
R-OH + HCl → R-Cl + H2O
Третичные спирты реагируют мгновенно с выделением теплоты, давая нерастворимые галогеналкилы. Вторичные спирты реагируют не мгновенно, а в течение 5 мин. без выделения теплоты. Первичные спирты не реагируют даже при длительном стоянии при комнатной температуре.
Этот порядок реакционной способности отражает порядок устойчивости карбокатионов (третичный > вторичный > первичный) и легкость превращения спирта в алкилхлорид через соответствующий карбокатион.
ZnCl2
СН3-СН2-СН2-ОН + HCl → реакция не идет
ZnCl2 + Cl-
СН3-СН(ОН)-СН3 + НСl → СН3-СН- СН3 → СН3-СН(Сl)-СН3
вторичный катион
ZnCl2 + Cl-
СН3-(СН3)СН(ОН)-СН3 + НСl → СН3-СН(СН3 )-СН3 → СН3-(СН3 )СН(Сl)-СН3
третичный катион
Какую роль играет безводный хлорид цинка в реактиве Лукаса?
Хлорид цинка представляет собой кислоту Льюиса, он реагирует со спиртом как с основанием Льюиса:
+ -
R-O + ZnCl2 → R-O ─ ZnCl2
│ │
H H
Такая координация делает гидроксигруппу лучшей уходящей группой, такой спирт легко атакуется ионом хлора. Вероятно, первичный спирт реагирует очень медленно по механизму SN2, вторичный спирт – по механизму SN1. Третичные спирты реагируют с соляной кислотой без хлорида цинка, что, несомненно, обусловлено большей устойчивостью (легкостью образования) третичного катиона. Они реагируют также по механизму SN1:

Реакционная способность спиртов по отношению к реактиву Лукаса: бензиловый > аллиловый > третичный > вторичный > первичный.
Опыт № 2. Окисление спиртов хромовой смесью
В две пробирки наливают по 2-3 мл раствора хромовой смеси (бихромат калия в концентрированной серной кислоте) и по каплям при встряхивании добавляют в одну пробирку 0,5 мл этилового спирта (Осторожно! Смесь сильно разогревается), а во вторую – 0,5 мл изоамилового спирта. Цвет растворов меняется из оранжевого в зеленый. В пробирке с этиловым спиртом ощущается запах яблок (нюхать осторожно!), в пробирке с изоамиловым спиртом – специфический запах изовалерианового альдегида.
Напишите уравнения реакций окисления данных спиртов хромовой смесью.
Опыт № 3. Окисление этилового спирта перманганатом калия (Тяга!)
Пипеткой аккуратно, не смачивая стенок, вносят в сухую пробирку, закрепленную в штативе, 5 мл концентрированной серной кислоты. Затем по стенке другой пипеткой осторожно приливают 5 мл этилового спирта так, чтобы получилось 2 слоя. После этого насыпают 1-1,5 г перманганата калия. Через несколько минут на границе двух слоев появляются яркие вспышки, ощущается запах уксусного альдегида.
Напишите уравнение реакции окисления этилового спирта в уксусный альдегид перманганатом калия.
Опыт № 4. Свойства глицерина и этиленгликоля
Получение глицерата и гликолята меди.
В пробирку наливают 3-4 капли разбавленного раствора медного купороса СuSO4 и 2-3 мл разбавленного раствора гидроксида натрия NaOH. К образовавшемуся осадку голубого цвета приливают несколько капель глицерина и смесь перемешивают. Осадок растворяется и появляется темно-синее окрашивание, вследствие образования глицерата меди.
Опыт повторяют, но вместо глицерина вводят в реакцию этиленгликоль.
Многоатомные спирты обладают более сильными кислотными свойствами, чем одноатомные. Поэтому они образуют солеобразные соединения – алкоголяты, не только при действии щелочных металлов, но и при взаимодействии с гидроксидами многих металлов. Если в молекуле спирта имеются две соседние гидроксильные группы, то гидроксид меди (II) в щелочном растворе сначала образует алкоголят меди, который затем превращается в комплексный катион с участием уже четырех гидроксильных групп (т.е. двух молекул спирта) с координационным числом 4. Комплексообразователем в нем является ион двухвалентной меди, замещающий водород в двух группах -ОН, а лигандами – атомы кислорода этих двух гидроксильных групп, не потерявших атом водорода:
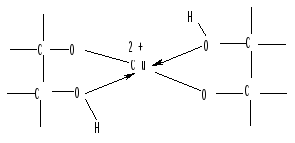
Именно эти комплексные ионы обусловливают интенсивную синюю или фиолетовую окраску раствора. Эти соединения устойчивы к действию щелочи. Наоборот, кислоты разрушают их с образованием исходного спирта и соли меди. При этом окраска раствора исчезает или резко уменьшается ее интенсивность.
Напишите уравнения реакций образования гликолята и глицерата меди.
Опыт № 5. Растворимость и кислотный характер фенолов
К 0,5 г исследуемого фенола добавляют 4-5мл воды и встряхивают. Если вещество не растворяется полностью, нагревают смесь до кипения, затем охлаждают, отмечая наблюдаемые изменения. Испытывают реакцию полученных растворов на лакмус, помещая каплю каждого из них на синюю лакмусовую бумагу.
Водные растворы фенолов используют для последующих опытов.
Простейший фенол С6Н5ОН (карболовая кислота) при обычной температуре лишь умеренно растворим в воде (6 г в 100 мл воды). При нагревании растворимость фенола повышается и выше 680С фенол и вода смешиваются с водой во всех отношениях.
С увеличением числа гидроксильных групп растворимость фенолов воде повышается в различной степени в зависимости от взаимного расположения гидроксогрупп в бензольном кольце. Пирогаллол и резорцин растворяются в воде очень хорошо, а гидрохинон – несколько хуже, чем фенол. Все фенолы растворимы в этиловом спирте и диэтиловом эфире. В отличие от спиртов фенолы обнаруживают явную кислую реакцию. Наиболее резко выражен кислотный характер у пирогаллола.
Опыт № 6. Реакция фенолов с хлоридом железа (III)
В каждую пробирку наливают по 1 мл раствора соответствующего фенола и прибавляют 1-2 капли раствора хлорида железа (III).
Растворы фенола и резорцина дают при этом интенсивное фиолетовое окрашивание, раствор пирогаллола – буровато-красное. Раствор гидрохинона сначала зеленеет, затем буреет, а при стоянии из него выпадают красивые темно-зеленые кристаллы хингидрона.
Окрашенные растворы, содержащие фенол, резорцин и пирогаллол делят каждый на две части; к одной части добавляют равный объем спирта, к другой – разбавленной соляной кислоты. Что наблюдаете?
Из смеси, содержащей гидрохинон, отливают немного раствора, отстоявшегося над осадком, и добавляют к нему несколько капель ферроцианида калия К3[Fe(CN)6]. Образуется темно-синий осадок турнбулевой сини Fe3[Fe(CN)6]2.
Многие фенолы и более сложные соединения, содержащие в молекуле фенольный гидроксил, дают с хлоридом железа (III) интенсивное окрашивание того или иного цвета, характерное для данного фенола. Окрашивание является результатом образования сильно диссоциированных комплексных фенолятов железа (III), образующихся по уравнению:
6 ArOH + FeCl3 → [(ArO)6Fe]3- + 6H+ + 3Cl-
При введении кислоты, спирта, избытка хлорида железа(III) уменьшается степень диссоциации фенолята (а, следовательно, снижается концентрация окрашенных анионов) и окраска уничтожается.
Одновременно хлорид железа (III) действует на фенолы и как окислитель. Гидрохинон окисляется им до хинона, из которого затем образуется хингидрон:
 гидрохинон
п-хинон
хингидрон
гидрохинон
п-хинон
хингидрон
(бесцветный) (желтый) (зеленый)
Реагируя как окислитель, соль трехвалентного железа переходит в соль двухвалентного железа, что легко обнаруживается действием ферроцианида калия:
3Fe2+ + [Fe(CN)6]3- → Fe3[Fe(CN)6]2
Опыт № 7. Действие брома на фенол в водном растворе
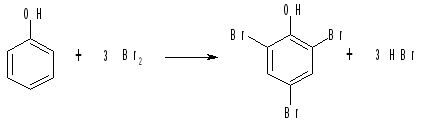
К 1 мл водного раствора фенола добавляют бромную воду по каплям. Образующаяся сначала муть при встряхивании исчезает. При дальнейшем прибавлении бромной воды (3-4 мл) выделяется обильный белый осадок трибромфенола с характерным аптечным запахом. Продолжают добавлять бромную воду при встряхивании до превращения белого осадка в светло-желтый.
Бромирование фенола в водном растворе идет вначале быстро, и фенол количественно превращается в малорастворимый неокрашенный 2,4,6-трибромфенол:
Но бромная вода является не только бромирующим агентом, но и окислителем вследствие происходящей реакции:
Br2 + H2O → HOBr + HBr
Поэтому при действии избытка бромной воды трибромфенол окисляется до тетрабромфенола, представляющего собой 2,4,4,6 – тетрабромциклогексадиенон:
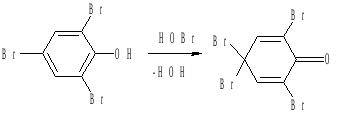
Этот продукт окрашен в желтый цвет и плохо растворим в холодной воде.
Опыт № 8. Окисление фенола
К 0,5 мл раствора фенола добавляют равный объем раствора карбоната натрия и затем приливают по каплям при встряхивании раствор перманганата калия. Происходит обесцвечивание раствора и выделение оксида марганца (IV) при комнатной температуре.
Окисление фенола протекает одновременно по различным направлениям и приводит к образованию сложной смеси веществ. Более легкая окисляемость фенола по сравнению с бензолом обусловлена влиянием гидроксильной группы, резко повышающей подвижность атомов водорода при атомах углерода бензольного кольца, особенно в положениях 2,4,6.
