
- •Методические указания к лабораторным занятиям по дисциплине «Химия»
- •Сыктывкар, 2016
- •1 Техника безопасности при работе в лаборатории органической
- •1.1 Общие правила работы
- •1.2 Работа с взрывоопасными и горючими веществами
- •1.3 Общие методические советы
- •2 Методы очистки органических соединений
- •2.1 Очистка твердых органических соединений методом перекристаллизации
- •2.2 Очистка твердых органических соединений методом возгонки
- •2.3 Определение температуры плавления
- •2.4 Очистка жидких органических соединений
- •2.4.1. Простая перегонка
- •2.4.2. Дробная (фракционная) перегонка
- •2.4.3. Определение показателя преломления
- •3. Синтез органических соединений Иодоформ
- •Бромэтан
- •Уксусноэтиловый эфир
- •Углеводороды
- •Контрольные вопросы по теме «Углеводороды»
- •Галогенпроизводные углеводородов
- •Контрольные вопросы по теме «Галогенпроизводные углеводородов»
- •Оксисоединения: спирты, фенолы
- •Контрольные вопросы по теме «Оксисоединения: спирты, фенолы»
- •Карбонильные соединения: альдегиды, кетоны
- •Контрольные вопросы по теме «Карбонильные соединения»
- •Углеводы
- •Контрольные вопросы по теме
- •Карбоновые кислоты и их производные
- •Контрольные вопросы по теме «Карбоновые кислоты и их производные»
- •Ароматические амины
- •Контрольные вопросы по теме «Ароматические амины»
- •Рекомендуемая литература
Контрольные вопросы по теме «Карбонильные соединения»
Назовите качественные реакции на альдегиды. Реакция Троммера и Толленса, реакция с фуксинсернистой кислотой.
Напишите реакцию восстановления Сu(OH)2 формальдегидом.
Напишите реакцию с гидросульфитом натрия для формальдегида, пентаналя, ацетона. Для чего применяют эту реакцию?
Какие из перечисленных карбонильных соединений дадут положительную йодоформную реакцию: уксусный альдегид, формальдегид, метилэтилкетон, пентаналь, этанол, диэтилкетон?
Напишите йодоформную реакцию для ацетона. Для чего применяют эту реакцию?
Напишите реакцию образования фенилгидразона бензойного альдегида, ацетофенона, бензофенона, ацетона. Для чего применяют эту реакцию?
Напишите реакцию образования 2,4-динитрофенилгидразона ацетилацетона, ацетона, метилэтилкетона. Для чего применяют эту реакцию?
Раскройте механизм реакции взаимодействия уксусного альдегида с этанолом в мольном соотношении 1:1. Какие продукты образуются при избытке спирта?
Раскройте механизм реакции взаимодействия ацетона с метанолом. в мольном соотношении 1:1. Какие продукты образуются при избытке спирта?
Углеводы
Опыт № 1. Общая реакция углеводов с а- нафтолом
Все углеводы при взаимодействии с концентрированной серной кислотой разлагаются с образованием разнообразных продуктов, и среди них фурфурола или его производных. Последние в результате реакции конденсации с α–нафтолом образуют окрашенные вещества.
В пробирку берут около 1 мл воды и очень немного любого углевода ( глюкозу, сахорозу, крахмал, клетчатку и пр.) и 1 – 2 капли 15%- ого спиртового раствора α– нафтола. Наклонив пробирку, по ее стенке осторожно из пипетки приливают 1 мл концентрированной серной кислоты. Серная кислота опускается на дно пробирки под водный раствор, и на границе двух слоев постепенно образуется фиолетовое кольцо.
Опыт № 2. Окисление моносахаридов
Все моносахариды легко окисляются. Кетозы окисляются так же хорошо, как и альдозы, в отличие от собственно кетонов, которые окисляются значительно труднее альдегидов. Моносахариды окисляются в щелочной среде гидратами окисей некоторых металлов (меди, серебра, висмута).
Восстановление гидроксида меди (II). В пробирку наливают 3 – 4 мл 1 – процентного раствора глюкозы и половинный обьем 10% - го раствора едкого натра. К смеси прибавляют при встряхивании по каплям 5%-ный раствор сульфата меди; образующийся при этом осадок гидроксида меди (II) растворяется с синим окрашиванием раствора. Сульфат меди приливают до появления уже не исчезающей при встряхивании мути. Гидроксид меди связывается глюкозой, образуя с ней окрашенные комплексные алкоголяты меди, подобно многоатомным спиртам, что доказывает так же наличие в молекуле сахаров нескольких спиртовых групп. Избыток гидроксида меди может в дальнейшем затемнить результат реакции, так как при нагревании гидоксид меди дает черную окись меди. Но и при недостатке гидроксида меди положительная реакция может маскироваться вследствие того, что глюкоза, не связанная гидроксидом меди, в щелочном растворе при нагревании осмоляется, образуя темно-окрашенные продукты. Пробирку нагревают в верхней части смеси до начинающегося кипения жидкости. При этом появляется сначала желтый осадок гидроксида меди(I), вскоре затем переходящий в красный осадок оксида меди(I).
Эту же реакцию проводят и с 1 – процентным раствором фруктозы. Гидроксид меди(II) восстанавливается и в этом случае.
Окисление моноз щелочным раствором гидроксида меди(II) не всегда идет в определенных стехиометрических соотношениях. Оно сопровождается расщеплением молекулы углевода с образованием в зависимости от условий сложной смеси продуктов окислительного распада. Среди них обнаружена также и глюконовая кислота, образование которой протекает по следующему уравнению:
Р еакция
с фелинговой жидкостью.Вместо того
порядка окисления, который указан в
предыдущей работе, для окисления сахаров
часто применяют фелингову жидкость,
которая представляет собой щелочной
раствор комплексного соединения
двухвалентной меди с виннокислой солью.
еакция
с фелинговой жидкостью.Вместо того
порядка окисления, который указан в
предыдущей работе, для окисления сахаров
часто применяют фелингову жидкость,
которая представляет собой щелочной
раствор комплексного соединения
двухвалентной меди с виннокислой солью.
В пробирке к 1мл 1%-го раствора глюкозы (или фруктозы) приливают равный объъем фелинговой жидкости и смесь нагревают до кипения. Образуется красный осадок оксида меди(I).
Фелинговой жидкостью пользоваться значительнее удобнее, чем отдельно взятыми щелочью и медным купоросом. При нагревании ее не образуется оксид меди (II), который мог бы маскировать красный осадок оксида меди (I). Этот реактив широко применяют также и для количественного определения моносахаридов.
Восстановление оксида серебра. В две чистые пробирки наливают по 3 – 4 мл аммиачного раствора оксида серебра, в одну из них добавляют 2 мл 1%–го раствора глюкозы, в другую 2 мл 1%-го раствора фруктозы. Обе пробирки ставят в нагретую (70 – 800) водяную баню. Через 5 – 10 мин на стенках пробирки появляется зеркало.
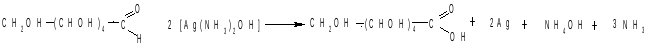
При нагревании в слабощелочной среде в присутствии веществ, способных связывать водород (акцепторы водорода), моносахариды через стадию образования гидратной формы способны окислятся путем дегидрирования с образованием соответствующей кислоты.
Опыт № 3. Осмоление моносахаридов
При нагревании моносахаридов с концентрированными растворами щелочей происходит распад моносахаридов с образованием целого ряда соедигений, а также смолистых веществ.
При действии разбавленных щелочей на моносахариды происходит их енолизация с последующим превращением в эпимеры и в соответствующие кетозы. При нагревании же с концентрированными щелочами, кроме енолизации, происходит их окисление и распад с образованием в дальнейшем продуктов полимеризации и конденсации. Среди продуктов распада обнаружены молочная и муравьиная кислоты и другие вещества.
В пробирку кладут несколько кипятильников и наливают 1 – 2 мл 10 %– го раствора глюкозы (или фруктозы) и такой же объем 30 - 40% – го раствора щелочи. При кипячении смеси (осторожно, жидкость вскипает толчками) раствор сначала желтеет, затем окрашивается в бурый цвет, появляется запах жженого сахара.
Опыт № 4. Реакция на пентозы
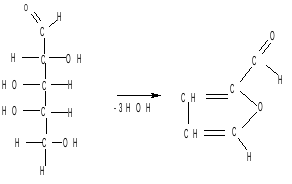
В пробирку берут несколько крупинок арабинозы или другой пентозы, приливают 2мл соляной кислоты (1: 1) и смесь непродолжительно кипятят. У отверстия пробирки держат фильтровальную бумажку, смоченную уксуснокислым анилином, или наливают в пробирку 1 – 2 мл анилина. Появляется интенсивное красное окрашивание раствора (или анилиновой бумажки).
При нагревании с кислотой молекула пентозы отщепляет три молекулы воды, и образуется фурфурол, который конденсируется с анилином с образованием красителя красного цвета.
Опыт № 5. Реакция на кетогексозы Селиванова
При нагревании с соляной кислотой
кетогексоза (фруктоза) превращается в
оксиметилфурфурол, который с резорцином
образует соединение красного цвета.
Альдозы также дают эту реакцию, но
реакция у них протекает медленнее и при
создании определенных условий (температуры
и кислотности среды) не протекает тот
период времени, который достаточен для
фруктозы.
В две пробирки наливают по 3 мл реактива Селиванова (0,05 г резорцина в 100 мл разбавленной (1:1) соляной кислоты); в одну из них
оксиметилфурфурол
прибавляют 3 капли 1%-го раствора фруктозы, в другую – 3 капли 1%–го раствора глюкозы. Обе пробирки помещают в баню, нагревают до 80оС и при этой температуре нагревают 8 мин (время, достаточное для развития окраски фруктозы). В пробирке с фруктозой появляется красное окрашивание.
Опыт № 6. Окисление дисахаридов
В зависимости от способа связи моносахаридов в молекулах дисахаридов они проявляют разную способность к окислению.
В три пробирки наливают по 2 – 3 мл 1%–х растворов сахарозы, мальтозы и лактозы. В каждую пробирки пробирку прибавляют равный объем фелинговой жидкости и все пробирки нагревают до начинающегося кипения. В пробирке с сахарозой восстановления меди не наблюдается, в двух других появляются осадки оксида меди (I).
Необходимо написать структурные формулы сахарозы, мальтозы и лактозы. Исходя из этих формул следует объяснить различное взаимодействие дисахаридов с гидроксидом меди (II). Составьте с уравнения реакций окисления мальтозы и лактозы.
Опыт № 7. Осмоление дисахаридов
Наливают в одну пробирку раствор сахарозы, в другую раствор мальтозы и лактозы. В каждую пробирку добавляют равный объем 40%–го раствора NaOH и бросают несколько кипятильников. Смесь нагревают. В пробирке с мальтозой или лактозой наблюдается побурение раствора, раствор сахарозы не изменяется от строения его молекулы: к осмолению способны дисахариды, имеющие в молекуле полуацетальный гидроксил.
Опыт № 8. Реакция полисахаридов с фелинговой жидкостью.
К раствору крахмального клейстера и к раствору гликогена прибавляют равные объемы фелинговой жидкости и нагревают до начинающегося кипения. Растворы не изменяются. В молекулах крахмала и гликогена, образованных очень большим количеством соединенных друг и другом остатков глюкозы (от 200 до 6000 и более), имеется всего только по одному свободному гликозидному гидроксилу. Альдегидная группа, образующаяся за счет этого гидроксила имеет очень малый относительный вес по сравнению со всей молекулой. Можно только с помощью особо чувствительных реакций обнаружить способную к окислению альдегидную группу (например, динитросалициловой кислотой).
Опыт № 9. Реакция крахмала и гликогена с йодом
К 2 – 3 мл раствора крахмального клейстера прибавляют несколько капель раствора йода в йодиде калия, разбавленного водой до образования раствора с желтой окраской. Появляется характерное для крахмала синее окрашивание. При нагревании раствора синяя окраска исчезает, при охлаждении раствора – появляется снова.
К 1мл раствора гликогена прибавляют 1 – 2 капли раствора йода в йодиде калия, появляется красно – бурное окрашивание.
Появление окраски при действии йода объясняют образованием молекулярных комплексных соединений йода с полисахаридами, а также и адсорбцией йода разветвленными молекулами амилопектина и гликогена.
Опыт № 10. Получение и свойства азотнокислых эфиров целлюлозы (нитроцеллюлозы)
Клетчатка при взаимодействии со смесью концентрированных азотной и серной кислот образует азотнокислые эфиры по свободным гидроксильным группам. В каждом остатке глюкозы в молекуле целлюлозы содержится три гидроксильные группы. При полной этерификации целлюлозы образуется тринитрат целлюлозы:
![]()
Степень этерификации определяют по проценту азота в полученном нитрате. При полной этерификации образуется эфир с 14,1% азота (пироксилин), при этерификации двух гидроксильных групп получают нитрат с 11,1% азота (коллоксилин).
Получение нитрата целлюлозы. В стакане готовят смесь 3 мл концентрированной азотной кислоты (1,4 г/см3) и 6 мл концентрированной серной кислоты (1,84 г/см3). Разогревшуюся смесь охлаждают до комнатной температуры и погружают в нее на 6 – 7 мин небольшой комочек ваты, перемешивая его стеклянной палочкой. Через 6 – 7 мин вату вынимают и сначала прмывают водой в стакане или в чашке, а после этого в струе воды под водопроводным краном. Отжимают избыток воды и, тщательно разрыхлив вату, высушивают ее в фарфоровой чашке на кипящей водяной бане. При указанных здесь условиях нитрования образуется по преимуществу коллоксилин.
Горение нитроклетчатки.Нитрованная клетчатка обладает значительно большей скоростью горения, чем исходная вата. На асбестовой сетке поджигают кусочек ваты и кусочек нитроклетчатки. Вата горит медленно, нитроклетчатка сгорает моментально.
Взрыв нитроклетчатки.На дно пробирки помещают небольшой комок нитроклетчатки. При нагревании пробирки на горелке нитроклетчатка разлагается со взрывом и вылетает из пробирки (отверстие пробирки повернуть от соседа).
Приготовление коллодия.Коллоксилин растворяется в смеси этилового спирта и диэтилового эфира (1:3) с образованием коллодия.
В пробирку к 2 мл смеси спирта и эфира вносят кусочек коллоксилина и, помешивая стеклянной палочкой, наблюдают сначала набухание, а затем и растворение нитроклетчатки. Вылить часть полученного коллодия на стеклянную пластинку. После испарения спирта и эфира остается пленка коллоксилина. При внесении ее в пламя (щипцами) она сгорает, по медленнее, чем взятая в виде ваты.
