
Билет № 26.
Кажущаяся степень диссоциации. Изотонический коэффициент. Законы Рауля и Вант-Гоффа для растворов электролитов.
Электролиз растворов и расплавов. Поляризация электродов. Перенапряжение. Потенциал разложения.
Химическая термодинамика. Изохорный тепловой эффект химической реакции. Внутренняя энергия.
Определить молярную концентрацию вещества в растворе, содержащем 5,85 г хлорида натрия в 200 см3раствора.
Используя справочные данные по ΔfН0(298К) иS0(298K) веществ определить температуру, при которой константа равновесия реакцииC(графит)+H2O(г)<=>CO(г) +H2(г)равна единице. Записать выражение для константы равновесия данной реакции.
6. Назвать следующие химические соединения и определить степень окисления всех элементов соединений: K2O, Mg(OH)2, HBr, Na3BO3, Fe(HCO3)2, AlOHCl2
Написать формулы следующих химических соединений: оксид железа (III), гидроксид меди (I), гидроортофосфат натрия, сульфат гидроксоцинка.
7.Определить произведение растворимости SrF2, если его растворимость в воде при 250С равна 0,85·10-3моль/л.
8
 .
Уравнять реакцию. Указать окислитель
и восстановитель:
.
Уравнять реакцию. Указать окислитель
и восстановитель:
HgCl2
+ FeCl2
![]() Hg
+ FeCl3
Hg
+ FeCl3
Определить направление протекания и константу равновесия
реакции при стандартных условиях.
Заведующий кафедрой химии профессор Яглов В.Н._______________
Утверждено на заседании кафедры «_____» _____________ г.
Протокол № ________
Лектор
Билет № 27.
Массовая и молярная доля растворенного вещества. Плотность раствора, титр раствора вещества.
Химическое равновесие в гомогенных и гетерогенных системах. Константа равновесия и ее связь с термодинамическими функциями.
Реакции окисления-восстановления. Метод электронного баланса. Молярные массы эквивалентов окислителей и восстановителей.
Стандартная энтальпия сгорания метилового спирта (СН3ОН) равна ( - 726,64 кДж/моль). Определить стандартную энтальпию образования метилового спирта.
5.Определить давление насыщенного пара над 5,0%-ным водным раствором глицерина (С3Н8О3) при 323К, если давление насыщенного пара над водой при этой же температуре равно 12,3 кПа.
6. Вычислить рН 0,01 М раствора гидроксида аммония.
7. Вычислить массовую долю оксида олова (II) в смеси с оловом, если при взаимодействии 18,5 г смеси с водным раствором щелочи выделилось 2 л водорода (н.у.).
8. Используя справочные данные по DfHo(298 К, В) и So(298 К, В), вычислить изменение энергии Гиббса реакции и сделать вывод о возможности протекания реакции
4HCl (r) + O2(г) = 2Cl2(г) + H2O (г) при температуре 400К.
Заведующий кафедрой химии профессор Яглов В.Н._______________
Утверждено на заседании кафедры «_____» ____________ г.
Протокол № ________
Лектор
Билет № 28.
1. Методы определения молярных масс газообразных веществ. Парциальное давление газа. Закон Дальтона.
2. Законы Рауля и Вант-Гоффа для растворов не электролитов.
3. Законы Фарадея. Выход по току.
4. Рассчитать константу равновесия в реакции цементации, протекающей при стандартных условиях, используя значения стандартных окислительно-восстановительных потенциалов.
Hg(NO3)2 + Mn < = > Mn(NO3)2 + Hg
5. Вычислить жесткость воды, если в 600 л её содержится 60,0 мг ионов магния и 80,0 мг ионов кальция.
6. Энергия активации некоторой реакции равна 60 кДж/моль. Во сколько раз изменится скорость реакции при повышении температуры от 300 К до 330 К?
7. Растворимость SrF2 в воде равна 0,887∙10-3 моль/л. Найти произведение растворимости данного вещества.
8. Составить уравнения реакций, с помощью которых можно осуществить указанные превращения и расставить коэффициенты.

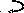
 Mg
(HSO4)2
Mg
(HSO4)2



 Mg
MgSO4
Mg(OH)2
MgSO4
Mg
MgSO4
Mg(OH)2
MgSO4
(MgOH)2SO4
Заведующий кафедрой химии профессор Яглов В.Н._______________
Утверждено на заседании кафедры «_____» _____________ г.
Протокол № ________
Лектор
