
Билет № 6.
Кажущаяся степень диссоциации. Изотонический коэффициент. Законы Рауля и Вант-Гоффа для растворов электролитов.
Электролиз растворов и расплавов. Поляризация электродов. Перенапряжение. Потенциал разложения.
Химическая термодинамика. Изохорный тепловой эффект химической реакции. Внутренняя энергия.
Определить моляльность вещества в растворе, если в 100 г этого раствора содержится 5,3 г Na2CO3.
5. Вычислить жесткость воды, если в 10 литрах её содержится 1,0 г ионов кальция и 0,6 г ионов магния?
6. Рассчитать константу равновесия в реакции цементации, протекающей при стандартных условиях.
2AgNO3 + Fe < = > Fe(NO3)2 + 2Ag
7 По уравнению Гиббса рассчитайте
адсорбцию ПАВ на поверхности раздела
жидкость–газ в водном растворе ПАВ с
концентрацией
![]() =
0,05 М, если поверхностная активность его
равна
=
0,05 М, если поверхностная активность его
равна![]() = –13,5·10–3Дж·м/моль. Температура
раствора
= –13,5·10–3Дж·м/моль. Температура
раствора
298 К.
8. Составить схему ГЭ, в котором протекает химическая реакция 2Ag0 + Hg2+ = 2Ag+ + Hg0. Написать уравнения электродных процессов. На основании стандартных значений энергий Гиббса образования ионов ∆f G0 (298K, Меn+) рассчитать стандартное напряжение ГЭ и константу равновесия реакции при 298К.
∆f G0 (298K, Ag+) = 77,11 кДж/моль;
∆f G0 (298K, Hg2+) = 164,77 кДж/моль
Заведующий кафедрой химии профессор Яглов В.Н._______________
Утверждено на заседании кафедры «_____» ____________ г.
Протокол № ________
Лектор
Билет № 7.
Массовая и молярная доля растворенного вещества. Плотность раствора, титр раствора вещества.
Химическое равновесие в гомогенных и гетерогенных системах. Константа равновесия и ее связь с термодинамическими функциями.
Аккумуляторы (щелочные и кислотные).
Стандартная энтальпия сгорания метилового спирта (СН3ОН) равна (- 726,64 кДж/моль). Определить стандартную энтальпию образования метилового спирта.
Закончить уравнение реакции и уравнять ее пользуясь
 методом
электронного баланса. Указать окислитель
и восстановитель: а)Fe
+ HNO3
конц .
методом
электронного баланса. Указать окислитель
и восстановитель: а)Fe
+ HNO3
конц .
 б)
С + H2SO4
конц.
б)
С + H2SO4
конц.

Вычислить рН 0,02М раствора фтороводородной кислоты (HF).
Вычислить температуры кипения и замерзания раствора, содержащего 0,1 моль сахарозы (

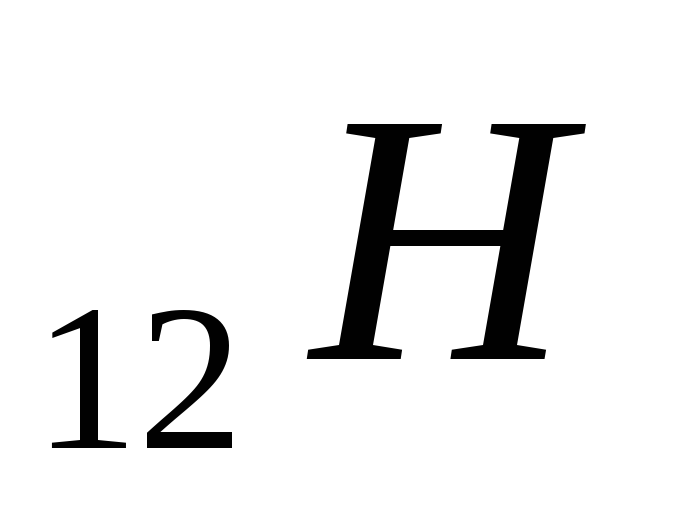
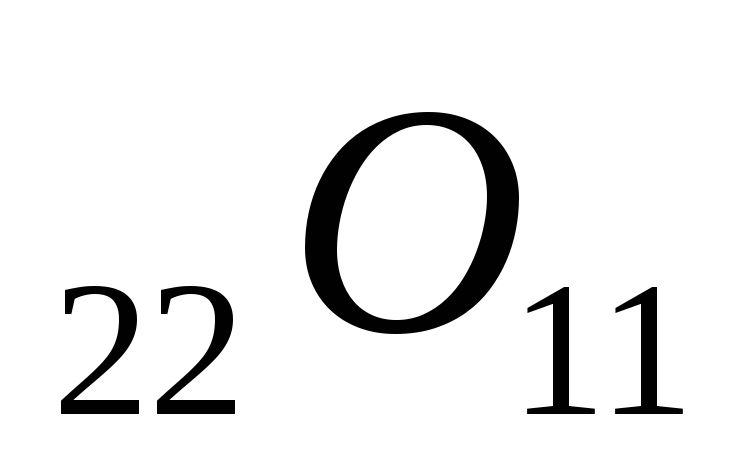 )
в 1000 г раствора.
)
в 1000 г раствора.Установить формулу кристаллогидрата СаSO4∙ nH2O, если в результате прокаливания его масса изменилась от 7,8 г до 6,0 г. Определить объем выделившейся парообразной воды при температуре 200оС и давлении 83,2 кПа.
Заведующий кафедрой химии профессор Яглов В.Н._______________
Утверждено на заседании кафедры «_____» _____________ г.
Протокол № ________
Лектор
Билет № 8.
Растворы. Молярная концентрация растворенного вещества. Молярная концентрация эквивалентов растворенного вещества. Моляльность.
Зависимость скорости реакции от концентрации реагирующих веществ. Средняя и истинная скорость реакции. Константа скорости реакции 1-го порядка.
Гальванические элементы, напряжение гальванических элементов.
Рассчитать изменение стандартных энтальпий и энтропий химической реакции: Fe2O3 (к)+ 3Н2 (г)= 2Fe (k)+ 3H2O(ж).
5. Вычислить массовую долю оксида бериллия в смеси с бериллием, если при взаимодействии 9 г смеси с водным раствором щелочи выделилось 5,8 л водорода (н.у.).
6. Определить произведение растворимости Ag2SO4, если его растворимость в воде при 250С равна 1,62·10-2 моль/л.
7. Вычислить общую жесткость воды, если в 5 литрах воды содержится 38 мг ионов Mg2+ и 108 мг ионов Са2+?
8.Определить давление насыщенного пара над 0,06 М раствором нитрата алюминия ( ρ р-ра= 1,034 г/см3) , при 307 К, если давление насыщенного пара над водой при этой температуре равно 5,318 кПа. Кажущаяся степень диссоциации равна 0,85.
Заведующий кафедрой химии профессор Яглов В.Н._______________
Утверждено на заседании кафедры «_____» ____________ г.
Протокол № ________
Лектор
