
Билет № 9.
Законы Рауля и Вант-Гоффа для растворов неэлектролитов.
Коррозия металлов. Химическая и электрохимическая коррозия металлов.
Кислоты и основания. Классификация. Свойства. Номенклатура.
Сколько граммов FeCl3 содержится в 2 литрах 0,1 М раствора?
5. Рассчитать константу равновесия в реакции цементации, протекающей при стандартных условиях.
2AgNO3 + Fe < = > Fe(NO3)2 + 2Ag
6. Растворимость Ag2SO4 воде равна 1,4∙10-2 моль/л. Найти произведение растворимости данного соединения.
7.Стандартная энтальпия сгорания метилового спирта (СН3ОН) равна (- 726,64 кДж/моль). Определить стандартную энтальпию образования метилового спирта.
8. На основании принципа Ле-Шателье определить, в каком направлении сместится равновесие в следующей системе:
2SO![]() +O
+O![]()
![]() 2SO
2SO![]()
![]()
![]() =
- 284,2кДж
при
=
- 284,2кДж
при
понижении температуры
повышении концентрации SO
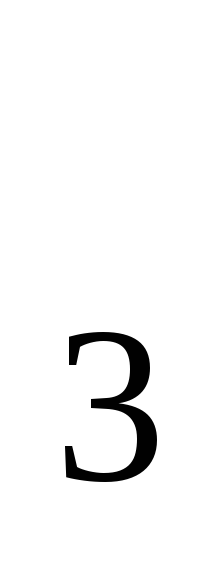
понижении давления
Записать выражение константы равновесия реакции.
Заведующий кафедрой химии профессор Яглов В.Н._______________
Утверждено на заседании кафедры «_____» _____________ г.
Протокол № ________
Лектор
Билет № 10.
Соли. Классификация. Свойства. Номенклатура.
Физические и химические свойства воды. Диаграмма состояния воды.
Последовательность электродных процессов на аноде и катоде при электролизе растворов. Схемы электролиза растворов и расплавов c инертными электродами и растворимым анодом.
4. Определить температуру, при которой возможен карботермический процесс, используя значения термодинамических данных:
FeO(к) + C(к) < = > Fe(к) + CO(г)
5. Вычислить рН 0,05 М водного раствора хлорноватистой кислоты.
6. Энергия активации некоторой реакции в отсутствие катализатора равна 86,0 кДж/моль, а с катализатором – 62,0 кДж/моль. Во сколько раз возрастает скорость реакции в присутствии катализатора, если реакция протекает при температуре 298 К?
7. Определите энергию Гиббса
![]() поверхности капель водяного тумана
массойm= 7 г при 288 К, если
поверхностное натяжение воды
поверхности капель водяного тумана
массойm= 7 г при 288 К, если
поверхностное натяжение воды![]() =73,48·10–3Дж/м2, плотность воды
=73,48·10–3Дж/м2, плотность воды![]() = 0,997 г/см3, дисперсность частицD= 60 мкм–1.
= 0,997 г/см3, дисперсность частицD= 60 мкм–1.
8. Определить объем 30%-го раствора азотной кислоты плотностью 1,180 г/см3, необходимого для приготовления 2 л 0,1 М раствора данного вещества. Пояснить процесс приготовления раствора.
Заведующий кафедрой химии профессор Яглов В.Н._______________
Утверждено на заседании кафедры «_____» ____________ г.
Протокол № ________
Лектор
Билет № 11.
Кислоты и основания. Классификация. Свойства. Номенклатура.
Скорость химических реакций. Средняя и истинная скорость реакций. Зависимость скорости реакции от концентрации реагентов. Константа скорости 1-го порядка.
Показатели коррозии (весовой, объемный и глубинный). Методы защиты от коррозии.
Рассчитать изменение стандартных энтальпий и энтропий химической реакции: Al2O3 (k) + 3C (гр) = 2Al (k) + 3CO (г) .
Растворимость SrF2 в воде равна 0,887∙10-3 моль/л. Найти произведение растворимости данного вещества.
Вычислить температуры кипения и замерзания раствора, содержащего 0,1 моль сахарозы (

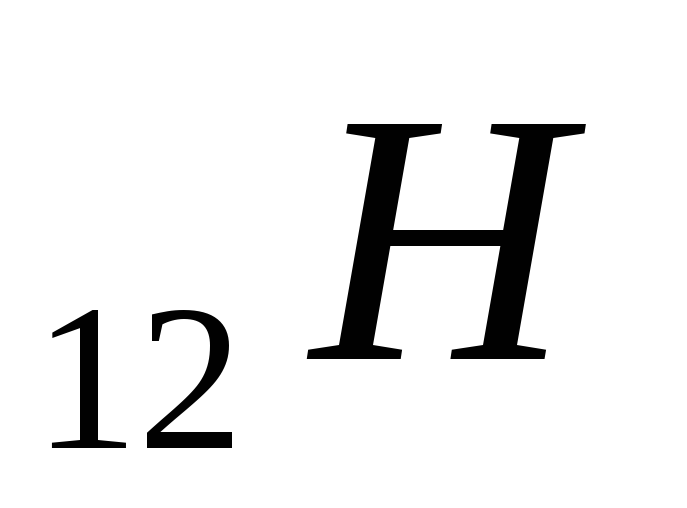
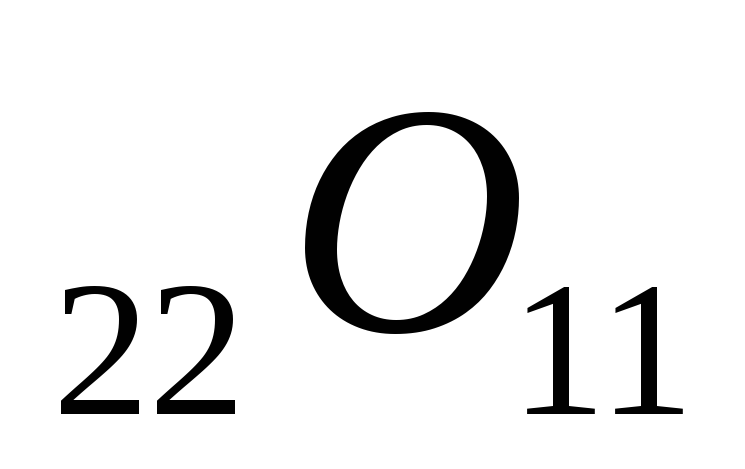 )
в 1000 г раствора.
)
в 1000 г раствора.
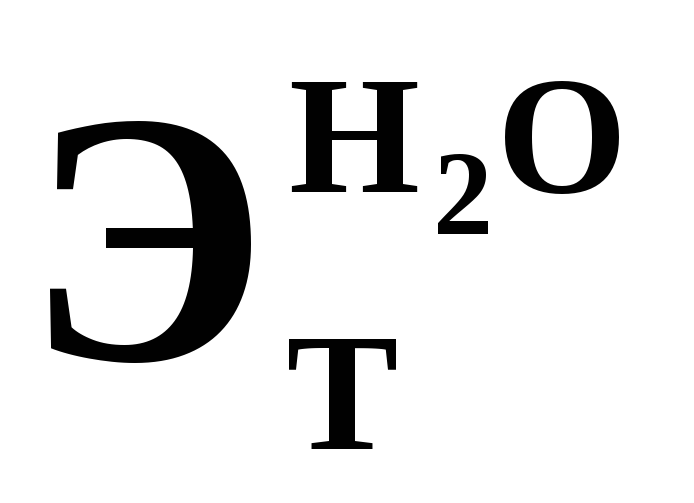 = 0,52 кг·К/моль
= 0,52 кг·К/моль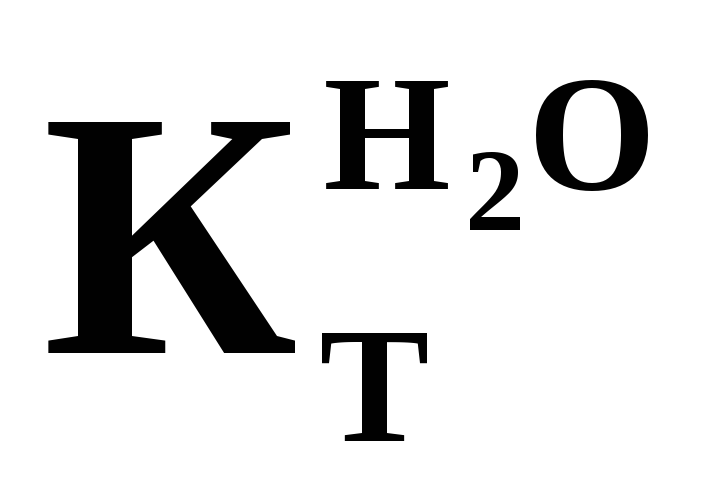 = 1,86 кг·К/моль
= 1,86 кг·К/мольОпределить заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях: K[AuBr4] , [Pt(NH3)Cl]Cl3 , [Cr(H2O)3F3]. Написать уравнения диссоциации этих соединений в водных растворах.
8. Определить молярную концентрацию эквивалента раствора Cu(NO3)2 , если для выделения всей меди из 100 мл раствора потребовалось пропустить ток силой 7 А в течение 30 мин. Составить схему электролиза и написать уравнения электродных процессов. Анод инертный.
Заведующий кафедрой химии профессор Яглов В.Н._______________
Утверждено на заседании кафедры «_____» _____________ г.
Протокол № ________
Лектор
