
Тут есть жесткость воды
.pdf
с повышением температуры растёт скорость процесса, но снижается равновесный выход. Поэтому нужно выбрать оптимальную температуру, при которой и выход продукта, и скорость процесса удовлетворительны. На практике обратимую экзотермическую реакцию начинают вести при высокой температуре и в ходе процесса снижают. Высокая температура в начале процесса обеспечивает высокую скорость реакции. При этом превращается основное количество исходных веществ. Снижение температуры в конце процесса уменьшает скорость реакции, но позволяет получить большой выход продукта.
Влияние давления. Давление влияет на скорость гомогенных процессов, протекающих в газовой фазе, особенно с уменьшением объёма. С увеличением давления пропорционально растут концентрации реагирующих веществ, а, следовательно, и скорость процесса в целом. Для необратимой реакции влияние давления зависит от порядка реакции:
где β – коэффициент, зависящий от константы скорости реакции концентраций реагирующих веществ, n – порядок реакции. Таким образом, чем выше порядок реакции, тем целесообразнее применять давление.
Повышение давления выгодно ещё и потому, что позволяет уменьшить диаметр трубопроводов, размеры аппаратов, но при этом нужно увеличивать толщину их стенок. Давление на скорость реакций в растворах влияет очень мало.
Влияние перемешивания. Для большинства газовых реакций перемешивание не влияет на скорость процесса, так как каждая молекула газа в обычных условиях и без перемешивания испытывает огромное число столкновений в секунду. Для жидких гомогенных систем, в которых молекулярная диффузия происходит медленнее, перемешивание служит эффективным способом увеличения константы скорости реакции и общей скорости процесса.
3.6.ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ГЕТЕРОГЕННЫХ НЕКАТАЛИТИЧЕСКИХ ПРОЦЕССОВ
3.6.1. Общая характеристика гетерогенных процессов
Большинство химических реакций, используемых в химико-технологических процессах, протекает с участием веществ, находящихся в разных фазах. По виду участвующих в процессе фаз различают следующие гетерогенные процессы:
газ - твердое; к этому типу процессов относятся адсорбция и десорбция газов, возгонка, обжиг руд, окисление металлов, восстановление твердых оксидов, горение твердых топлив;
жидкость – твердое; адсорбция, растворение, выщелачивание, кристаллизация;
газ – жидкость; абсорбция, десорбция из жидкости, концентрирование растворов испарением растворителя, конденсация, перегонка жидких смесей - дистилляция, ректификация;
несмешивающаяся система жидкость – жидкость; экстракция, эмульгирование;
твердое – твердое; спекание, процессы получения цемента и керамики, высокотемпературный синтез неорганических материалов;
многофазные системы газ – жидкость – твердое и др.
Механизм гетерогенных процессов сложнее, чем механизм гомогенных процессов. Особенностью гетерогенных процессов является то, что прежде чем произойдёт химическая
100

реакция, должен осуществиться перенос реагентов из одной фазы к поверхности раздела фаз или в объём другой фазы. Перенос вещества происходит в результате диффузии, абсорбции, адсорбции, испарения и т.п. Гетерогенные процессы протекают на поверхности соприкосновения реагирующих фаз.
Сами по себе химические реакции могут протекать гомогенно, т.е. внутри одной из фаз, или гетерогенно, т.е. на границе раздела фаз. На границе раздела фаз протекают реакции между компонентами, один из которых находится в твёрдой фазе, а другой в газовой, жидкой или отдельной твёрдой фазе. Например, гетерогенным будет взаимодействие кислорода с твёрдым углем при горении угля. Реакция же окисления кислородом жидких углеводородов протекает как гомогенная, хотя реагенты и находятся в разных фазах. Жидкие горючие сгорают в паровой фазе, а гетерогенной в этом случае будет не химическая реакция, а предшествующая ей диффузионная стадия испарения жидкости с её зеркала.
Итак, гетерогенные процессы протекают в несколько стадий, Скорости отдельных могут существенно различаться и по-разному зависеть от изменения параметров технологического режима. Например, температура неодинаково влияет на скорости химической реакции и диффузии.
Под скоростью гетерогенного химического процесса понимают количество одного из реагентов или продуктов реакции, которое прореагирует или образуется в единицу времени на единице поверхности раздела фаз:
где i – стехиометрический коэффициент i-го реагента или продукта; F – реакционная поверхность.
Уравнение скорости гетерогенного ХТП можно записать и следующим образом:
где К – коэффициент массопередачи (зависит от химической природы и физических характеристик реагентов, их агрегатного состояния, гидродинамики процессов, конструкции реактора и др.); Fуд – удельная поверхность контакта фаз, приходящаяся на единицу объёма или массы; С – движущая сила процесса (разность концентраций, давлений).
При анализе гетерогенных процессов выделяют два случая. В первом случае скорость химической реакции больше скорости диффузии, следовательно, диффузия будет лимитирующей стадией, и процесс протекает в диффузионной области. Во втором случае скорость химической реакции мала по сравнению со скоростью диффузионных процессов, и лимитирующей стадией будет химическая реакция. Такие гетерогенные процессы протекают в кинетической области.
Многие гетерогенные процессы не связаны с химическими реакциями и основаны только на физико-химических явлениях. К таким процессам можно, например, отнести испарение, конденсацию, перегонку, растворение, экстрагирование, не сопровождающиеся химическими реакциями.
Газ и жидкость представляют собой текучие фазы с подвижной поверхностью. Это позволяет для построения моделей химического процесса всё многообразие гетерогенных систем свести к двум видам: газ (жидкость) – твёрдое (взаимодействие текучей и жёсткой фаз) и газ (жидкость) – жидкость (взаимодействие текучих фаз).
101

3.6.2. Гетерогенные процессы в системе газ (жидкость) - твёрдое вещество
Гетерогенные процессы в системе газ – твёрдое вещество очень распространены в промышленности. К ним относятся процессы горения твёрдых топлив, обжига различных руд, получения цемента. Системы газ - твердое встречаются при поглощении газоили парообразных компонентов из газовых или паровых смесей твердыми поглотителями (адсорбция). Разновидностью данного процесса является ионообмен. Сюда же можно отнести процесс сушки твердых влажных материалов путем испарения содержащейся в них влаги при непосредственном контакте с потоком горячего газа; здесь происходит переход влаги из твердой фазы в газообразную.
С системами жидкость – твердое вещество мы встречаемся в процессах кристаллизации, т. е. выделения твердых веществ из растворов и расплавов, а также при извлечении растворенных веществ твердыми поглотителями (адсорбция).
Рис. 3.6. Изменения частицы твёрдого вещества по мере её взаимодействия с газом или жидкостью. 1
– состояние частицы до реакции; 2 – не полностью прореагировавшая частица; 3 – полностью прореагировавшая частица, сохранившая размеры, прочность и твёрдость; 4 - образование в ходе реакции опадающей в виде хлопьев золы или газообразных продуктов приводит к уменьшению размеров частицы; частица уменьшается в объёме и исчезает после реакции.
На рис. 3.6 показаны изменения твёрдой частицы в ходе реакции. Если твёрдая частица реагента переходит в твёрдый продукт или содержит большое количество примесей, остающихся в конце процесса в виде золы, то такая частица в ходе реакции практически не меняется в размерах (рис. 3.6. схема А). Например,
2ZnS(тв) +3О2(газ) → 2ZnO(тв) + 2SO2(газ)
Если твёрдая частица в ходе реакции полностью превращается в газообразные или жидкие продукты, то она уменьшается в размерах и исчезает после реакции (рис.3.6. схема В). Например,
С(тв) + О2(газ) → СО2(газ)
Для описания гетерогенных процессов в системе газ - твёрдое вещество используют кинетические модели. Наиболее распространёнными являются квазигомогенная модель и модель с фронтальным перемещением зоны реакции (модель с непрореагировавшим ядром). Рассмотрим эти модели на примере гетерогенной реакции
102

Квазигомогенная модель основана на представлении, что внешний газ проникает внутрь частицы и взаимодействует с веществом во всём объёме твёрдой частицы. Это возможно, если газообразный реагент может достаточно свободно проникнуть внутрь твёрдой фазы, т.е. если частица твёрдого вещества пронизана большим числом пор, а химическая реакция, протекающая на поверхности этих пор, достаточно медленная. Внутренняя поверхность твёрдой частицы намного больше наружной, и реакция происходит в основном на внутренней поверхности. При этом скорость реакции одинакова на различных участках частицы. Таким образом, всё вещество постепенно превращается в продукты реакции.
Рис. 3.7. Схематическое изображение твердой частицы в ходе гетерогенного процесса, описываемого квазигомогенной моделью: 1 – до реакции; 2 – почти полностью превращенная частица; С - концентрация твёрдого реагента в частице; R – радиус частицы.
На рис. 3.7. показано, как изменяется по объёму твёрдой фазы в разные моменты времени от начала реакции концентрация твёрдого реагента В, если процесс протекает в соответствии с квазигомогенной моделью. Эта модель достаточно хорошо отражает явления, протекающие при очень медленных реакциях, в которых участвуют сильно пористые тела.
Рис. 3.8. Профиль изменения концентрации твёрдого реагента В по мере протекания гетерогенного процесса, описываемого моделью с фронтальным перемещением зоны реакции: а – до реакции; б – промежуточный момент реакции; в – почти полностью превращённая частица. 1- низкая степень превращения; 2- зола; 3- невзаимодействующее ядро частицы; 4- зона реакции; 5- высокая степень превращения; C – концентрация твердого реагента в частице; R – радиус частицы.
Модель с фронтальным перемещением зоны реакции. Согласно этой модели химическая реакция протекает на внешней поверхности частицы. Зона реакции постепенно продвигается
103
внутрь частицы с образованием твердых и газообразных продуктов реакции. В произвольный момент времени твердая частица представляет собой внутреннее ядро, окруженное внешней оболочкой.
Ядро состоит из непрореагировавшего реагента (поэтому эту модель называют ещё моделью с непрореагировавшим ядром). Окружающая его оболочка состоит из твердого продукта и инертных веществ, условно называемых "золой". Следовательно, в любой момент имеется невзаимодействующее ядро твердого материала, размер которого в ходе реакции постепенно уменьшается (рис. 3.8.).
Простое наблюдение за процессом горения угля, дров, брикетов, а также туго свернутого рулона бумаги дает представление о модели частицы с невзаимодействующим ядром. Эта модель является более распространённой, чем квазигомогенная модель.
Гетерогенный процесс, описываемый моделью с фронтальным перемещением зоны реакции, можно разделить на пять элементарных стадий:
1)внешняя диффузия – подвод газообразного реагента А из потока газа к поверхности твёрдой частицы;
2)внутренняя диффузия – проникновение газообразного реагента через поры твёрдого продукта реакции (золы) к ядру твёрдого реагента;
3)собственно химическая реакция на поверхности непрореагировавшего ядра;
4)внутренняя диффузия газообразных продуктов реакции через слой твёрдых продуктов (золы) обратно к поверхности частицы;
5)внешняя диффузия газообразных продуктов реакции через пограничный слой газа в основную массу газового потока.
Вреальных условиях некоторые из указанных стадий обычно отсутствуют. Если, например, не образуется газообразных продуктов, и если реакция необратима, то две последние стадии можно исключить из рассмотрения.
Любая из этих стадий при определённых условиях может оказаться лимитирующей. Если лимитирующей является внешняя диффузия, то процесс протекает во внешнедиффузионной области. Если лимитирующей является внутренняя диффузия, то процесс протекает во внутридиффузионной области. Если лимитирующей является химическая реакция, то процесс протекает в кинетической области. Если скорости диффузии и химической реакции соизмеримы, то процесс протекает в переходной области.
Для воздействия на гетерогенный процесс важно выяснить лимитирующую стадию, т.е. определить область протекания ХТП.
3.6.3. Способы интенсификации гетерогенных процессов в системе газ - твёрдое вещество
Исходя из модели частицы с непрореагировавшим ядром, рассмотрим три случая взаимодействия, когда процесс лимитируется внешней диффузией, внутренней диффузией, либо скоростью химической реакции.
Задача состоит в том, чтобы установить влияние различных факторов на интенсивность процесса. В данном случае интенсивность процесса характеризуют временем τ, в течение которого сферическая частица твердого реагента В первоначального радиуса Ro прореагирует настолько, что ее радиус станет равным R, или же прореагирует полностью, когда R = 0.
104

Процессы, протекающие во внешнедиффузионной области. При протекании процесса во внешнедиффузионной области лимитирующей стадией является массопередача реагентов из потока газа к наружной поверхности раздела фаз. Массопередача (перенос вещества) осуществляется в результате конвекции (движения масс газа) и молекулярной диффузии (теплового движения молекул).
Признаки протекания процесса во внешнедиффузионной области:
сильное влияние скорости потока или интенсивности перемешивания на скорость процесса;
слабое влияние температуры на скорость процесса.
На рис. 3.9. а изображен профиль изменения концентрации газообразного реагента А, отвечающий протеканию процесса во внешнедиффузионной области.
Рис. 3.9. Профиль изменения концентрации газообразного реагента А Изменение концентрации газообразного реагента А в ходе реакции лимитируемой: а – внешней
диффузией; б – внутренней диффузией; в – химической реакцией. 1 – пограничная газовая плёнка, окружающая частицу, с концентрацией реагента А ниже, чем в газовом потоке; 2 – слой твёрдых продуктов реакции (зола); 3 – уменьшающееся ядро непрореагировавшего реагента В; СА – концентрация вещества А в окружающем газе; R – радиальная координата.
Так как в этом случае стадии, следующие за диффузией реагента А через пограничную газовую пленку не оказывают сопротивления дальнейшему проникновению А через слой твердых продуктов реакции и взаимодействию с ядром реагента В, то можно принять, что концентрация реагента А на поверхности твердой частицы равна нулю и концентрационная движущая сила, равная СА, неизменна в течение всего периода взаимодействия материала частицы с газом.
Скорость диффузии зависит от плотности и вязкости среды, температуры, природы диффундирующих частиц, воздействия внешних сил и т.д. Закономерности диффузионных процессов описываются двумя законами Фика.
Согласно первому закону Фика скорость процесса, равную в этом случае скорости конвективной диффузии, можно выразить уравнением:
105

– скорость конвективной диффузии, т.е. количество газообразного реагента А, перенесённое вследствие конвективной диффузии через единицу поверхности в единицу времени; СА – движущая сила процесса (изменение концентрации реагента А на расстоянии δ – толщины слоя, через который проходит диффузионный поток); β – коэффициент массоотдачи, зависящий от гидродинамики потока
где D – коэффициент молекулярной диффузии.
Повысить скорость внешней диффузии можно, увеличивая движущую силу коэффициент массоотдачи. Для увеличения коэффициента массоотдачи нужно повышать линейную скорость газового потока, обтекающего твёрдую частицу, увеличивать перемешивание реагентов, менять вязкость, плотность и другие физические свойства среды, от которых зависит скорость диффузии.
Процессы, протекающие во внутридиффузионной области. В этом случае лимитирующей стадией является диффузия реагентов или продуктов реакции в порах твёдой частицы.
Признаки протекания процесса во внутридиффузионной области:
сильная зависимость скорости процесса от диаметра частиц твёрдого материала;
незначительное влияние температуры на скорость процесса.
Вэтом случае концентрация газообразного реагента А меняется от СА до нуля на пространстве от внешней оболочки частицы до ядра (рис. 3.9. б).
Скорость внутренней диффузии в соответствии с законом Фика выражается уравнением
(3.42.)
где Dэфф – эффективный коэффициент диффузии, учитывающий пористость твёрдого вещества, извилистость пор и т.д.; ΔR=Ro-R; Ro – начальный внешний радиус твёрдой частицы; R – радиус ядра, уменьшающийся по мере протекания процесса.
Интенсивность процесса, протекающего во внутридиффузионной области, сильно зависит от степени измельчения твёрдого вещества, т.к. радиус частицы входит в уравнение скорости (3.6). Повысить скорость внутридиффузионной стадии можно, уменьшая размер твёрдой частицы (измельчением), а также увеличивая средний диаметр пор и повышая давление (с ростом давления увеличивается движущая сила процесса диффузии СА).
Процессы, протекающие в кинетической области. Лимитирующей стадией является стадия химической реакции, и скорость процесса в целом зависит от её скорости, так как скорости внешней и внутренней диффузии велики.
Признаки протекания процесса в кинетической области:
сильная зависимость скорости процесса от температуры;
независимость скорости процесса от линейной скорости газа и интенсивности перемешивания, а также от размера пор.
106

Если химическая реакция необратима (например, реакция горения твёрдых тел), концентрация газообразного реагента на поверхности ядра уменьшится от исходной концентрации СА до нуля, т.е. до его полного израсходования (рис. 3.8. в).
Скорость поверхностной реакции может быть описана законами химической кинетики:
Скорость химической стадии может быть увеличена либо вследствие возрастания концентрации газообразного реагента (как и в случае предыдущих стадий), либо же, главным образом вследствие роста константы скорости реакции k, что достигается повышением температуры.
3.6.4. Гетерогенные процессы в системе газ-жидкость (газожидкостные реакции)
Процессы, основанные на взаимодействии газообразных и жидких реагентов, широко используются в химической промышленности. С системами газ - жидкость мы встречаемся в процессах выделения из газовых смесей одного или нескольких компонентов путем их растворения в жидкостях (очистка газовых смесей). Этот процесс перехода газовой фазы в жидкую называется абсорбцией; обратный переход называется десорбцией. К газожидкостным процессам относятся испарение жидкостей, перегонка жидких смесей (дистилляция и ректификация), пиролиз жидкостей с испарением продуктов пиролиза, полимеризация в газовой фазе с образованием жидких полимеров и т.п.
Газожидкостные реакции – это гетерогенные процессы, включающие химическое взаимодействие между реагентами, один из которых находится в газовой фазе, а другой – в жидкой.
Жидкость может представлять собой раствор вещества, химически взаимодействующего с газообразным реагентом.
Газожидкостные реакции широко используются в химической технологии. Примеры процессов данного типа:
1)абсорбция газообразного аммиака раствором азотной кислоты в производстве аммиачной селитры
NH3(газ) + HNO3(раствор) → NH4NO3(раствор)
2)абсорбция диоксида углерода водными растворами моноэтаноламина с целью очистки синтез-газа в производстве аммиака
2RNH2(раствор) + Н2О(ж) + СО2(газ) → (RNH3)2СО3(раствор)
(RNH3)2СО3(раствор) + Н2О(ж) + СО2(газ) → 2(RNH3)НСО3(раствор)
3)галогенирование, нитрование, сульфирование углеводородов и многие другие процессы.
Газожидкостные реакции принято рассматривать как процессы абсорбции, сопровождающиеся химическим взаимодействием. В этом случае к ним можно применить закономерности массопередачи.
107
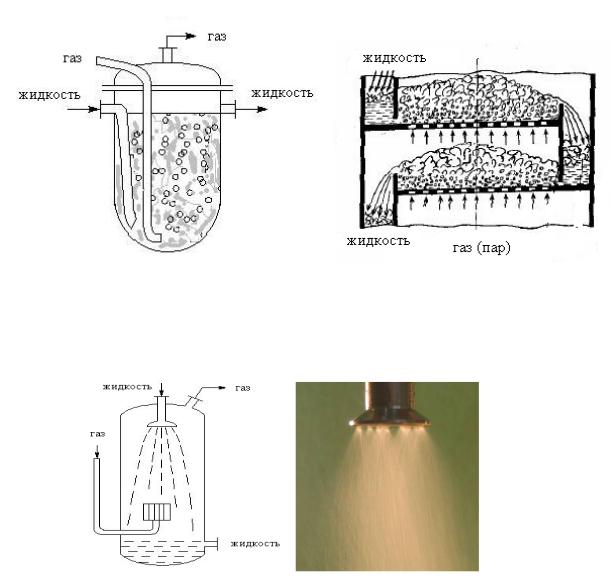
Массопередача между газом и жидкостью
Растворимость газа в жидкости подчиняется закону Генри: концентрация газа, растворённого в жидкости, пропорциональна давлению газа над поверхностью жидкости.
Основными условиями эффективного проведения этих процессов, при которых достигаются высокие степень превращения и селективность, а также устойчивость процесса, являются обеспечение хорошего контакта фаз.
Контакт фаз достигается перемешиванием.
Перемешивание (увеличение поверхности контакта фаз) может осуществляться различными способами:
1)барботаж газа через жидкость (например, в тарельчатых колоннах), газ диспергирован
вжидкости; пузырьки газа служат своеобразными перемешивающими агентами (рис.
3.10);
Рис. 3.10. Барботаж газа (пара) через жидкость
2)распыление жидкости в виде капель или струй в газовом потоке, жидкость диспергирована в газе (рис. 3.11.);
Рис. 3.11. Распыление жидкости
3)плёночное течение; жидкость плёнкой стекает по поверхности, поток газа проходит вдоль неё (рис. 3.12.);
108

Рис. 3.12. Плёночное течение жидкости
4) жидкость стекает по насадке в виде |
5) попутный газожидкостный поток; |
нерегулярной плёнки, газ проходит в |
потоки газа и жидкости движутся в одном |
свободном пространстве насадки (рис. |
направлении (рис. 3.14.); |
3.13.); |
|
Рис. 3.13. Стекание жидкости по насадке |
Рис. 3.14. Попутный газовый поток |
109
